双通道重建在腹腔镜辅助近端胃癌根治术中的应用体会
吴新军,李 岩,薛明辉,陈炳合,魏 勇,朱绍辉,闫争强
(1.新乡医学院第一附属医院胃肠外科,河南 新乡,453100;2.新乡医学院第一附属医院放射科)
近年,食管胃结合部腺癌的发病率呈上升趋势[1-3]。在笔者所处的太行山及毗邻区域的豫北地区,食管胃结合部腺癌占临床胃癌的大多数。对于胃上部癌,胃切除术式的选择、淋巴结清扫范围及消化道重建方式一直是讨论的热点。日本胃癌治疗指南定义的胃癌D2根治术包括全胃切除术与远端胃癌根治术,将包括D1+NO.8a、9、11p的近端胃癌切除术定义为D1+,近端胃癌根治切除术被定义为缩小的非定型治愈性手术[4]。此外,近端胃切除后食管胃吻合常导致胃食管反流,如反酸、烧心等症状及反流性食管炎,因此近端胃切除术实施较少,全胃切除术仍是目前胃上部癌主要的根治性手术方式。近年研究显示[5-6],长径<4 cm的食管胃结合部癌,NO.4、5、6淋巴结转移率极低,对于长径<4 cm的食管胃结合部癌,不论浸润深度,不必行全胃切除术[4],可选择行近端胃切除术。近端胃切除后如何进行消化道重建,以消除食管胃吻合后出现的反流问题,近年学者们设计了多种方案,如空肠间置、食管管状胃吻合、双通道重建及食管残胃双肌瓣吻合等。本研究通过分析57例腹腔镜辅助近端胃切除术后行双通道重建患者的临床资料,以探讨双通道重建对手术过程、功能性效果、术后并发症的影响,现将体会报道如下。
1 资料与方法
1.1 临床资料 2017年11月至2019年8月新乡医学院第一附属医院胃肠外科施行腹腔镜辅助近端胃癌切除、保留远端胃、双通路重建手术57例,其中男46例,女11例;41~73岁,平均(62.4±8.7)岁。入选标准:(1)早期胃上部癌;(2)进展期胃上部癌(包括食管胃结合部腺癌Siewert Ⅱ型、Ⅲ型、非食管胃结合部的胃上部癌),肿瘤长径<4 cm,幽门上、下无肿大淋巴结。
1.2 手术方法 患者平卧取人字位,采用弧形五孔法施术。在腹腔镜监视下,沿横结肠上缘分离大网膜,入网膜囊,完整分离大网膜。沿结肠脾曲及胰尾前方分离胃网膜左血管,于根部结扎切断(图1a)。于胰腺上缘切开胰腺被膜,向右侧清除肝总动脉前方及上方淋巴脂肪组织(NO.8a淋巴结)(图1b)。结扎切断胃左静脉,于腹腔干表面清扫淋巴脂肪组织,根部结扎切断胃左动脉(图1c),清除NO.7、9淋巴结。沿胰腺上缘分离,清扫脾动脉周围淋巴脂肪组织(图1d),至脾动脉分叉处(NO.11淋巴结),根部切断胃后动脉。分离胃后间隙,切断胃膈韧带左右层。于胃短动脉根部及脾胃韧带近脾处切断。在胃前方近肝处切断肝胃韧带(图1e),切断膈食管韧带,切断食管前后方迷走神经干,廓清腹段食管周围(图1f)。由剑突至脐与剑突连线中点处取上腹部正中辅助切口。距肿物上缘2 cm荷包钳钳夹食管,切断食管,制作食管断端荷包,置入25#管型吻合器抵钉座固定。距Treitz韧带15 cm切断空肠。距空肠远断端约50 cm处切开肠壁,缝制荷包,置入26#管型吻合器抵钉座固定。经空肠近断端插入26#管型吻合器,经空肠侧壁穿出连接杆,与26#管型吻合器抵钉座连接,行空肠空肠侧侧吻合。75 mm直线型切割吻合器闭合空肠近断端。经结肠前或结肠后距肠肠吻合20~25 cm处空肠与拟保留的远端胃前壁或后壁,以29#管型吻合器进行侧侧胃肠吻合。距肿瘤下缘5 cm以100 mm直线型切割吻合器横断胃体,移除近端胃及所属淋巴结,间断浆肌层缝合加强胃肠吻合、肠肠吻合(图2a)。以25#管型吻合器将食管断端与距胃肠吻合约20 cm处空肠行端侧吻合(图2b)。以75 mm直线型切割吻合器闭合空肠远断端,浆肌层包埋。

图1a 结扎切断胃网膜左血管 图1b 胰腺上缘区域淋巴结清扫

图1c 结扎切断胃左血管 图1d 沿脾动脉清扫淋巴结

图1e 胃小弯侧系膜切除 图1f 裸化腹段食管
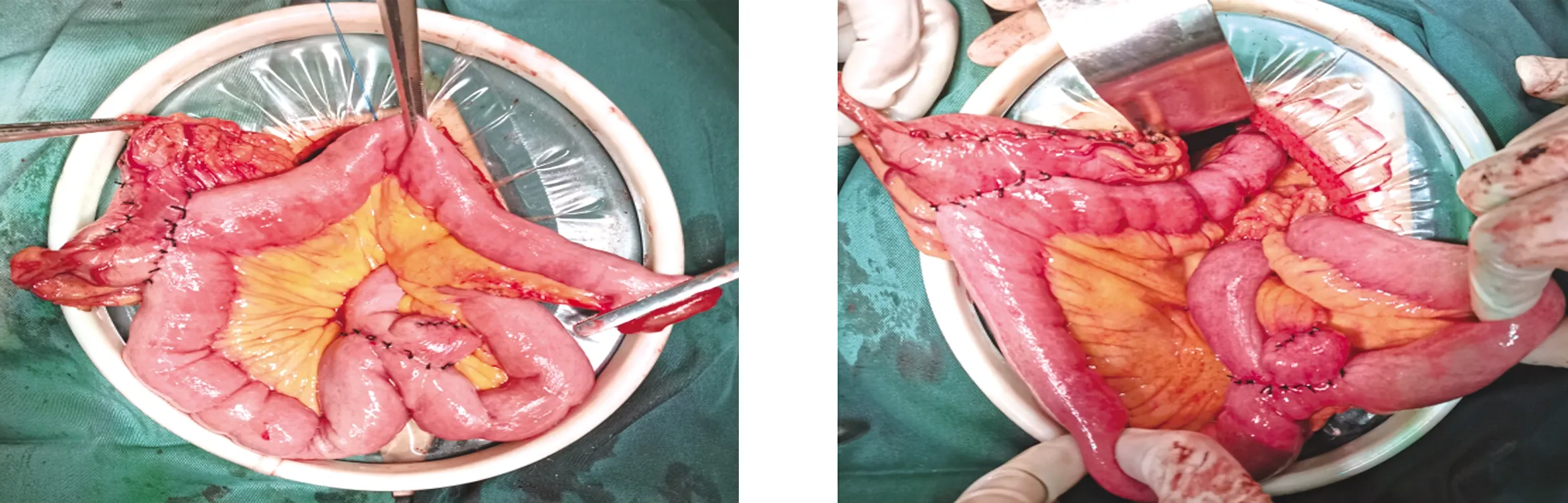
图2a 完成胃肠与肠肠吻合 图2b 完成食管空肠吻合

2 结 果
2.1 手术情况 本组57例双通道重建的腹腔镜辅助近端胃癌根治术均顺利完成。手术时间平均(273.7±34.3)min,双通道重建时间(81.9±20.4)min,手术失血量(56.1±14.3)mL。
2.2 术后恢复及并发症 术后首次排气时间平均(3.7±0.9)d,术后平均住院(11.4±5.5)d。术后发生近期并发症7例,发生率12.3%,其中肺不张并肺部感染4例;膈下脓肿1例,合并肾病综合征,长期服用小剂量糖皮质激素、免疫抑制剂,经穿刺引流治愈;食管空肠吻合口漏1例,经双套管冲洗引流并经鼻肠营养管进行肠内营养2个月,瘘口愈合,后出现食管空肠吻合口狭窄,经内镜下扩张治愈。1例术后出现下肢深静脉血栓,经溶栓治疗后血栓消失。余者均顺利康复。
2.3 术后反流、进食情况 术后随访,患者均无反流、反酸、烧心等胃食管反流表现,无进食后上腹部饱胀不适感;术后1年行胃镜检查,发现1例反流性食管炎(A级),余者均未见反流性食管炎表现,胃镜均可进入残胃,未见残胃癌变。术后1个月每日餐次5~7次,平均(5.8±0.8)次,此后餐次逐渐减少,每次进食量为患病前的40%~50%;术后1年,每日3次正餐外加餐1~2次,加餐多为进食牛奶、糕点等1~2次,正餐餐次进食量估测为患病前的80%~90%。
2.4 术后消化道造影 术后1个月采用38%的泛影葡胺80 mL行上消化道造影,均显示造影剂经残胃十二指肠与空肠两条通道(图3a、3b),54例以经空肠途径为主(约为2/3),3例显示造影剂大部分经残胃十二指肠通道。造影显示胃排空稍延迟。未见胃内造影剂反流至空肠。
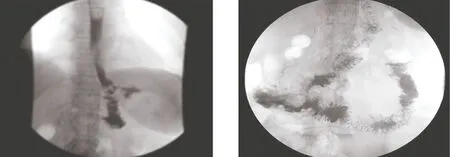
图3a 食管空肠吻合口 图3b 造影剂入残胃及空肠两条途径
3 讨 论
近端胃切除术后传统的消化道重建方法是行食管残胃吻合。然而,由于切除了贲门与食管下端,丧失了抗胃食管反流的机制,近端胃癌切除食管胃吻合术后常发生胃食管反流症状及反流性食管炎,反流性食管炎发生率为27.4%~67.4%[1,7-9],多需长期服用抑酸剂治疗。其次,由于迷走神经切断后残胃蠕动功能减弱,幽门括约肌功能失调,残胃排空延迟,每餐量减少,餐次增多。以上因素严重影响患者的生活质量及营养状况。笔者曾遇到多例患者,体重减少达30%~40%,且纳差、反酸、烧心症状明显。此外,食管胃吻合后吻合口狭窄也是常见的并发症,研究报道其发生率为35.1%~38.2%[9-10]。加之近端胃癌切除被认为是缩小的根治性手术,尽管近端胃癌切除残胃食管吻合保留了食物的生理途径,因如上不足,临床应用较少。
全胃切除术符合标准根治手术的要求,并且由于空肠的顺向蠕动,食管空肠吻合具有明显的抗反流作用,避免了食管胃吻合的缺点。但其不足是失去了胃十二指肠的消化吸收功能及食物的胃十二指肠流向所促进的胆汁与胰液分泌,不利于食物消化吸收。此外,失去了分泌内因子的所有壁细胞,会影响维生素B12的吸收;铁的吸收主要在十二指肠及空肠,胃酸环境使铁易于吸收,全胃切除后食物不经过十二指肠,缺乏胃酸环境,也会影响铁的吸收,从而产生营养性贫血。研究显示[11-12],与全胃切除Roux-en-Y吻合相比,近端胃切除+双通道重建可明显改善术后营养状态、减少贫血的发生。
为克服两种术式的缺陷,为不必行全胃切除术的胃上部癌,设计了多种近端胃切除后消化道重建方式,包括间置空肠、双通道重建、食管胃吻合肌瓣成形术(双肌瓣吻合、Kamikawa吻合、“観音開き法”)[13-16]等。研究显示[17],相较单通道间置空肠,双通道重建可能是提供最稳定肠道吸收及消化激素分泌结果的方式。
近端胃切除后双通道重建是在食管与残胃之间间置一段空肠,利用空肠的顺向蠕动拮抗残胃的胃酸反流进入食管,以减轻甚至消除胃食管反流症状、反流性食管炎。报道显示[18],食管空肠吻合口与胃空肠吻合之间空肠肠袢距离为15 cm时,术后胃食管反流症状发生率为10.5%,术后抑酸剂使用率为31.6%。本组57例均采用20 cm的间置空肠距离,术后随访6~28个月,均无胃食管反流症状发生,无需服用抑酸剂,术后半年复查胃镜,反流性食管炎发生率为1.75%(1/57),显示双通道重建的间置空肠可有效拮抗胃食管反流,且效果与间置空肠的距离有关。20 cm以上的间置空肠可能具有更好的抗反流作用。然而间置空肠过长会产生以下不利因素:(1)残胃活动度大,可能出现胃下垂。(2)间置的空肠盘曲在左上腹,可能引起术后复查胃镜困难。Kinoshita等[19]的研究中90例患者采用15 cm的间置空肠长度,术后胃镜均可到达残胃。相较于此研究,增加5 cm的间置空肠长度不会明显增加胃镜检查难度,本研究中术后胃镜检查也均可进入残胃。(3)此段空肠过长可影响小肠的消化吸收功能。因此,笔者认为20 cm的间距更为适当。
本研究中,术后1个月患者每日餐次5~7次;术后1年,每日3次正餐外加简餐1~2次,正餐餐次进食量估测为患病前的80%~90%,且均无进食后上腹部胀满不适;术后造影显示造影剂经残胃十二指肠与空肠两条通道,表明进食后会有2个食物流向,能容纳较多的食物,使餐次进食量增加;显著改善了全胃切除或近端胃切除食管胃吻合术后的每餐进食量少、每日餐次显著增加的状况,减轻了术后生活护理的负担。
对于双通道重建术后食物流向的比例,Ahn等[20]于术后3个月采用摄入2 mCi锝-99m标记的DTPA混合固体食物的方法进行研究,发现食物经过残胃十二指肠途径与空肠途径的比例为3∶2。本研究中术后采用38%的泛影葡胺80 mL进行上消化道造影,发现54例主要经空肠途径、3例主要经残胃十二指肠途径,其原因可能是造影剂剂量偏少、为流质,且仅反映了流质饮食进食过程初期的表现。从生理上而言,食物流向主要经残胃十二指肠途径是合理的。为使食物主要经残胃十二指肠途径,Nomura等[21]将胃肠吻合口肛侧的空肠闭合,并保留迷走神经肝支、幽门支,形成单通道的空肠间置。术后1年间置空肠组每日进食量较双通道组略少,但术后1年体重/术前体重较双通道组略高,尽管未得出统计学差异,也提示经胃十二指肠途径有助于维持营养状态。但由于迷走神经的切断,胃排空功能延迟,48.9%的患者出现胃潴留[20],完全经胃途径的方式会出现易饱、每餐进食量少的问题。部分食物经空肠途径可增加每餐进食量,减少每日餐次。此外,笔者认为于小弯侧胃中上部剖开胃系膜,解剖分离迷走神经,从胃全系膜切除理论上而言是不合理的。为使食物尽可能多地进入残胃途径,Tanaka等[22]采用60 mm的直线吻合器行胃后壁空肠扭转吻合,形成较宽的胃肠吻合,并使空肠骑跨于残胃前方,另将肠肠吻合口上提至残胃水平,其效果尚待进一步观察。
术后并发症方面,食管空肠吻合口漏发生较多,与此部位显露受限,食管残端血运、吻合后空肠肠袢有无张力等因素有关。本组病例中发生食管空肠吻合口漏1例,经非手术治疗治愈。双通道重建增加了一个胃空肠吻合,多采用器械吻合,且吻合部位易于显露、血运良好、容易加强缝合,极少发生胃空肠吻合口漏。因而双通道重建不会显著增加吻合口漏的发生。Aburatani等[18]进行了双通道重建与食管胃吻合比较的回顾性研究,吻合口狭窄的发生率分别为0与27%(P=0.014);Johansson等[23]认为,这可能与双通道重建胃液反流轻、较少引起吻合口炎症有关。本研究结果与之相似,除1例因食管空肠吻合口漏愈合后食管空肠吻合口狭窄外,余者术后上消化道造影、术后1年胃镜检查均未发现吻合口狭窄。表明双通道重建食管空肠吻合口狭窄发生率较低。需要注意的是胃黏膜下血管丰富,吻合完毕需检查胃肠吻合口是否出血,必要时行吻合口全层间断缝合,本组未出现因术后胃空肠吻合口出血导致的再手术。
双通道重建是在食管空肠Roux-en-Y吻合的基础上增加一个胃肠吻合,并不明显增加复杂性,且胃肠吻合时胃已游离,吻合不困难,本组消化道重建时间为(81.9±20.4)min。樊俊彦等[24]对手术时间进行了回顾性队列研究,结果显示近端胃切除+双通道重建组较全胃切除+Roux-en-Y吻合组手术时间(294 min vs.255 min,P=0.002)略长。相较残胃食管吻合,双通道重建增加了手术步骤,延长了手术时间,但相对于术后获益,增加一定的手术时间是值得的。
双通道重建的若干技术细节:(1)结肠前/结肠后吻合:笔者施行双通道重建初期采用结肠前吻合,术后造影常发现胃下垂表现,残胃空肠吻合口低于幽门,不利于食物经由残胃十二指肠途径。原因与切除小网膜导致残胃的游离度增大有关。此后,笔者多采用结肠后吻合,将残胃空肠吻合置于结肠系膜兜托之上,术后造影显示此方法有效防止了胃下垂的发生。胃下垂的发生也与食管空肠吻合与残胃空肠吻合之间的距离有关,如果将两吻合之间的肠袢距离缩短,有助于减轻术后胃下垂。(2)胃前壁/后壁吻合:空肠与残胃吻合的位置有不同的报道。《近端胃切除消化道重建中国专家共识(2020版)》[15]建议采用残胃前壁与空肠侧侧吻合。Aburatani等[18]、Kinoshita等[19]均采用残胃前壁与空肠吻合。Nomura等[17]采用残胃断端与空肠吻合的方法,徐宁等[25]则采用残胃后壁与空肠的背驮式间置空肠吻合。本组多采用残胃后壁与空肠进行侧侧吻合。笔者认为,残胃后壁与空肠吻合比较符合残胃与空肠在此处的自然状态,前壁吻合后的残胃与此处空肠会产生扭转,吻合口受力不均;而无论坐位或站立位进食,残胃前壁与后壁的吻合对食物的流向及排空不会产生明显区别。
对于双通道重建的问题,笔者认为还存在以下方面需要进一步研究:(1)吻合较为复杂。双肌瓣吻合借用胃壁肌瓣将食管远端5 cm埋入胃壁肌层并行食管残胃吻合,通过胃壁肌层的收缩闭合食管下段,以拮抗胃食管反流,吻合口较双通道少。杨力等[13]报道了2例近端胃切除后双肌瓣吻合的结果,未出现反流性食管炎及吻合口相关并发症,显示了良好的效果。但该重建方式食管残胃吻合过程较复杂,尤其食管受侵而需切除部分食管的食管胃交界部癌,无论腹腔镜还是开腹手术,由于吻合位置深在,空间狭小,吻合复杂,安全吻合难度较高。(2)各吻合口的合适距离有待商榷。(3)食物流向的改变对消化吸收生理功能的影响尚需进一步明确。
关于近端胃切除术后双通道重建的价值目前尚无明确的结论,现有报告均为回顾性研究,多数研究显示[11,24,26-28],与全胃切除Roux-en-Y吻合相比,除具有一致的根治性及术后吻合口相关并发症发生率外,在术后营养状态、贫血方面,近端胃切除+双通道重建优于全胃切除+Roux-en-Y吻合。然而,Cho等[29]的研究显示,两者术后营养状态与贫血程度相似,值得注意的是,该研究中残胃容积小于其他研究,可能降低了残胃十二指肠食物通道的作用。对此,韩国正在进行Ⅲ期多中心前瞻性RCT研究(KLASS-05),以对比腹腔镜近端胃切除+双通道重建与腹腔镜全胃切除术的效果[30]。
总之,双通道消化道重建是较理想、安全、可行的腹腔镜辅助近端胃癌切除术后的消化道重建方式,可避免术后胃食管反流,增加进食量,利于维持术后营养状态、减轻术后贫血。尽管其远期效果尚需多中心前瞻性随机对照的研究加以证明,相较食管胃吻合,双通道吻合可作为胃上部癌近端胃切除后更好的消化道重建方式。

