适用于无创消化道重建的径向充磁吻合器的设计
陈 环,单丽宇,吕 毅,李 宇*
(1.西安交通大学第一附属医院肝胆外科,西安 710061;2.西安交通大学第一附属医院精准外科与再生医学国家地方联合工程中心,西安 710061)
0 引言
胃流出道梗阻[1]是多种晚期肿瘤的常见并发症,如胰头癌[2-4]、十二指肠癌[5-7]、胆囊癌[8-11]、胃癌[12-14]等。为解决胃流出道梗阻患者的进食问题,临床上多采用内镜下金属支架置入等方法[15]。然而,术中所用支架多为裸金属支架,组织长入支架可造成支架堵塞,导致梗阻复发,因此须反复多次置入支架,严重影响患者的生存质量。近年来,胃肠道微创手术成为研究热点,在超声引导下,一种基于胃后壁与空肠起始部间解剖关系的胃肠吻合术[16]受到重视,但因操作难度大并未得到普及。
磁外科[17]是利用特殊设计的磁性医疗器械或设备,将磁性物质间“非接触性”磁场力转化为临床诊疗中能够发挥特定功能的力,从而完成组织压榨[18-21]、器官锚定[22-24]、管腔导航[25-26]、间隙扩张和可控示踪[27]等功能的新兴综合性技术学科。按照不同应用方式和作用原理,磁外科技术可分为以下五大类[17]:磁压榨技术、磁锚定技术、磁导航技术、磁悬浮技术以及磁示踪技术。磁吻合(magnetic compression anastomosis,MCA)技术作为磁压榨技术的重要分支,是借助磁场介导的磁体间引力,对靶组织产生压力,致使靶组织缺血—坏死—脱落,促使周围组织连接愈合,最终实现管道重建。目前,MCA 技术已成功应用于消化道管腔吻合、狭窄再通、尿路系统吻合和血管吻合等领域,具有较高的临床价值。
传统的磁吻合器多由一对环形磁体组成,体积较大,内镜置入困难,而单纯的体积缩减会导致吻合力不足和吻合口狭窄,因此,微创的胃肠姑息性磁吻合器发展缓慢。为解决这一难题,Machytka 等[28]通过将若干梯形磁体首尾相接排列,设计了可在线形和环形间转变的自组装磁吻合器。该磁吻合器的自组装过程主要通过机械结构实现,增加了磁吻合器的复杂性;此外,该磁吻合器的机械故障发生率较高,进一步限制了其在临床的推广应用。严小鹏等[29]也采用了类似的结构设计,但目前处于理论阶段,尚未在动物实验中进一步验证。
磁路设计与优化是磁外科医疗器械设计的最大特点。与传统的轴向充磁不同,本研究利用多个径向充磁的圆柱形磁体侧侧相吸,设计并制作适用于无创消化道重建的可在线形和环形2 种状态下自由转变的自组装径向充磁吻合器,并在有限元力学分析及大鼠胃肠吻合模型中验证设计的吻合器的可行性和有效性。
1 设计思路
针对当前磁吻合器体积过大、难以微创置入的问题,径向充磁吻合器的整体设计目标为:(1)有且仅有线形(置入状态)与环形(吻合状态)2 种稳定状态;(2)在置入过程中保持线形状态,置入后可由线形转变为环形;(3)具备不同规格,适用于不同临床场景;(4)能提供适当的吻合力。
径向充磁吻合器的设计思路如下:(1)多个等尺寸的径向充磁圆柱形磁体侧侧相吸,排列成直线,构成线形状态吻合器。(2)每3 个磁体组成1 个转轴单元,两侧磁体可以中间磁体为轴心旋转。每个磁体均可作为轴心形成转轴,实现吻合器从线形状态向环形状态的转变。(3)通过控制圆柱形磁体数目,可制作不同规格的吻合器,以适用于不同临床场景。(4)采用N54 钕-铁-硼材料提供消化道吻合所需的磁力。
2 结构设计
径向充磁吻合器由子环、母环和“J”形管组成。具体设计如下。
2.1 子环和母环
径向充磁吻合器的子环和母环结构一致,均由6 个等尺寸的圆柱形磁体组成。如图1(a)所示,与传统的轴向充磁不同,本研究中所用的圆柱形磁体均为径向充磁。如图1(b)所示,在径向磁力作用下,3个(或以上)圆柱形磁体可通过侧侧相吸排列成线。此时,3 个相邻磁体可形成转轴单元,两侧磁体可以中间磁体为轴心旋转,旋转过程中径向磁力维持了转轴的稳定性。如图1(c)所示,6 个圆柱形磁体侧侧相吸后组装成子环或母环,此时吻合器为线形状态,磁场沿线形吻合器从左至右(或从右至左)分布。如图1(d)所示,当每个圆柱形磁体绕其相邻磁体旋转角度θ=60°时,吻合器组装成环形状态,此时磁场绕环形吻合器中轴旋转分布。
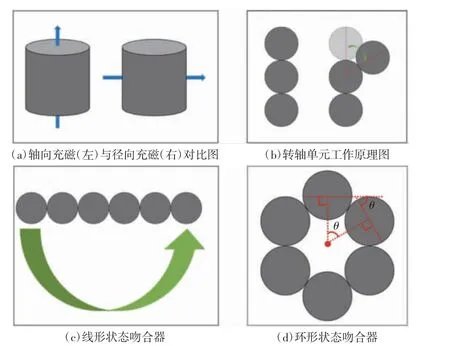
图1 径向充磁吻合器设计原理
吻合器实物图如图2 所示,6 个直径2 mm、高2 mm 的圆柱形磁体侧向相吸,形成线形吻合器[如图2(a)所示]。线形状态下吻合器可通过狭小通道(内镜通道、导管等)置入靶肠管。线形吻合器置入肠管后,可通过转轴弯曲组装成环形吻合器[如图2(b)所示],2 个环形吻合器轴向相吸可实现无创消化道重建[如图2(c)所示]。

图2 径向充磁吻合器实物图
2.2 “J”形管
吻合器的置入与自组装须使用专用器械的辅助——“J”形管。如图3(a)所示,“J”形管为柔性结构,自然状态下主体为平直管道,头部为环形凹槽。“J”形管的工作原理如图3(b)所示,线形吻合器经“J”形管主体送入,在头部的环形凹槽内弯曲至一定角度后,首尾磁体借助磁力相吸组装成环形吻合器。

图3 “J”形管
3 使用方法
操作者操作内镜至消化道狭窄(如胰头癌占位处)近端,引入导丝并穿过狭窄处;退出内镜后,经导丝引入“J”形管,并在透视下定位“J”形管于待吻合处(如空肠起始处)。
退出导丝,置线形吻合器入“J”形管,再次置入导丝后在导丝推动下,线形吻合器逐步向“J”形管头端移动,并在环形凹槽内逐步弯曲,最终在消化道狭窄远端形成环形吻合器。
以相同方式于消化道狭窄近端(如胃内)置入另一线形吻合器并组装成环形吻合器。2 个环形吻合器轴向相吸,对肠管和胃壁进行压榨,吻合器之间的组织会发生缺血—坏死—脱落,吻合器周围的组织逐层愈合,最终形成吻合口。
4 有限元力学分析
以高5 mm、直径6 mm 的圆柱形磁体为例,分析线形、弧形和环形3 种状态下吻合器的稳定性,分析结果如图4 所示。以图4(a)中线形状态下磁体2 为例,其受到的磁力F2、弹力F1-2、弹力F3-2、轴向力矩M2分别为1.01 N、13.07 N、14.08 N 和0,磁体2 受力平衡,各磁体受力一致,因此线形状态下的吻合器受力平衡。以图4(b)中弧形状态下磁体1 为例,其受到的磁力F1、弹力F2-1、轴向力矩M1分别为12.65 N、12.64 N 和0.14 N·m,磁体1 受力不平衡,因此弧形状态下的吻合器受力不平衡。以图4(c)中环形状态下磁体1 为例,其受到的磁力F1、弹力F2-1、弹力F6-1、轴向力矩M1分别为12.39 N、12.39 N、12.39 N 和0 N·m,磁体1 受力平衡,各磁体受力一致,因此环形状态下吻合器受力平衡。
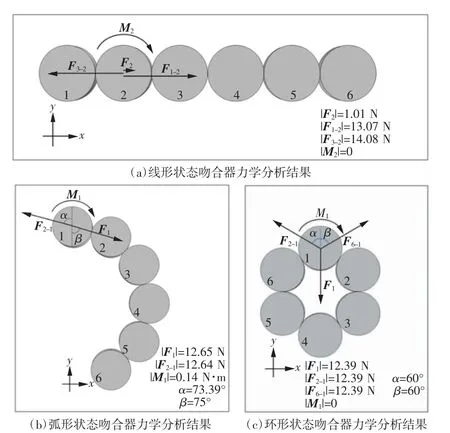
图4 径向充磁吻合器力学稳态分析
5 动物实验
选取健康、成年且无特定病原体的SD 大鼠12只,体质量240~260 g,由西安交通大学实验动物中心提供。SD 大鼠在实验动物中心普通动物环境中饲养、管理,环境温度维持在(25±2)℃,环境相对湿度维持在50%~80%,光照时间为12 h,饮水、进食过程不受限制。SD 大鼠饲养、管理和实验严格遵守国家《实验动物管理条例》《陕西省实验动物管理办法》,且本实验经西安交通大学动物伦理委员会批准。
将12 只SD 大鼠随机均分为实验组和对照组(假手术组),每组6 只,术前24 h 禁食、6 h 禁饮,麻醉及手术操作前称重。术前1 h 向大鼠皮下注射丁丙诺啡0.05 mg/kg 作为止痛剂,通过吸入异氟烷进行麻醉。具体操作如下:
(1)实验组:经腹中线逐层开腹(切口3 cm),暴露胃、十二指肠及空肠近端[如图5(a)所示];在十二指肠近端做2 mm 纵切口,通过切口置“J”形管入胃内,利用导丝经“J”形管将母环推送至胃内,以同样的方式置子环于空肠近端[如图5(b)所示];调整吻合器状态和位置后,吻合器子母环相互吸引耦合,磁吻合开始[如图5(c)所示];缝合小肠和腹壁切口。(2)对照组:禁食、麻醉、开腹和十二指肠近端开口操作与实验组相同,但不进行胃肠吻合。
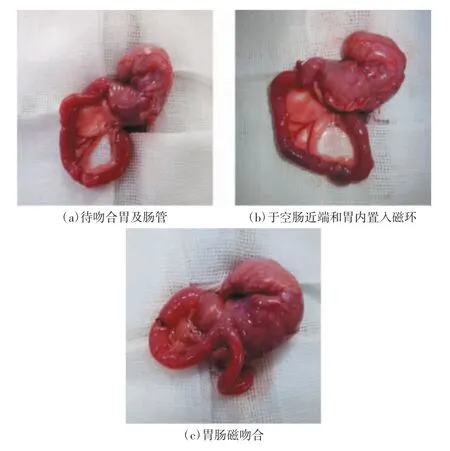
图5 大鼠胃肠磁吻合操作
术后立即行腹部X 射线检查,观察磁体位置,确认磁体是否对位良好。术后每日行腹部X 射线检查,确认磁体是否解离及排出;每周测量大鼠体质量,评估大鼠生理状态。
术后第2 周,使用过量麻醉对12 只大鼠施行安乐死。获取“胃-肠吻合袢”,观察吻合口愈合情况,并通过浸水注气法测量实验组大鼠的吻合口爆破压和对照组大鼠的胃爆破压。通过ImageJ_v 1.8.0 测量吻合口大小,并以周长(mm)表示。
采用SPSS 23.0 软件对2 组大鼠的体质量和爆破压进行统计学分析,P<0.05 表示差异有统计学意义。
6 结果
实验组6 只大鼠的胃肠吻合均顺利实施,且无死亡。术后X 射线显示,子环和母环对位良好[如图6(a)所示],吻合器未发生解离,磁环排出时间为(7.17±2.14)d(4~10 d)。术后14 d,剖腹探查,各组大鼠腹腔内的解剖结构清晰、无粘连,肠管管径正常,未见肠梗阻、消化道漏及腹腔感染等严重并发症。
术前、术后1 周及术后2 周,实验组、对照组大鼠体质量分别为(252.97±9.68)g vs(253.03±11.71)g(P=0.992)、(265.53±11.49)g vs(267.92±16.13)g(P=0.774)、(282.13±10.62)g vs(280.62±11.97)g(P=0.770)。实验组大鼠术后体质量逐渐增加,与对照组大鼠体质量无统计学差异。
对照组大鼠胃爆破压为(161.83±9.02)mmHg(1 mmHg=133.32 Pa)(与Uygun 等[30]的研究结果一致,破裂均发生于薄弱的胃体与胃底交界处),实验组胃肠吻合口爆破压为(152.83±7.94)mmHg,二者无统计学差异(P=0.097)。
大体标本显示,实验组吻合口浆膜面整洁连续,黏膜光滑平整,吻合线隐约可见且愈合良好,吻合口周长为(14.23±2.14)mm,如图6(b)所示。HE 染色结果显示实验组浆膜层、黏膜下层和黏膜层愈合较好,如图6(c)所示。

图6 实验组大鼠术后图像
7 讨论
磁外科的显著特点在于将磁性器械“非接触性”场力有效地转化为受控释放的特定能量,从而达到临床诊疗的目的。磁吻合技术凭借磁体间的“非接触力”实现管道重建,规避了针线贯穿损伤和异物刺激。然而,传统的磁吻合器多为刚性的圆形结构,致使内镜下磁体置入困难,这在近年来内镜磁吻合技术飞速发展的背景下不容忽视。
为解决内镜下磁体置入困难的难题,Zhao 等[31]设计了椭圆型吻合器,减小了吻合器的横截面,并通过犬肠道侧侧吻合验证了其可行性。但该设计在相同尺寸下增大了吻合器的纵截面,增加了吻合器排出过程中崁顿梗阻的风险。Machytka 等[28]设计了八边形自组装磁吻合器,成功实现了内镜下空肠分流术,但复杂的机械结构限制了其推广应用。Matsuura 等[32]在行内镜下磁压榨胆肠吻合术中,为了顺利置入胆道内磁体,不得不依次更换更粗的经皮经肝胆管引流(percutaneous transhepatic biliary drainage,PTBD)管,在长达6 个月的时间内更换了7 次PTBD 管,最终将PTBD 管的直径增加至5.33 mm 才顺利置入磁体。这一过程不仅增加了操作难度,还拖延了治疗过程,降低了患者的生存质量。
与传统的轴向充磁不同,本研究利用了多个径向充磁的圆柱形磁体侧侧相吸,排列成可在线形和环形2 种状态下自由转变的自组装吻合器。吻合器的可动关节(转轴单元)由圆柱形磁体本身构成,转轴的稳定性由径向磁力维持。该磁路设计在实现自组装的同时避免引入复杂的机械结构,彻底规避了复杂的机械结构导致的机械故障,同时节约了吻合器的制作成本。另一方面,通过控制吻合器中磁体的数量,可根据临床需求制作不同规格的自组装吻合器,这在借助机械关节实现自组装的吻合器中是难以实现的[29]。
有限元力学分析结果表明,该吻合器仅具备线形和环形2 种稳定状态,弧形状态为不稳定的过渡状态,在理论层面证实了自组装过程的可行性。动物实验表明吻合器可在线形状态下经内径2 mm 的通道置入,并在消化道内组装成直径6 mm的环,最终实现吻合。且吻合术后未发现吻合器解离和相关并发症,证实了径向磁力可有效维持吻合器的稳定性。另外,吻合口愈合良好,其周长和爆破压均满足生理要求,表明环形状态子母环的轴向相吸可提供适当吻合力,实现胃肠吻合。因此该吻合器具备经内镜置入消化道,并实现无创消化道重建的潜力。
该吻合器有望解决内镜下磁吻合器置入困难的问题。但本研究仅在小动物模型中进行了初步实验,未来仍需在大型动物中进一步验证该吻合器的安全性和有效性。

