参连合用对代谢综合征患者“肠道菌群-免疫反应”的影响
蔡之幸,陈 越,陈莉莉,李 丽
代谢综合征(metabolic syndrome, MS)是一组以中心性肥胖、高血压、糖代谢异常、脂质代谢紊乱等为主要临床表现的证候群[1]。如不能有效控制,可引发心脑等重要脏器疾病,严重威胁人们的生命健康。最新统计数据表明,我国MS发病率已达14%~18%,患者已经超过1亿,即每8~10个成年人中就有1人患病[2]。研究发现,肠道菌群不仅影响人体能量代谢[3],而且在MS发生发展中起着重要作用[4]。通常肠道菌群与肠道黏膜免疫维持动态平衡,一旦肠道内寄生的致病菌大量繁殖,会导致肠道黏膜免疫屏障被破坏,诱发机体免疫反应[5]。MS患者“肠道菌群-免疫反应”目前已成为临床关注的热点,但部分研究结论尚存在争议。本研究拟在前期益气燥湿法(参连合用)干预MS患者糖脂代谢基础上[6],进一步观察参连联合常规西医治疗对湿热中阻兼气虚型MS患者效果,为探索 “肠道菌群-免疫反应”机制提供参考。
1 对象与方法
1.1 对象 选取 2019年 1月—2020年 8月上海交通大学医学院附属同仁医院收治的54例湿热中阻兼气虚型的MS患者作为研究对象,按照随机数字表法分为对照组(常规西药治疗)与治疗组(常规西药+参连联合治疗),每组各27例。治疗组男16例,女11例,平均年龄(50.64±8.32)岁;对照组男17例,女10例,平均年龄(51.10±8.14)岁。本研究经我院医院伦理委员会批准,所有患者均知情同意。
1.2 纳入与排除标准 纳入标准:(1)符合国际糖尿病联盟于2005年颁布的 MS 诊断标准[7-8],即腹型肥胖(中国人群男性腰围≥90 cm,女性腰围≥80 cm),并具有以下任两项者①TG≥1.7 mmol/L;②男性HDL<1.03 mmol/L,女性 HDL<1.29 mmol/L;③血压>130/85 mmHg(1 mmHg=0.133 kPa); ④空腹血糖(fasting blood glucose, FBG)≥5.6 mmol/L。(2)符合中医证候辨证标准者。(3)年龄为35~75周岁。
排除标准:(1)妊娠或哺乳期妇女。(2)有严重心脑血管及肝肾脏疾病、精神病及其他严重器质性疾病患者。(3)纳入本研究前1个月应用抗生素、益生菌等微生物制剂的患者。(4) 治疗依从性差,不能按疗程完成治疗者。(5) 治疗过程中,出现过敏反应或严重不良事件者。
1.3 方法
1.3.1 血液样本采集与检测 收集患者空腹血样(禁食12 h,次日早晨8∶00采集血样),标本采集后送检,通过全自动生化分析仪(日本日立公司生产)测定生化指标,ELISA法(Elascience公司生产)检测各类炎症因子。
1.3.2 粪便样本收集与检测 采集患者约5 g新鲜粪便中间部分样本,分装在2个密闭EP管中,2 h内储存于-80 ℃冰箱低温冷冻保存。标本保存后送检,测定肠道细菌DNA。具体方法如下:取粪便样本0.2 g制备成肠菌液,采用E.Z.N.A.®soil试剂盒提取粪便基因组DNA,利用NanoDrop2000检测DNA浓度和纯度;采用引物对 V3-V4 可变区进行 PCR 扩增实验,引物设计合成见表1;反应条件为:采用iQTM SYBR Green Supermix(Bio-Rad,美国)配置定量PCR反应体系,25 μl总体积含 2× Supermix 12.5 μl、ddH2O 8.5 μl、样本肠菌液 2 μl、上下游引物(12.5 μmol)各 1 μl。按试剂盒提取说明,每0.2 g 粪便提取 200 μl基因组,计算每克粪便细菌基因组拷贝数,换算为1g copies/g湿便,取对数拷贝数值。

表1 PCR引物设计合成Table 1 PCR primer design and synthesis
1.3.3 治疗方法 对照组采用常规西药艾塞那肽注射液(5 μg/次)治疗,于早、晚饭前10 min皮下注射;治疗组在对照组治疗基础上加用黄连素片(盐酸小檗碱片,上海信谊天平药业有限公司委托上海信谊九福药业有限公司生产,国药准字H20034013,规格:0.10 g/片)300 mg,2次/d,每次1片,口服;振源片[吉林吉春制药股份有限公司,国药准字Z20093631,规格:0.15 g/片(含人参果皂苷25 mg)]600 mg,3 次/d,每次4片,口服。1周为1个疗程,连续观察2个疗程。
1.4 观察指标 (1)检测指标:患者治疗前后FBG、TC、TG、LDL-C、HDL-C,血清CRP,IL-6、IL-10,乳酸杆菌、双歧杆菌、肠杆菌属、肠道总菌等;(2)治疗后的各类不良事件。
1.5 统计学处理 使用SPSS 23.0软件对数据进行统计学分析。计量资料呈正态分布,以±s表示,2组间的比较采用成组t检验或校正t检验或秩和检验。同组内治疗前后比较采用配对t检验。计数资料以例(%)表示,2组间比较采用χ2检验或校正χ2检验。统计推断的检验水准α=0.05(双侧检验)。
2 结 果
2.1 2组基线/临床资料比较 2组患者性别、年龄、肥胖程度、病程及入组前是否服用降脂药、降压药、降糖药等一般资料比较差异均无统计学意义(P均>0.05),具有可比性。详见表1。
表1 2组基线/临床资料比较(±s)Table 1 Comparison of baseline/clinical data between 2 groups(±s)
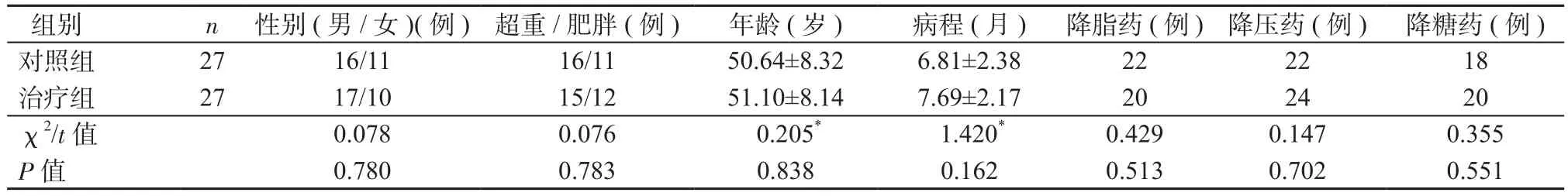
表1 2组基线/临床资料比较(±s)Table 1 Comparison of baseline/clinical data between 2 groups(±s)
注:*.t值
组别 n 性别(男/女)(例)超重/肥胖(例) 年龄(岁) 病程(月) 降脂药(例)降压药(例) 降糖药(例)对照组 27 16/11 16/11 50.64±8.32 6.81±2.38 22 22 18治疗组 27 17/10 15/12 51.10±8.14 7.69±2.17 20 24 20 χ2/t值 0.078 0.076 0.205* 1.420* 0.429 0.147 0.355 P值 0.780 0.783 0.838 0.162 0.513 0.702 0.551
2.2 2组治疗前后FBG、TC、TG、LDL-C、HDL-C比较 与治疗前比较,2组治疗后FBG、TC、TG、LDL-C水平均下降,其中TG下降差异均有统计学意义(P均<0.05);HDL-C水平均上升,但差异均无统计学意义(P均>0.05)。治疗组的FBG、TC、TG、LDL-C下降幅度及HDL-C上升的幅度与对照组相比差异均无统计学意义(P均>0.05)。详见表2。
表2 2组治疗前后FBG、TC、TG、LDL-C、HDL-C水平比较(±s,mmol/L)Table 2 Comparison of FBG, TC, TG, LDL-C, HDL-C between 2 groups before and after treatment(±s, mmol/L)
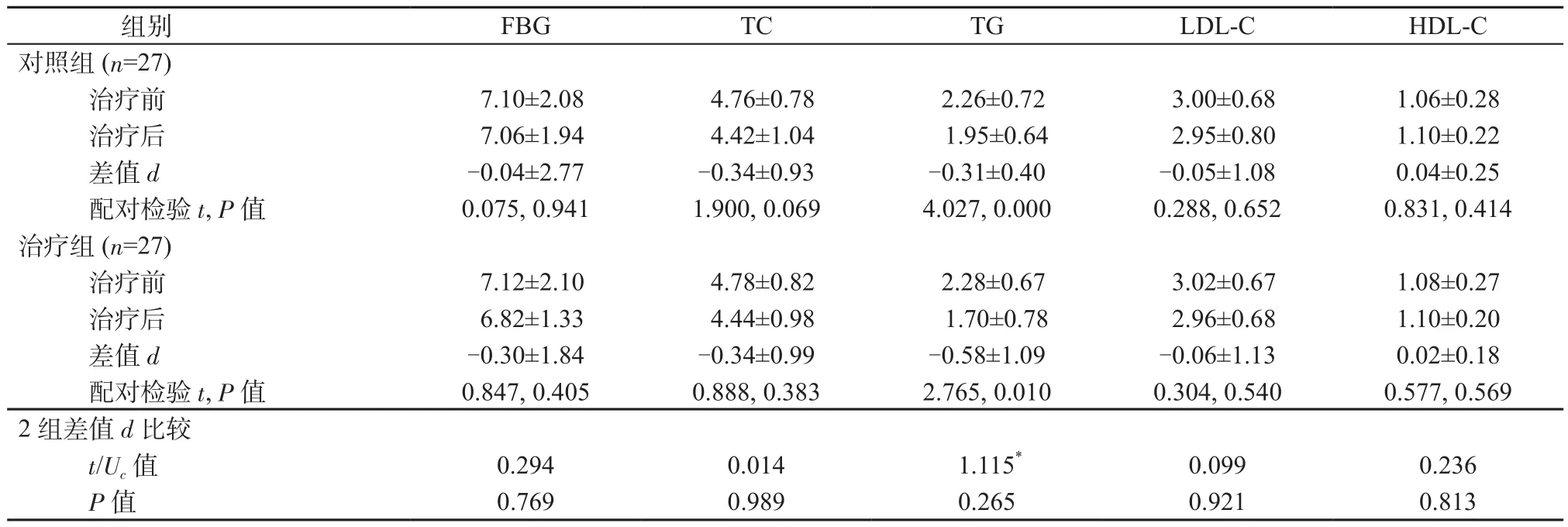
表2 2组治疗前后FBG、TC、TG、LDL-C、HDL-C水平比较(±s,mmol/L)Table 2 Comparison of FBG, TC, TG, LDL-C, HDL-C between 2 groups before and after treatment(±s, mmol/L)
注:*.Uc值
组别 FBG TC TG LDL-C HDL-C对照组(n=27)治疗前 7.10±2.08 4.76±0.78 2.26±0.72 3.00±0.68 1.06±0.28治疗后 7.06±1.94 4.42±1.04 1.95±0.64 2.95±0.80 1.10±0.22差值 d -0.04±2.77 -0.34±0.93 -0.31±0.40 -0.05±1.08 0.04±0.25配对检验t, P值 0.075, 0.941 1.900, 0.069 4.027, 0.000 0.288, 0.652 0.831, 0.414治疗组(n=27)治疗前 7.12±2.10 4.78±0.82 2.28±0.67 3.02±0.67 1.08±0.27治疗后 6.82±1.33 4.44±0.98 1.70±0.78 2.96±0.68 1.10±0.20差值 d -0.30±1.84 -0.34±0.99 -0.58±1.09 -0.06±1.13 0.02±0.18配对检验t, P值 0.847, 0.405 0.888, 0.383 2.765, 0.010 0.304, 0.540 0.577, 0.569 2组差值d比较t/Uc值 0.294 0.014 1.115* 0.099 0.236 P值 0.769 0.989 0.265 0.921 0.813
2.3 2组治疗前后肠道菌群的比较 与治疗前比较,2组治疗后乳酸杆菌、双歧杆菌含量均升高,肠杆菌含量均下降,其中治疗组乳酸杆菌含量升高差异有统计学意义(P<0.05)。治疗组的乳酸杆菌、双歧杆菌含量升高幅度及肠杆菌的下降幅度与对照组相比差异均无统计学意义(P均>0.05)。肠道总菌治疗前后及2组间变化幅度相比差异均无统计学意义(P均>0.05)。详见表3。
表3 2组治疗前后肠道菌群比较(±s,lg copies/g)Table 3 Comparison of intestinal flora between 2 groups before and after treatment(±s, lg copies/g)

表3 2组治疗前后肠道菌群比较(±s,lg copies/g)Table 3 Comparison of intestinal flora between 2 groups before and after treatment(±s, lg copies/g)
注:*.Uc值
组别 乳酸杆菌 双歧杆菌 肠杆菌属 肠道总菌对照组(n=27)治疗前 4.73±1.20 5.73±1.60 7.09±1.53 7.86±1.09治疗后 4.77±1.33 5.77±1.52 7.02±1.70 7.88±1.05差值 d 0.04±2.03 0.04±2.16 -0.07±2.09 0.02±1.18配对检验t, P值 0.102, 0.920 0.096, 0.924 0.418, 0.707 0.248, 0.762治疗组(n=27)治疗前 4.78±1.19 5.75±1.61 7.05±1.52 7.90±0.88治疗后 5.68±1.92 6.04±0.80 6.88±0.96 7.85±1.10差值 d 0.90±2.04 0.29±1.57 -0.17±1.42 -0.05±1.82配对检验t, P值 2.292, 0.030 0.960, 0.346 0.622, 0.539 0.143, 0.887 2组差值d比较t/Uc值 1.461* 0.540 0.281 0.148 P值 0.144 0.589 0.779 0.882
2.4 2组治疗前后血清CRP、IL-6、IL-10水平比较 与治疗前比较,2组治疗后IL-10水平均上升(P均<0.05),CRP、IL-6水平均下降,其中IL-6下降差异均有统计学意义(P均<0.05)。治疗组IL-10上升幅度及IL-6下降幅度均大于对照组(P均<0.05)。详见表4。
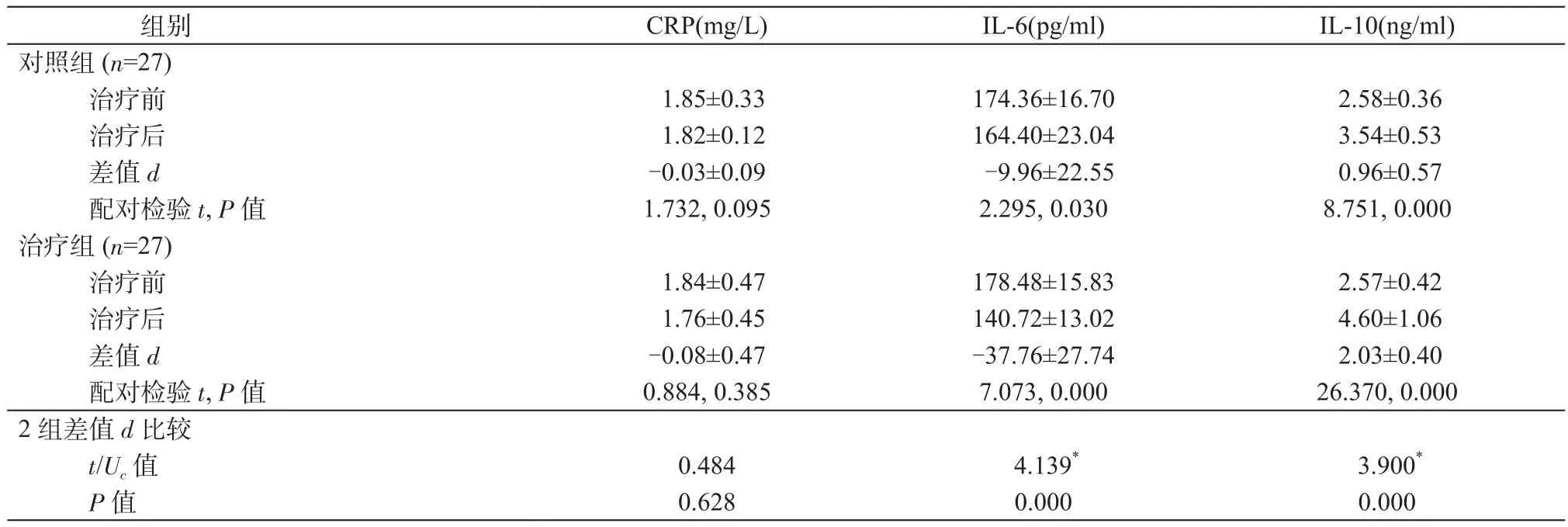
表4 2组治疗前后血清CRP、IL-6、IL-10水平比较Table 4 Comparison of serum CRP, IL-6 and IL-10 between 2 groups before and after treatment
3 讨 论
MS发病率逐年升高,已经严重威胁人类的生命健康。目前,研究发现MS患者体内肠道菌群不仅与人体能量代谢有关,而且与机体免疫反应有着密切关系。在中医学中,MS散见于“湿阻”“肥胖”“消渴”等,MS与“脾”的关系最为密切[4],“脾失健运”是MS发生的重中之重[9]。现代研究提示,中医“脾胃学说”与MS最为密切,“脾胃学说”亦是中医学中与肠道菌群最直接相关的理论[10-12]。常规西医药物治疗对于肠道菌群具有重要影响,但参连联合常规西药治疗对MS患者的肠道菌群及免疫反应的影响目前还尚不完全清楚。基于此,本研究拟纳入部分患者,观察参连联合常规西医治疗对湿热中阻兼气虚型MS患者效果,以期为探索“肠道菌群-免疫反应”机制提供参考。
课题组前期研究发现,以益气燥湿法为代表的参连合用能有效降低患者糖脂水平,改善患者胰岛素抵抗情况[6]。但本研究结果表明,参连联合常规西医疗法可以使MS患者肠道内乳酸杆菌、双歧杆菌含量升高,肠杆菌含量下降,其中治疗组乳酸杆菌含量升高差异有统计学意义,而肠道总菌含量未见明显变化。同时,上述疗法在降低血糖、血脂方面短期内未见明显优势,与前期临床研究结果[6]不甚相符。其原因可能是参连通过改变患者的肠道菌群结构,进而发挥远期的调节MS患者糖脂代谢的作用。
肠道菌群是人体最大的微生态系统,负责人体内糖、脂、蛋白质等多种营养物质的代谢与转化调节,肠道菌群失调可引起低度炎症,糖脂代谢紊乱会诱发肥胖和胰岛素抵抗,加重糖尿病的发生和发展[13]。研究发现,糖尿病患者肠道菌群失调主要表现为拟杆菌门与大肠杆菌等致病杆菌含量升高,双歧杆菌含量减少;高脂血症大鼠肠道菌群失调主要表现为乳酸杆菌及双歧杆菌的含量减少,而肠杆菌的含量相对增多;其中肠道双歧杆菌、乳酸杆菌等可分解蛋白质,产生抑制血管紧张素转换酶活性的多肽,进而降低血压[14]。
此外,肠道菌群介导的免疫炎性反应在MS发生发展中起着重要作用[15-18]。就机体免疫系统而言,T淋巴细胞亚群所包含的调节性T细胞(regulatory T cells, Treg)与辅助性T细胞17(helper T cells 17, Th17)分别通过分泌相关免疫因子参与机体炎性免疫应答、抑制免疫炎性反应、维持机体免疫稳态。IL-10是Treg分泌的重要抗炎因子之一,通过抑制主动免疫,减轻机体炎性损伤;而IL-6是Th17分泌的一种重要炎性因子,参与机体免疫炎性损伤的进程。本研究发现治疗组IL-10上升幅度及IL-6下降幅度均大于对照组,表明参连对MS患者起到了积极的免疫因子调控作用,进一步证实肠道菌群等代谢产物与Treg/Th17介导的外周免疫平衡的确切关联[19-21]。
本研究虽然样本量较小,观察时间短,但是发现参连联合常规西药治疗MS患者可提高外周血免疫炎性因子IL-10水平,降低IL-6水平,明显升高肠道乳酸杆菌含量,上述结果对于探索参连联合常规西医治疗MS患者“肠道菌群-免疫反应”机制研究具有重要意义。

