慢性HCV感染DAA应答特点和长期预后观察研究
王文鑫,刘红虹,毕京峰,王福生,福军亮
慢性丙型肝炎(chronic hepatitis C, CHC)是HCV感染所致的全球流行性疾病。2015年全球7100万人患有慢性HCV感染,39.9万人死于HCV相关的肝硬化或肝细胞癌(hepatocellular carcinoma,HCC)[1]。成功清除HCV有助于减少肝纤维化的发生,甚至逆转肝纤维化和肝硬化,降低肝硬化患者的病死率[2-3]。2015年之前,我国的慢性HCV感染治疗药物以干扰素为主,治疗方案多为聚乙二醇干扰素α(pegylated-interferon-alpha, Peg-IFN-α)联合利巴韦林(ribavirin, RBV),简称PR方案[4]。该方案不良反应多,疗程较长,具有人群限制性,特别是失代偿期肝硬化(decompensated-liver cirrhosis, DLC)患者不宜采用该方案,而且持续病毒学应答(sustained virological response, SVR)率相对较低。2013年之后,丙型肝炎的治疗逐步进入全口服直接抗病毒药物(direct-acting antiviral agents,DAA)治疗时代。目前研究表明多种DAA治疗方案获得的SVR率基本都>95%,且较少有人群限制性[5],患者耐受性良好,不良事件发生率低。目前DAA治疗更多的关注SVR率,而对于HCV感染不同疾病阶段的患者治疗后应答特点及长期随访性数据相对较少。另外,我国由于DAA上市时间较晚,其治疗HCV感染相关疾病的数据更为有限。因此,本研究前瞻性入组慢性HCV感染不同疾病阶段的患者,评估DAA治疗后病毒学应答特点和规律,并在停药后长期随访患者的疾病进展情况,为制定更为合理的DAA治疗和监测方案提供数据支撑。
1 对象与方法
1.1 研究对象 将2016年7月—2017年3月就诊于中国人民解放军总医院第五医学中心的CHC、代偿期丙型肝炎肝硬化(compensated-liver cirrhosis,CLC)和DLC患者纳入研究,共127例。纳入标准:①CHC、CLC和DLC患者的诊断均符合《丙型肝炎防治指南(2015年版)》[6];②自愿接受DAA治疗;③签署知情同意书者。排除标准:①患有自身免疫性肝炎、甲状腺疾病、急慢性肾脏疾病、精神性疾病、恶性肿瘤的患者,以及控制不佳的糖尿病、高血压、心脏病等;②同时应用与DAA有相互作用并影响DAA代谢的药物,如抗结核药、抗癫痫药。
所有患者均采用无干扰素的口服DAA方案,DAA治疗方案选择原则如下:①依据指南建议及患者HCV基因型确定DAA基础治疗方案,基因1型建议采用索非布韦/来迪派韦(sofosbuvir/ledipasvir, SOF/LDV)或索非布韦/达拉他韦(sofosbuvir/daclatasvir, SOF/DCV)方案,基因2型建议采用SOF联合RBV或SOF/DCV方案,非1/2型建议采用SOF/DCV方案,疗程12~24周;在此基础上结合患者个人意愿及经济条件选择方案。②根据患者是否存在CLC、PR经治情况、其他疗效负性因子(如PLT<75×109/L),以及是否存在RBV禁忌证,决定是否联合RBV 治疗12~24周。③DLC采用无RBV方案。使用详情见表1。所有患者停药后进行2年的随访观察。该研究通过我中心医学伦理委员会批准。
纳入的127例慢性HCV感染者中,男63例,女64例,年龄50.00(43.00,59.00)岁。CHC患者85例(CHC组),CLC患者32例(CLC组),DLC患者10例(DLC组)。3组患者入组时年龄、性别、病毒学指标、DAA治疗方案、合并其他基础疾病等情况见表1。

表1 3组患者接受DAA治疗前的基线特征Table 1 Baseline characteristics of patients in 3 groups before DAA therapy
1.2 主要试剂及仪器 所有患者的样本均在我院中心实验室进行检测,采用的方法、仪器和试剂如下:血清HCV RNA定量检测使用COBAS Taq Man48实时荧光定量PCR仪(美国罗氏公司)。通过SLAN 96P实时荧光定量PCR仪(上海宏石公司)对HCV基因型进行测序和鉴定。HCV RNA检测下限为15 IU/ml。
1.3 研究方法 收集入组患者年龄、性别,HCV感染所处疾病阶段,合并其他基础疾病以及相关用药情况,血清HCV RNA定量及HCV基因型,血清生化指标,血常规。
开始DAA治疗后每周检测HCV RNA定量,直至阴性,之后按照开始治疗后8周、12周、24周,以及停止DAA治疗后12、24、48、72、96周检测HCV RNA定量、肝功能、肾功能、血常规、甲胎蛋白、腹部彩超等检查;治疗期间和停止治疗后的每个随访点询问并记录患者是否出现乏力、纳差、恶心、腹胀、腹痛、腹泻等不适症状(图1)。
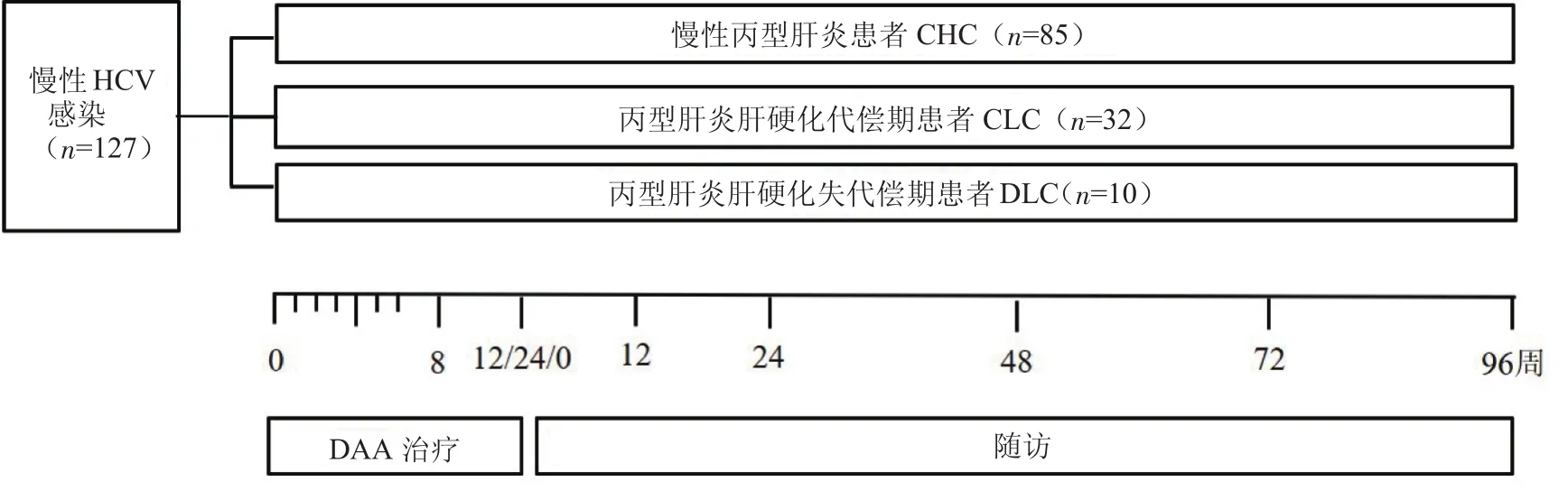
图1 研究方案示意图Figure 1 The Schematic Diagram of Research Design
1.4 病毒学应答定义 超快速病毒学应答(super rapid virological response, SRVR):抗病毒治疗1周时外周血HCV RNA不可测;快速病毒学应答(rapid virological response, RVR):抗病毒治疗4周时外周血HCV RNA不可测;持续病毒学应答(sustained virologic response, SVR):抗病毒治疗结束后第12周和24周外周血检测不到HCV RNA,表示为SVR12 或SVR24。
1.5 统计学处理 应用SPSS 25.0 统计软件进行数据分析处理。不符合正态分布的数据用中位数和四分位数[M(P25,P75)]表示,3组间比较用Kruskal-Wallis秩和检验,两两比较用Mann-WhitneyU检验,α´=2α/[k(k-1)](k为分组数);分类资料用频数和百分率表示,3组间比较用R×Cχ2检验,两两比较用χ2检验,α´= 2α/[k(k-1)](k为分组数)。用Logistic回归分析HCV RNA转阴速度影响因素,所有统计分析均采用双侧检验,α=0.05。P<0.05表示差异具有统计学意义。
2 结 果
2.1 SVR12 所有入组患者在DAA治疗结束时HCV RNA检测均为阴性。CHC组和CLC组各有1例患者在停药后12周时未能进行HCV RNA检测,按照未达SVR12纳入统计分析。CHC、CLC和DLC组的SVR12率分别为98.82%(84/85)、96.88%(31/32)、100%(10/10),组间比较差异无统计学意义(χ2=0.799,P=0.671)。
2.2 3组患者HCV RNA转阴速度比较 共126例患者达到RVR,1例CLC患者在治疗6周时HCV RNA检测阴性。3组患者转阴速度的差别:CHC、CLC、DLC 3组患者SRVR(即治疗1周HCV RNA检测阴性)率分别为52.94%(45/85)、12.50%(4/32)和10.00%(1/10);开始治疗后第2周HCV RNA检测阴性的患者分别为40.00%(34/85)、65.63%(21/32)和70.00%(7/10);开始治疗后第3~4周HCV RNA检测阴性的患者分别为7.06%(6/85)、18.75%(6/32)和20.00%(2/10);通过Kruskal-Wallis秩和检验发现3组患者HCV RNA达到低于检测下限的速度存在统计学差异(H=20.695,P<0.001)。3组之间两两比较,CHC组明显快于CLC组和DLC组(P均<0.05),CLC组和DLC组患者HCV RNA达到低于检测下限的速度之间差异无统计学意义(P>0.05)(图2)。

图2 3组HCV感染不同疾病阶段患者不同时间外周血HCV RNA转阴率的比较(%)Figure 2 Comparison of the rates of HCV RNA undetectable at different week among different disease stages(%)
2.3 HCV RNA转阴速度的影响因素分析 进一步通过Logistic回归分析了影响患者DAA治疗获得SRVR的相关因素,发现肝硬化是影响患者获得SRVR的独立预测因素,合并肝硬化患者达到SRVR的几率降低88.00%(P<0.05)。患者的年龄、性别、基线的病毒载量水平、HCV 基因型、是否PR经治、是否合并其他基础疾病以及DAA治疗方案等因素对于获得SRVR没有明显影响,见表2。
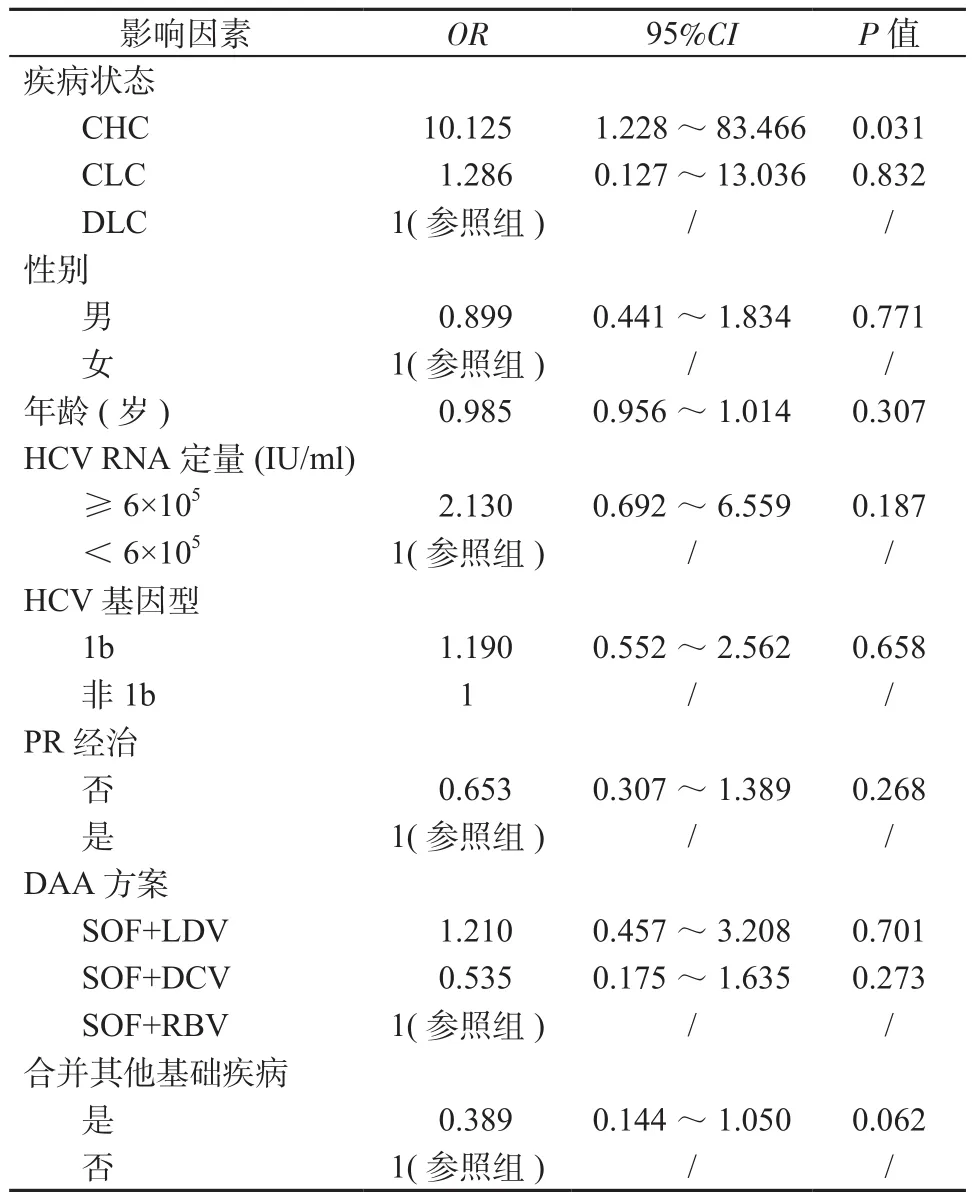
表2 SRVR影响因素的Logistic回归分析结果Table 2 Factors for SRVR based on logistic regression
2.4 长期随访情况 在获得SVR12的125例患者中1例基因3b型的CLC患者在停止治疗6个月时发生病毒学复发;其余124例患者在2年随访期间未发现病毒学复发。CHC和CLC患者在2年随访期间未出现肝功能恶化或失代偿情况。基因1b型的DLC患者中有1例出现反复腹水,并出现消化道出血1次,另1例在随访9个月时发现HCC。
3 讨 论
据推算,我国HCV感染者约为1000万[7]。肝硬化和肝癌是主要的死亡原因,肝硬化年发生率为3%~4%,一旦进展至失代偿期,患者10年生存率为25%[8]。DAA治疗是目前主要推荐的治疗方案,相较于PR方案,DAA在已知主要基因型和基因亚型的HCV感染者中SVR都能>90%[9-11],并且在多个不同临床阶段的人群中方案统一,疗程短,药物不良反应小且相互作用较少,因此可以减少治疗前的检测和治疗中的监测,更便于对慢性HCV感染者实施治疗和管理。
但DAA在我国上市时间较晚,药物可及性在近两年才得到显著改善。在此之前很多患者自行购买国外仿制药物进行治疗,存在不规范用药的问题。国内应用经验主要是依据国内外临床试验数据和部分小样本研究获得,而且大部分数据来源于慢性肝炎阶段的患者,而对肝硬化,尤其是DLC的DAA治疗过程中病毒应答特点和长期随访观察较少。为此,我们入组了CLC和DLC患者,进行DAA治疗效果和安全性观察,同时与慢性肝炎患者进行比较分析。我们发现肝硬化患者包括DLC患者应用DAA治疗后达到的SVR12率与慢性肝炎患者没有明显差异,且未出现药物相关的严重不良反应,安全性良好。Zeuzem等[12]发现肝纤维化程度及是否存在肝硬化并不影响丙型肝炎初治患者应用DAA的SVR率,与本研究结果基本一致。也有研究认为DLC患者DAA治疗效果低于无肝硬化及CLC患者[13-15]。患者入组数量、病毒基因型差异、治疗前的疾病严重程度、以及是否曾经治疗可能是导致研究结果差异的原因。
我们进一步比较了本研究不同疾病阶段患者DAA治疗后HCV RNA转阴速度是否存在差别。本研究发现存在肝硬化的丙型肝炎患者接受DAA治疗HCV RNA的转阴速度慢于无肝硬化的患者,而两类患者在治疗前HCV RNA水平、HCV基因型方面无明显差别,提示肝硬化可能是影响应答速率的重要因素。Logistic回归分析进一步证实肝硬化患者达到SRVR的几率大幅下降,且肝硬化是获得SRVR的独立预测因素。除了肝纤维化严重程度之外,合并基础疾病可能也是影响因素之一。肝硬化患者合并基础疾病的比例明显高于非肝硬化患者,而且合并基础疾病的患者获得SRVR的几率也明显下降,但可能由于病例数较少,回归分析未发现统计学差异。Afdhal等[16]发现相较于12周DAA治疗,24周疗程仅增加发生药物不良反应的风险,对SVR率并无显著提高。Backus等[17]入组4365例HCV感染者,给予不足12周的DAA治疗,发现DAA治疗4周时HCV RNA检测阴性的患者SVR率显著高于4周时HCV RNA检测阳性的患者,而在接受12周治疗的患者中,治疗4周时患者HCV RNA检测是否阴性,其SVR率间差异无统计学意义,提示HCV RNA转阴慢的患者可以通过延长DAA治疗时长来获得SVR,HCV RNA转阴快的患者可以适当缩短DAA治疗时长。我们研究中入组的肝硬化患者几乎均在4周内达到HCV RNA检测阴性,这可能是其SVR12率与非肝硬化患者无显著差异的原因。同时也提示肝硬化患者存在缩短疗程的可能。但是对于未获得SRVR的肝硬化患者能否缩短疗程须要进一步研究。
本研究入组的DLC患者全部达到了SVR12,但仍有2例患者分别出现肝功能反复失代偿和肝细胞肝癌。这提示,对于存在肝硬化的慢性HCV感染者,即使通过有效的DAA治疗获得病毒持久抑制,但是仍有可能出现疾病进展甚至严重不良事件。有研究发现,自发或通过抗病毒药物治疗达到血清HCV RNA持续阴性的患者外周血淋巴细胞和肝组织中仍存在HCV RNA[18-19]。另一方面,现有检测方法的精度和HCV基因组缺陷表达也可能导致HCV RNA假阴性的出现[20]。
本研究尚存在病例数较少、随访时间相对较短的局限,尤其是DLC患者不足20例,计算得到的百分率代表性较差。但这些数据初步表明,DAA治疗对于各个疾病阶段的HCV感染者均有较好的安全性和SVR率。但合并肝硬化的患者HCV RNA转阴速度显著慢于无肝硬化患者。另外,对于肝硬化患者,即使病毒持久抑制,仍须定期监测肝脏生化指标、肿瘤学标志物及影像学结果,警惕严重并发症和肿瘤发生风险。

