LncRNA PCED1B-AS1调控NLRP3促进巨噬细胞清除结核分枝杆菌的机制研究
谢玉瑾,宋雪云,马永春
结核病是一种由单一传染源引起的传染性疾病,严重威胁人类生命健康[1]。结核分枝杆菌属于革兰阳性菌,主要侵犯肺脏,引发肺结核病。结核分枝杆菌主要在巨噬细胞内寄生,当人体免疫力较强时,巨噬细胞可以杀灭细胞内寄生的病原菌,而当人体免疫力较弱时,巨噬细胞免疫反应能力降低,病原菌在巨噬细胞内长期存在[2]。长链非编码RNA(long-non-coding RNA, lncRNA)在人体免疫反应、炎症反应、细胞运动、新陈代谢等过程中发挥作用,是近些年生命科学领域研究中的重点和热点[3]。研究发现,lncRNA和结核病发生有关,参与巨噬细胞清除结核分枝杆菌过程,可能是疾病治疗的分子靶标[4]。lncRNA PCED1BAS1是在结核病患者中表达下调的调节因子,影响巨噬细胞凋亡,可能是结核病进展中的抑制因子[5],目前尚未明确其在巨噬细胞清除结核分枝杆菌以及分泌炎症因子中的作用。本研究以巨噬细胞RAW264.7作为研究对象,探讨PCED1B-AS1在巨噬细胞清除结核分枝杆菌以及分泌炎症因子中的作用和可能机制,旨在为分子靶向治疗结核病提供参考。
1 材料与方法
1.1 材料 巨噬细胞RAW264.7购自南京科佰生物科技有限公司;结核分枝杆菌H37Rv购自美国ATCC;pcDNA-PCED1B-AS1、pcDNA均由云舟生物科技(广州)有限公司构建;核苷酸结合寡聚化结构域样受体3(NLR family pyrindomain containing 3, NLRP3) 小干扰RNA(small interfering RNA,siRNA)、siRNA control由汉恒生物科技(上海)有限公司构建;NLRP3抗体购自美国Abcam;引物由南京金斯瑞生物技术有限公司合成。
1.2 细胞感染模型构建 巨噬细胞于含有1%双抗、10%胎牛血清的RPMI1640中培养,培养温度37 ℃,培养箱中含有5%的CO2,细胞密度超过90%以后,进行细胞传代。感染结核分枝杆菌的巨噬细胞应为处于对数生长期的细胞,把细胞接种到24孔板内,以H37Rv感染巨噬细胞(感染复数为5),继续培养4 h以后,添加PBS溶液将细胞洗涤,然后添加新鲜的细胞培养液继续培养。把没有感染H37Rv的巨噬细胞命名为Control组,将感染H37Rv以后的巨噬细胞设置为Control+H37Rv组。收集Control组、Control+H37Rv组细胞培养48 h,用于1.3中检测。
1.3 PCED1B-AS1、NLRP3 和 TNF-α、IL-6 mRNA水平检测 在细胞内添加Trizol试剂,用移液枪反复吹打混合,促进细胞充分裂解,然后按照常规方法提取细胞总RNA。将提取的RNA沉淀溶解在体积为20 μl的RNase-free水中,放在-80 ℃的冰箱中保存备用。吸取1 μl的RNasefree水将紫外分光光度计清洗,然后吸取1 μl的RNA用于检测A260/A280的比值,比值在1.8~2.0之间表示纯度良好。cDNA合成反应如下:在EP管中添加 1 μl的 Oligo(dT)、1 μg 的 RNA、1 μl的Random primer,最后加ddH2O至总体积达到13 μl,在普通PCR仪上设置65 ℃反应13 min,置于冰上,继续添加 1 μl的 dNTP、5 μl的 5×RT Reaction Buffer、1 μl 的 RNase inhibitor、1 μl 的M-MLV RTase,加入ddH2O至总体积为25 μl,在普通PCR仪上设置37 ℃条件结合60 min,85 ℃条件结合5 s,放在-20 ℃中保存。PCR的引物序列如下。PCED1B-AS1上游:TCAAGCCAATCAGCTGACAC;下游:AAACAAATGCCCTGCTTGAC。NLRP3上 游:CCCTGCATTTTGTTGTTGTTG; 下游:CCTGCTTCTCACATGTCGTC。TNF-α上游:ACGGCATGGATCTCAAAGAC;下游:GTGGGTGAGGAGCACGTAGT。IL-6上 游:ATGAACTCCTTCTCCACAAGCGC;下游:GAAGAGCCCTCAGGCTGGACTGG。GAPDH(内参)上游:GCACCGTCAAGGCTGAGAAC;下游:TGGTGAAGACGCCAGTGGA。PCR反应体系为:2 μl的上游引物、2 μl的下游引物、10 μl的 2×All-in-one qPCR mix、2 μl的 cDNA模板、0.4 μl的 50×ROX reference,加入 ddH2O 至总体积为20 μl,在荧光定量PCR仪中,设置预变性条件为95 ℃ 10 min,变性条件为95 ℃ 10 s,退火条件为56 ℃ 20 s,延伸条件为72 ℃ 30 s,一共进行40个循环。根据反应得到的CT值,经2-△△CT方法计算基因表达变化。
1.4 细胞转染 将巨噬细胞种植到6孔板内准备细胞转染。转染步骤如下:①用50 μl不含血清的RPMI1640把4 μg质粒稀释,混匀,放在室温中结合5 min;②用50 μl不含血清的RPMI1640把5 μl的转染试剂Lipofectamine 2000稀释,混匀,放在室温中结合5 min;③将步骤①和②中的试剂混合,在室温条件下孵育20 min;④收集步骤③中的混合物,添加到6孔板内,放在培养箱中继续培养6 h。更换细胞培养液,继续培养12 h。将pcDNAPCED1B-AS1、pcDNA转染巨噬细胞后,用H37Rv感染(感染复数为5),设置为PCED1BAS1+H37Rv组、Vector+H37Rv组,Control+H37Rv组处理方法同1.2。收集Control+H37Rv、PCED1BAS1+H37Rv、Vector+H37Rv组细胞,按照1.3中方法利用qRT-PCR检测PCED1B-AS1和TNF-α、IL-6 mRNA表达水平,同时用于1.5和1.6中检测。
1.5 巨噬细胞清除结核分枝杆菌检测 巨噬细胞感染后继续培养72 h,收集细胞裂解物,然后将裂解物种植在含有10% OADC的琼脂板上,培养24 d,计数结核分枝杆菌菌落量。
1.6 Western blot检测NLRP3蛋白表达 收集巨噬细胞感染48 h以后的Control+H37Rv组、PCED1B-AS1+H37Rv组、Vector+H37Rv组细胞,在细胞中添加PBS溶液将细胞反复洗涤2次,最后加入RIPA裂解溶液,放在冰上充分裂解20 min,以4 ℃,1000×g离心10 min,将上清转移到新的EP管中,经过BCA方法检测蛋白浓度以后,在蛋白样品中添加5×Loading Buffer充分混合,用于SDS-PAGE电泳。将玻璃板清洗干净并组装,制备10%的SDS-PAGE凝胶,在加样孔内按照每个孔40 μg蛋白添加样品。把电泳电压设置为80 V,观察溴酚蓝前端部分进入到分离胶以后,将电泳仪的电压设置为100 V,等到溴酚蓝进入到玻璃板的底部以后,关闭电源,将凝胶取出。根据需要将NC膜裁剪,然后浸泡在转移缓冲液中备用。转膜的电压设置在50 V,转膜装置放在冰上进行,转膜持续40 min之后,将电源关闭。将NC膜浸泡在5%脱脂奶粉中,把非特异性的结合位点封闭。然后将NC膜放在抗体孵育袋中,然后添加按照1∶1000稀释以后的NLRP3抗体孵育液,在4 ℃的环境中结合过夜。最后将NC膜置于1∶2000稀释以后的二抗孵育液中,在室温条件下结合2 h。ECL方法显色以后,分析目的蛋白的表达水平。NLRP3蛋白水平=NLRP3条带灰度值÷GAPDH灰度值。
1.7 NLRP3 siRNA影响PCED1B-AS1的作用检测 在巨噬细胞中共转染NLRP3 siRNA、pcDNAPCED1B-AS1 和 siRNA Control、pcDNA-PCED1BAS1,然后用H37Rv感染(感染复数为5),设置为PCED1B-AS1+si-NLRP3+H37Rv组和PCED1BAS1+si-NC+H37Rv组,按照1.3、1.5、1.6中方法检测细胞中TNF-α、IL-6 mRNA水平和细胞清除结核杆菌水平、NLRP3蛋白表达水平。
1.8 统计学处理 实验重复3次,每组设置3个复孔。用SPSS 21.0软件统计分析实验数据,符合正态分布的定量数据用±s表示,2组间的比较用t检验,多组间的比较用单因素方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1 H37Rv感染对巨噬细胞中PCED1B-AS1和TNF-α、IL-6 mRNA表达影响 与Control组比较,Control+H37Rv组巨噬细胞中PCED1B-AS1水平降低,TNF-α、IL-6 mRNA水平升高(P均<0.05)。详见表1。
表 1 Control组 和 Control+H37Rv组 中 PCED1B-AS1和 TNF-α、IL-6 mRNA 水平比较(±s)Table 1 Comparison of PCED1B-AS1, TNF-α and IL-6 mRNA levels in Control group and Control+H37Rv group(±s)

表 1 Control组 和 Control+H37Rv组 中 PCED1B-AS1和 TNF-α、IL-6 mRNA 水平比较(±s)Table 1 Comparison of PCED1B-AS1, TNF-α and IL-6 mRNA levels in Control group and Control+H37Rv group(±s)
组别 nPCED1B-AS1 TNF-α mRNA IL-6 mRNA Control组 9 1.00±0.15 1.00±0.11 1.00±0.12 Control+H37Rv 组 9 0.45±0.05 3.84±0.22 2.15±0.16 t值 10.436 34.639 17.250 P值 0.000 0.000 0.000
2.2 pcDNA-PCED1B-AS1对H37Rv感染的巨噬细胞中PCED1B-AS1和TNF-α、IL-6 mRNA表达影响 pcDNA-PCED1B-AS1转染后,PCED1B-AS1表达水平升高。与Control+H37Rv组、Vector+H37Rv组相比,PCED1B-AS1+H37Rv组巨噬细胞中TNF-α、IL-6 mRNA水平明显升高,差异均具有统计学意义(P均<0.05)。详见表2。上调PCED1B-AS1促进H37Rv感染的巨噬细胞中TNF-α、IL-6 mRNA 表达。
表2 Control+H37Rv组、Vector+H37Rv组及PCED1BAS1+H37Rv组 中 PCED1B-AS1和 TNF-α、IL-6 mRNA水平比较(±s)Table 2 Comparison of PCED1B-AS1, TNF-α and IL-6 mRNA levels in Control+H37Rv group, Vector+H37Rv group and PCED1B-AS1+H37Rv group(±s)
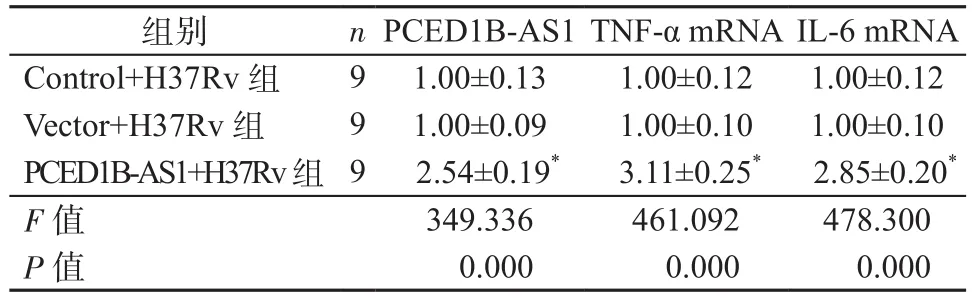
表2 Control+H37Rv组、Vector+H37Rv组及PCED1BAS1+H37Rv组 中 PCED1B-AS1和 TNF-α、IL-6 mRNA水平比较(±s)Table 2 Comparison of PCED1B-AS1, TNF-α and IL-6 mRNA levels in Control+H37Rv group, Vector+H37Rv group and PCED1B-AS1+H37Rv group(±s)
注:*.与Control+H37Rv组、Vector+H37Rv组相比,P均<0.05
组别 n PCED1B-AS1 TNF-α mRNA IL-6 mRNA Control+H37Rv 组 9 1.00±0.13 1.00±0.12 1.00±0.12 Vector+H37Rv 组 9 1.00±0.09 1.00±0.10 1.00±0.10 PCED1B-AS1+H37Rv组 9 2.54±0.19* 3.11±0.25* 2.85±0.20*F值 349.336 461.092 478.300 P值 0.000 0.000 0.000
2.3 过表达PCED1B-AS1对巨噬细胞清除结核分枝杆菌的影响 与Control+H37Rv组、Vector+H37Rv组相比,PCED1B-AS1+H37Rv组巨噬细胞中结核分枝杆菌菌落量明显降低,差异均具有统计学意义(P均<0.05)。详见表3。过表达PCED1BAS1促进巨噬细胞清除结核分枝杆菌。
表3 Control+H37Rv组、Vector+H37Rv组及PCED1BAS1+H37Rv组中结核分枝杆菌菌落量比较(±s)Table 3 Comparison of Mycobacterium tuberculosis colonies in Control+H37Rv group, Vector+H37Rv group and PCED1B-AS1+H37Rv group(±s)

表3 Control+H37Rv组、Vector+H37Rv组及PCED1BAS1+H37Rv组中结核分枝杆菌菌落量比较(±s)Table 3 Comparison of Mycobacterium tuberculosis colonies in Control+H37Rv group, Vector+H37Rv group and PCED1B-AS1+H37Rv group(±s)
注:*.与Control+H37Rv组、Vector+H37Rv组相比,P均<0.05
组别 n 菌落量(×105)(CFU)Control+H37Rv 组 9 3.26±0.25 Vector+H37Rv 组 9 3.34±0.36 PCED1B-AS1+H37Rv 组 9 2.23±0.14*F值 48.877 P值 0.000
2.4 过表达PCED1B-AS1对H37Rv感染的巨噬细胞中NLRP3蛋白表达影响 与Control+H37Rv组、Vector+H37Rv组相比,PCED1B-AS1+H37Rv组巨噬细胞中NLRP3蛋白水平明显升高,差异均具有统计学意义(P均<0.05)。详见图1和表4。过表达PCED1B-AS1促进H37Rv感染的巨噬细胞中NLRP3蛋白表达。
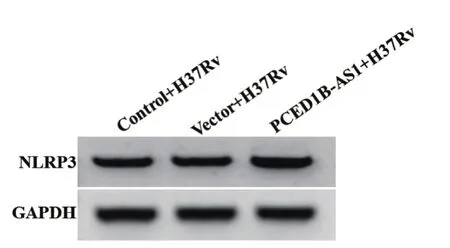
图1 Western blot检测pcDNA-PCED1B-AS1转染后经H37Rv感染的巨噬细胞中NLRP3蛋白表达变化Figure 1 Change of NLRP3 protein expression in H37Rvinfected macrophages after pcDNA-PCED1B-AS1 transfection detected by Western blot detection
表4 Control+H37Rv组、Vector+H37Rv组及PCED1BAS1+H37Rv组中NLRP3 mRNA和蛋白表达水平比较(±s)Table 4 Comparison of NLRP3 mRNA and protein expression levels in Control+H37Rv group, Vector+H37Rv group and PCED1B-AS1+H37Rv group(±s)

表4 Control+H37Rv组、Vector+H37Rv组及PCED1BAS1+H37Rv组中NLRP3 mRNA和蛋白表达水平比较(±s)Table 4 Comparison of NLRP3 mRNA and protein expression levels in Control+H37Rv group, Vector+H37Rv group and PCED1B-AS1+H37Rv group(±s)
注:*.与Control+H37Rv组、Vector+H37Rv组相比,P均<0.05
组别 n NLRP3 mRNA NLRP3蛋白Control+H37Rv 组 9 1.00±0.10 0.45±0.04 Vector+H37Rv 组 9 0.97±0.09 0.47±0.06 PCED1B-AS1+H37Rv 组 9 3.23±0.03* 0.95±0.09*F值 2387.700 162.677 P值 0.000 0.000
2.5 siRNA NLRP3对过表达PCED1B-AS1影响巨噬细胞清除结核分枝杆菌以及表达TNF-α、IL-6 mRNA的作用 与PCED1B-AS1+si-NC+H37Rv组比较,PCED1B-AS1+si-NLRP3+H37Rv组巨噬细胞中NLRP3蛋白表达水平降低,NLRP3 mRNA、TNF-α、IL-6 mRNA水平降低,细胞裂解物中结核分枝杆菌菌落量升高(P均<0.05),见图2和表5。siRNA NLRP3减弱过表达的PCED1B-AS1巨噬细胞中TNF-α、IL-6 mRNA表达水平,并且siRNA NLRP3可削弱过表达的PCED1B-AS1巨噬细胞清除结核分枝杆菌功能。

图2 pcDNA-PCED1B-AS1以及NLRP3 siRNA转染以后经H37Rv感染的巨噬细胞中NLRP3蛋白表达差异Figure 2 Difference of NLRP3 protein expression levels after transfection with pcDNA-PCED1B-AS1 and NLRP3 siRNA in H37Rv-infected macrophages
表5 PCED1B-AS1+si-NC+H37Rv组和PCED1B-AS1+si-NLRP3+H37Rv组中NLRP3 mRNA和蛋白水平、TNF-α、IL-6 mRNA水平和结核分枝杆菌菌落量比较(±s)Table 5 Comparison of NLRP3 mRNA and protein expression levels, TNF-α, IL-6 mRNA levels and Mycobacterium tuberculosis colonies in PCED1B-AS1+si-NC+H37Rv group and PCED1B-AS1+si-NLRP3+H37Rv group(±s)
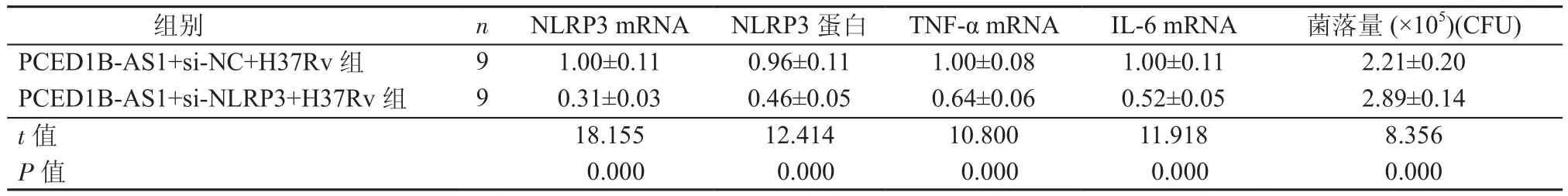
表5 PCED1B-AS1+si-NC+H37Rv组和PCED1B-AS1+si-NLRP3+H37Rv组中NLRP3 mRNA和蛋白水平、TNF-α、IL-6 mRNA水平和结核分枝杆菌菌落量比较(±s)Table 5 Comparison of NLRP3 mRNA and protein expression levels, TNF-α, IL-6 mRNA levels and Mycobacterium tuberculosis colonies in PCED1B-AS1+si-NC+H37Rv group and PCED1B-AS1+si-NLRP3+H37Rv group(±s)
组别 n NLRP3 mRNA NLRP3蛋白 TNF-α mRNA IL-6 mRNA 菌落量(×105)(CFU)PCED1B-AS1+si-NC+H37Rv 组 9 1.00±0.11 0.96±0.11 1.00±0.08 1.00±0.11 2.21±0.20 PCED1B-AS1+si-NLRP3+H37Rv 组 9 0.31±0.03 0.46±0.05 0.64±0.06 0.52±0.05 2.89±0.14 t值 18.155 12.414 10.800 11.918 8.356 P值 0.000 0.000 0.000 0.000 0.000
3 讨 论
结核病是一种十分常见的传染病,其发生和结核分枝杆菌的感染有关[6]。结核分枝杆菌诱发结核病的过程较为复杂,主要通过寄生在巨噬细胞内达到在体内长期存在的目的[7]。当机体免疫力较强时,巨噬细胞被活化,分泌大量炎症因子,促进免疫反应,细胞凋亡增加,结核分枝杆菌被清除[8]。而当机体免疫力较低时,巨噬细胞免疫反应水平下降,结核分枝杆菌则长期且大量存在于巨噬细胞内[9]。研究发现,结核分枝杆菌促进巨噬细胞中炎症因子的表达,这些炎症因子包括TNF-α、IL-6等[10]。本研究发现,结核分枝杆菌感染的巨噬细胞中TNF-α、IL-6 mRNA表达水平升高,这与上述的研究结果相符合,说明结核分枝杆菌诱导巨噬细胞分泌炎症因子。
LncRNA长度>200 nt,在人体内的多种组织如脑、肝、肺、肾中均有表达,并且对不同类型的细胞分化、衰老、氧化应激、炎症因子分泌等有调节作用[11]。很多研究显示,lncRNA在人类疾病中发挥作用,如心肌病、关节炎、糖尿病等[12-14]。近些年也有很多实验发现lncRNA与结核病的进展有关,结核病患者体内有着与健康人差异较大的基因表达谱,而且这些基因多数被证明与结核病的恶性进展有关[15-16]。PCED1B-AS1是近些年发现的调控因子,参与肿瘤进展,能够促进胶质瘤、胶质母细胞瘤细胞的恶性生物学行为[17-18]。在结核病患者中发现PCED1B-AS1异常低表达,敲除PCED1B-AS1可降低巨噬细胞凋亡水平,增加细胞自噬,而上调PCED1B-AS1则有相反的作用,PCED1B-AS1可能通过促进细胞凋亡发挥抗肺结核的作用[5]。本研究发现结核分枝杆菌感染以后的巨噬细胞中PCED1B-AS1表达水平下降,并且上调PCED1B-AS1可加强巨噬细胞对结核分枝杆菌的清除作用,提高巨噬细胞中TNF-α、IL-6 mRNA的表达水平,这证明PCED1B-AS1可能通过促进巨噬细胞免疫反应和清除结核分枝杆菌发挥抗结核作用。
进一步研究PCED1B-AS1的可能机制,发现上调PCED1B-AS1可促进巨噬细胞中NLRP3蛋白表达。NLRP3是NLR蛋白家族成员,被激活后可促进NLRP3炎症小体作用发挥[19-21]。NLRP3在慢性阻塞性肺疾病、急性肺损伤、支气管哮喘等过程中发挥作用[22-24]。在肺结核的研究中证实,结核分枝杆菌能够激活NLRP3,诱导巨噬细胞抗结核的免疫反应[25-27]。本研究发现,下调NLRP3可以逆转PCED1B-AS1对巨噬细胞分泌炎症因子和清除结核分枝杆菌的作用,提示PCED1B-AS1可能通过NLRP3参与巨噬细胞抗结核过程。
综上所述,上调PCED1B-AS1可促进巨噬细胞对结核分枝杆菌的清除,并且可以诱导巨噬细胞分泌炎症因子,机制可能与下调NLRP3有关,目前对PCED1B-AS1通过何种靶向机制最终影响NLRP3参与巨噬细胞抗结核分枝杆菌的调控机制尚不明确,将在后续的实验中进行探讨。本次实验为研究PCED1B-AS1在结核病发生中的作用和机制提供了参考,为靶向分子治疗结核病提供了可能思路。

