长托宁通过下调miR-217表达抑制缺氧/复氧诱导的大鼠心肌细胞H9C2损伤的机制研究*
靳 涛,武 倩,董 雨,崔晓东
(河北省沧州中西医结合医院 1.麻醉二科;2.第三手术室,沧州 061000)
急性心肌梗死是当今世界造成人类死亡和残疾的主要疾病之一,严重威胁人类生命健康。在急性心肌梗死患者的治疗中,溶栓、经皮冠状动脉介入治疗等再灌注是减少心肌细胞死亡的有效治疗方法,但是,再灌注治疗在挽救缺血心肌的同时也可引发不同程度的心肌缺血/再灌注损伤[1]。因此,寻找有效防治心肌缺血/再灌注损伤的药物是当前医学研究的热点。长托宁(penequinine hydrochloride,PHC)是我国自主研发的一种新型M胆碱受体阻断剂,具有选择性M1、M3受体拮抗作用。PHC可稳定细胞膜,拮抗平滑肌痉挛(收缩)而改善微循环。研究显示,PHC可通过抑制NF-KB和STAT3信号通路,减少一氧化氮的生成,减轻脂多糖对人脐静脉内皮细胞造成的损伤[2]。PHC可降低内毒素诱导的急性肺损伤大鼠肺组织炎症反应和氧化应激水平,保护大鼠肺损伤[3]。但目前,PHC对心肌缺血再灌注损伤的影响及机制还未知。微小RNA(microRNA,miRNA)是一类小分子非编码单链RNA,参与调控细胞增殖、凋亡、氧化应激等多种生理或病理过程,与人类多种疾病的发生发展密切相关[4-5]。研究显示,miR-217 在心肌缺血/再灌注损伤小鼠和缺氧/复氧(H/R)诱导的心肌细胞H9C2中表达上调,下调miR-217 表达可减轻心肌缺血再灌注小鼠损伤及H/R 诱导的H9C2 细胞损伤[6]。目前,PHC能否通过调控miR-217表达保护心肌细胞损伤还未知。因此,本研究通过建立体外H/R 大鼠心肌细胞H9C2损伤模型,探讨PHC对H/R诱导的H9C2细胞损伤的影响及miR-217 在此过程中的调控作用,为治疗心肌缺血/再灌注损伤药物的开发及靶点选择提供实验和理论依据。
1 材料与方法
1.1 细胞和实验试剂 大鼠心肌细胞H9C2购自于中国科学院上海生命科学研究所细胞资源中心。胎牛血清(FBS)购自美国Hycolne 公司;低糖DMEM 培养基、高糖DMEM 培养基、胰蛋白酶、LipofectamineTM2000 试剂盒、二喹啉甲酸(BCA)蛋白检测试剂盒购自北京索莱宝科技有限公司;逆转录试剂盒和PCR试剂盒购自日本TaKaRa公司;Trizol试剂购自美国Invitrogen 公司;PCR 引物、miR-217模拟物(mimics)、模拟对照序列(miR-NC)、miR-217抑制剂(anti-miR-217)和抑制剂阴性对照(anti-miRNC)序列购自上海吉玛制药技术有限公司;Annexin V-FITC/PI 细胞凋亡试剂盒购自江苏凯基生物技术股份有限公司;兔抗人B淋巴细胞瘤-2(Bcl-2)、B淋巴细胞瘤-2 相关蛋白(Bax)和GAPDH 多克隆抗体购自美国Santa Cruz 公司;丙二醛(MDA)、超氧化物歧化酶(SOD)和谷胱甘肽还原酶(GSH-Px)试剂盒购自南京建成生物工程研究所。
1.2 细胞培养 H9C2 细胞复苏后,加入含10%FBS 的高糖DMEM 培养基,置于37 ℃、5%CO2、湿度97 %的培养箱中培养。根据细胞生长状况,每2~3 d 更换1 次新鲜培养基。待细胞生长密度达80%左右时,吸弃培养基,加入适量预冷PBS清洗细胞。吸弃PBS,加入0.25%胰蛋白酶溶液消化,进行传代培养。
1.3 细胞H/R 模型建立[7]细胞培养12 h 后,换用不含FBS的低糖DMEM培养基培养,并置于37 ℃、5%CO2、95%N2的培养箱中缺氧培养2 h;然后换为含10% FBS 的高糖DMEM 培养基,置于37 ℃、5%CO2、湿度97%的培养箱中复氧培养4 h。
1.4 细胞转染 取对数生长期的H9C2 细胞,调整浓度为2.5×104个/mL,每孔2.5 mL 接种于6 孔板中。待细胞生长密度达60%时,更换无FBS的高糖DMEM 培养基。参照LipofectamineTM2000 试剂盒说明书,分别将miR-217 mimcs、miR-NC、anti-miR-217、anti-miR-NC 转染至H9C2 细胞。转染6 h 后,更换含10%FBS 的高糖DMEM 培养基。继续培养至48 h后,收集细胞用于后续实验。
1.5 细胞分组和处理 细胞调整浓度为2.5×104个/mL,每孔1 mL 接种于24 孔板中。未转染的H9C2细胞分为对照组(Con组)、H/R组、H/R+低剂量PHC组(H/R+PHC-L 组)、H/R+中剂量PHC 组(H/R+PHC-M 组)和H/R+高剂量PHC 组(H/R+PHC-H组)。Con 组细胞正常培养6 h;H/R 组细胞仅建立H/R 模型;H/R+PHC-L 组、H/R+PHC-M 组和H/R+PHC-H 组细胞缺氧培养2 h 后,分别换用含PHC 终浓度为12.5 μg/L、25.0 μg/L、50.0 μg/L[2]的10%FBS高糖DMEM培养基复氧4 h。转染anti-miR-NC、anti-miR-217 的细胞仅建立H/R 模型,并分别记为H/R+anti-miR-NC 组 和H/R+anti-miR-217 组。转 染miR-NC、miR-217的细胞缺氧培养2 h后,分别换用含PHC终浓度为50.0 μg/L的10%FBS高糖DMEM培养基复氧4 h,并分别记为H/R+PHC+miR-NC 组和H/R+PHC+miR-217组。每组设置3个复孔。
1.6 细胞MDA含量及SOD和GSH-Px活力检测
各组细胞培养结束后,吸弃培养基,0.25%胰蛋白酶消化,收集细胞。RIPA细胞裂解液裂解裂解细胞,3 500 r/min 离心10 min,取上清液,参照试剂盒说明书,分别检测细胞上清液中MDA 含量及SOD和GSH-Px活力。
1.7 流式细胞仪检测细胞凋亡 参照Annexin VFITC/PI试剂说明书,取1.0×106个细胞,加入500 μL结合缓冲液,移液器轻轻吹打,混悬细胞。加入10 μL Annexin V-FITC,室温避光孵育10 min。加入5 μL PI,室温避光孵育10 min,用流式细胞仪检测细胞凋亡率。
1.8 Western blotting 法检测细胞Bax 和Bcl-2 蛋 白表达 加入RIPA 裂解液裂解充分裂解细胞,离心,BCA蛋白试剂盒检测上清中蛋白浓度;取适量蛋白煮沸变性后,SDS-PAGE 分离蛋白,转移至PVDF膜,5%脱脂奶粉封闭2 h;分别加入一抗Bax(1∶1 000)、Bcl-2(1∶1 000)和GAPDH(1∶2 000)4 ℃冰箱孵育过夜,TBST 洗膜3 次,5 min/次;加入辣根过氧化酶标记的二抗(1∶5 000)37 ℃孵育1 h,TBST洗膜3 次,5 min/次;ELC 显色,凝胶成像系统曝光、拍照,Image J软件分析蛋白条带灰度值。以目的蛋白条带灰度值与内参GAPDH条带灰度值的比值作为目的蛋白表达量。
1.9 实时荧光定量PCR(qPCR)法检测细胞miR-217表达 Trizol试剂提取细胞总RNA,微量核酸仪检测RNA的纯度和浓度,逆转录为cDNA。然后以cDNA 为模板,进行PCR 扩增。PCR 反应条件:95 ℃预变性5 min,95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,共35个循环。引物序列:miR-217正向:5’-GCTGGGTGCGAAAGTCGTC-3’,反向:5’-CGAATGCTGAACGTGCCG-3’;U6 正向:5’-GCCTGAACAGCTCTTTCCG-3’,反向:5’-GTCGTAAACGCTTTCCCG-3’。以U6 为内参,采用2-△△Ct法计算miR-217相对表达量。
1.10 统计学方法 利用SPSS 22.0 统计软件分析实验数据,计量资料以均数±标准差()表示,多组间比较采用单因素方差分析,进一步两两比较采用SNK-q检验,以P<0.05为差异有统计学意义。
2 结果
2.1 PHC对H/R诱导的心肌细胞氧化应激的影响 与Con组比较,H/R组细胞中MDA含量显著升高(P<0.05),SOD 和GSH-Px 活性显著降低(P<0.05);与H/R 组比较,H/R+PHC-L 组、H/R+PHC-M组和H/R+PHC-H组细胞中MDA含量显著降低(均P<0.05),SOD 和GSH-Px 活力显著升高(均P<0.05),见表1。
表1 PHC对H/R诱导的H9C2细胞氧化应激的影响
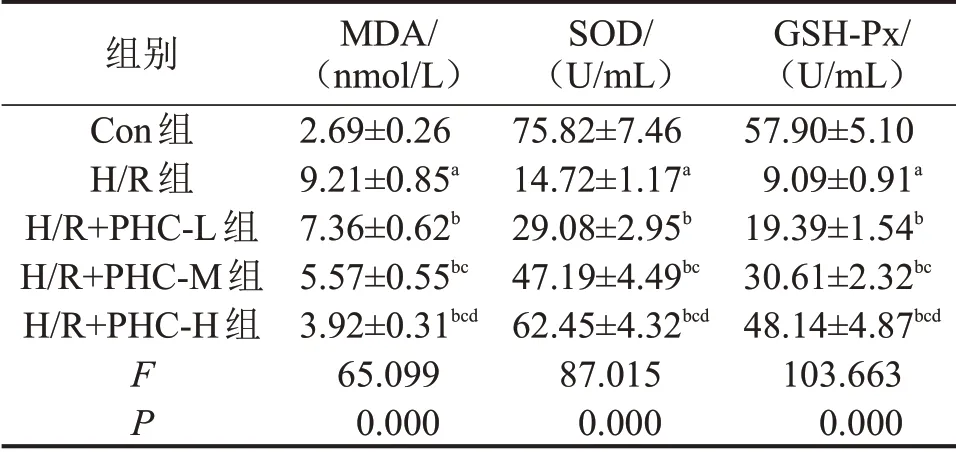
表1 PHC对H/R诱导的H9C2细胞氧化应激的影响
与Con 组比较,aP<0.05;与H/R 组比较,bP<0.05;与H/R+PHC-L 组比较,cP<0.05;与H/R+PHC-M 组比较,dP<0.05。
2.2 PHC 对H/R 诱导的心肌细胞凋亡的影响 与Con组比较,H/R组细胞凋亡率和Bax蛋白表达显著升高(P<0.05),Bcl-2 蛋白表达显著降低(P<0.05);与H/R 组比较,H/R+PHC-L 组、H/R+PHC-M组和H/R+PHC-H 组凋亡率和Bax 蛋白表达显著降低(P<0.05),Bcl-2 蛋白表达显著升高(P<0.05),见图1、表2。
表2 PHC对H/R诱导的H9C2细胞凋亡的影响

表2 PHC对H/R诱导的H9C2细胞凋亡的影响
与Con 组比较,aP<0.05;与H/R 组比较,bP<0.05;与H/R+PHC-L 组比较,cP<0.05;与H/R+PHC-M 组比较,dP<0.05。
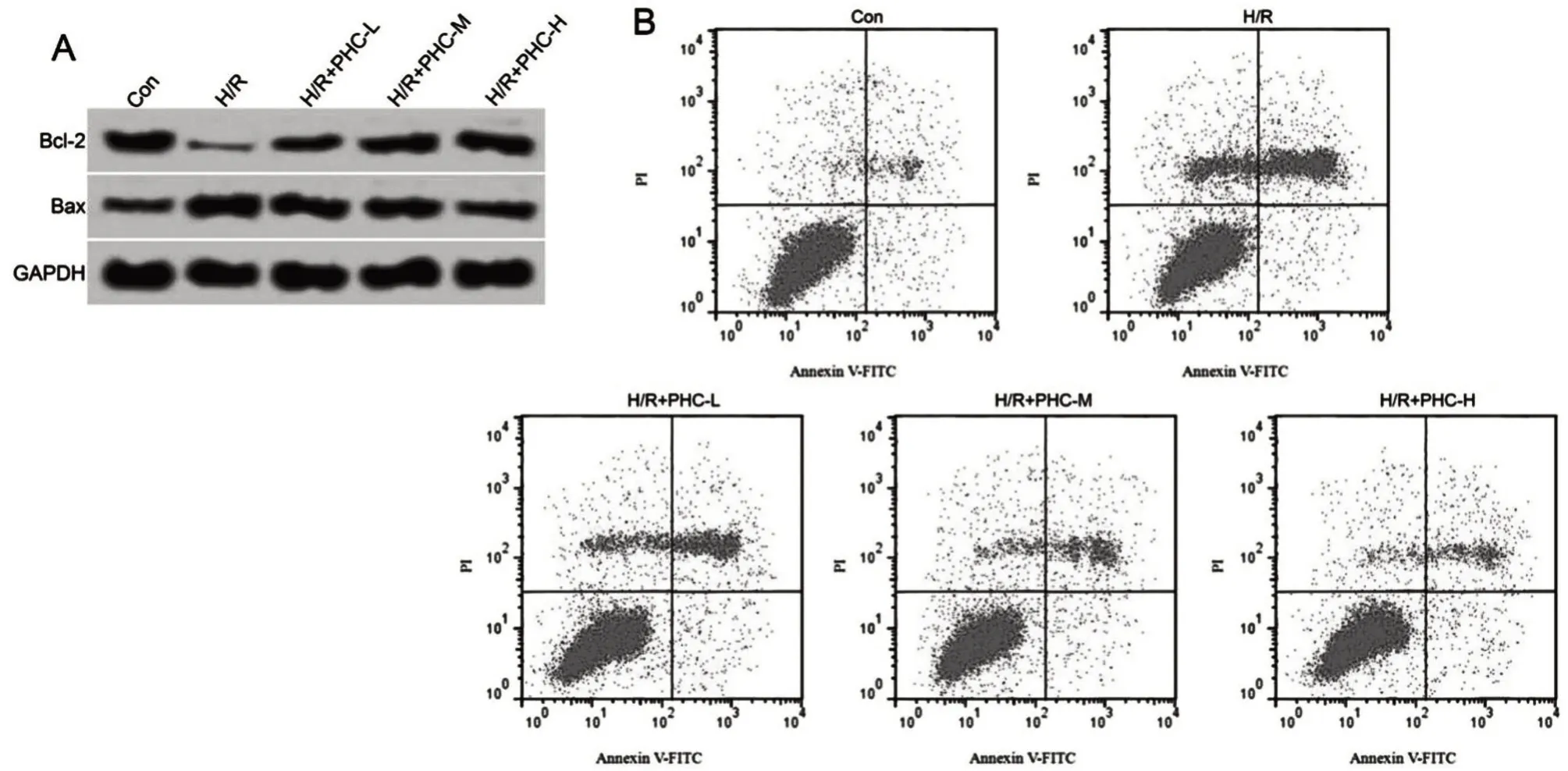
图1 PHC对H/R诱导的H9C2细胞凋亡的影响
2.3 PHC 对H/R 诱导的心肌细胞miR-217 表达的影响 与Con 组比较,H/R 组细胞中miR-217 表达显著升高(P<0.05);与H/R 组比较,H/R+PHC-L组、H/R+PHC-M 组和H/R+PHC-H 组细胞中miR-217表达显著降低(P<0.05),见表3。
表3 PHC对H/R诱导的H9C2细胞miR-217表达的影响

表3 PHC对H/R诱导的H9C2细胞miR-217表达的影响
与Con 组比较,aP<0.05;与H/R 组比较,bP<0.05;与H/R+PHC-L 组比较,cP<0.05;与H/R+PHC-M 组比较,dP<0.05。
2.4 下调miR-217 表达对H/R 诱导的心肌细胞损伤的影响 与H/R+anti-miR-NC组比较,H/R+antimiR-217 组细胞中miR-217 表达、MDA 含量显著降低(P<0.05),SOD 和GSH-Px 活力显著升高(P<0.05),细胞凋亡率和Bax 蛋白表达显著降低(P<0.05),Bcl-2 蛋白表达显著升高(P<0.05),见图2、表4。
表4 下调miR-217表达对H/R诱导的H9C2细胞损伤的影响
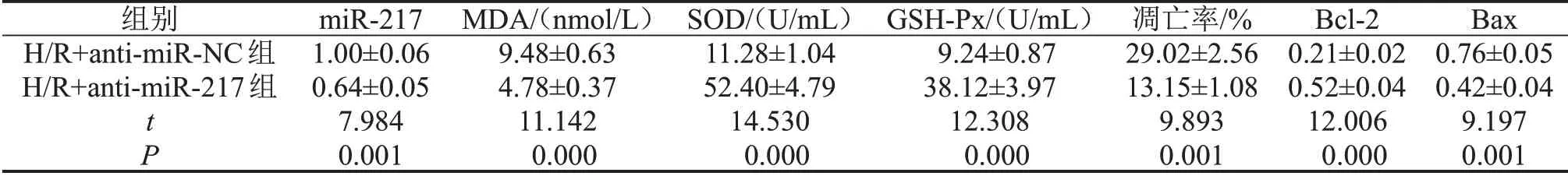
表4 下调miR-217表达对H/R诱导的H9C2细胞损伤的影响

图2 下调miR-217表达对H/R诱导的H9C2细胞凋亡的影响
2.5 miR-217 过表达逆转PHC 对H/R 诱导的心肌细胞损伤的作用 与H/R+PHC+miR-NC组比较,H/R+PHC+miR-217 组细胞中miR-217 表达、MDA 含量显著升高(P<0.05),SOD和GSH-Px活性显著降低(P<0.05),细胞凋亡率和Bax蛋白表达显著升高(P<0.05),Bcl-2 蛋白表达显著降低(P<0.05),见图3、表5。
表5 miR-217过表达逆转了PHC对H/R诱导的H9C2细胞损伤的作用
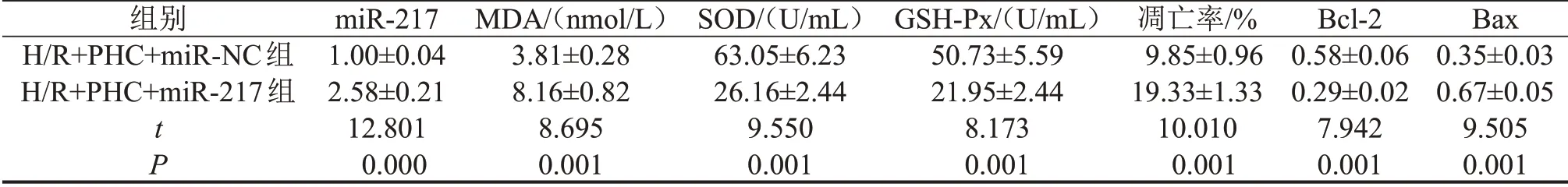
表5 miR-217过表达逆转了PHC对H/R诱导的H9C2细胞损伤的作用
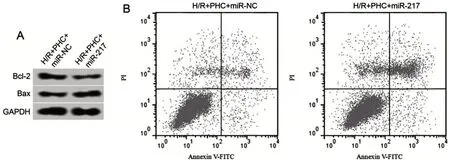
图3 miR-217过表达逆转了PHC对H/R诱导的H9C2细胞凋亡的作用
3 讨论
急性心肌梗死是常见的心血管疾病,具有较高的致死率和致残率[8]。尽早恢复血流并维持心肌氧和能量的平衡是急性心肌梗死的主要治疗途径,但再灌注也会引起不同程度的心肌损伤,即发生心肌缺血再灌注损伤。缺血再灌注过程中通过产生氧自由基、线粒体损伤、炎性细胞浸润等多种机制诱导心肌细胞凋亡,因此,抑制心肌细胞氧化应激,降低心肌细胞凋亡是减轻或治疗心肌损伤的策略和目标。目前,H/R 心肌细胞损伤模型已被广泛用于心肌缺血再灌注损伤的体外模型[9]。本研究结果显示,H9C2 细胞经H/R 处理后,细胞中MDA 含量显著升高,SOD和GSH-Px活性显著降低,且细胞凋亡加剧(均P<0.05),与相关报道结果一致[10],表明H/R处理诱导H9C2细胞氧化应激损伤,并促进细胞凋亡。
PHC是我国自主研制的新型抗胆碱药物,具有药效长、副作用小等特点。研究显示,PHC 预先处理有助于改善大鼠心肌缺血/再灌注损伤后肠系膜微循环[11];PHC用于治疗急性有机磷中毒患者时,可有效改善患者心肌损伤,提高急救效果,并且治疗安全,值得在临床中推广应用[12]。但目前,PHC对心肌细胞损伤的影响和机制还未知。
正常机体内氧化和抗氧化处于动态平衡,而在病理状态下,机体内的氧化和抗氧化平衡失衡,产生过量的氧自由基,损伤机体组织。研究显示,氧化应激在心肌缺血再灌注损伤中起重要作用。MDA 是脂质过氧化产物之一,可间接反映机体氧化应激水平[13]。SOD和GSH-Px时机体内重要的抗氧化酶,可清除自由自,减轻自由基对机体组织损伤[14]。本研究显示,PHC 作用H/R 诱导的心肌细胞后,细胞中MDA 含量显著降低,SOD 和GSH-Px 活性显著降升高(P<0.05),表明PHC可有效降低H/R诱导的心肌细胞氧化应激反应。
心肌细胞凋亡是引起心肌缺血/再灌注损伤的主要原因之一,抑制心肌细胞凋亡对心肌缺血再灌注损伤的治疗具有重要意义。细胞凋亡是一种复杂的程序性死亡过程,受多种基因的调控。促凋亡蛋白Bax 和抗凋亡蛋白Bcl-2 在细胞凋亡中发挥重要调控作用,Bax 表达升高促进细胞凋亡,而Bcl-2表达升高则抑制细胞凋亡[15]。本研究显示,PHC 作用H/R 诱导的心肌细胞后,细胞凋亡率和Bax 蛋白表达显著降低,Bcl-2 蛋白表达显著升高(均P<0.05),表明PHC可抑制H/R诱导的心肌细胞凋亡。
miRNA在真核生物中广泛存在,参与调控细胞凋亡和氧化应激过程,与心肌缺血再灌注损伤的发生发展密切相关。研究显示,下调miR-217 表达通过可降低1—甲基—4—苯基—吡啶离子(MPP+)诱导的人神经母细胞瘤SH-SY5Y细胞炎症反应、氧化应激和凋亡[16]。高糖可促进内皮细胞中miR-217的表达,上调miR-217 表达可促进高糖诱导的内皮细胞凋亡[17]。本研究发现,下调miR-217 表达可抑制H/R 诱导的心肌细胞氧化应激和凋亡,减轻心肌细胞损伤(P<0.05),提示miR-217可能是心肌损伤的治疗靶点。此外,PHC可抑制H/R诱导的心肌细胞miR-217 的表达,而过表达miR-217 逆转了PHC 对H/R 诱导的心肌细胞氧化应激和凋亡的抑制作用,提示PHC可能通过下调miR-217表达来抑制H/R诱导的心肌细胞氧化应激和凋亡。
综上所述,PHC 可有效抑制H/R 诱导的心肌细胞氧化应激和凋亡,减轻心肌细胞损伤,其作用机制与下调miR-217 表达有关,具有开发为治疗心肌缺血/再灌注损伤药物的潜在价值。
- 广西医科大学学报的其它文章
- Musashi2 gene expression in lung squamous cell carcinoma and its effect on the maintenance of CD44v6(+)lung cancer stem cells mediated by Notch1 signaling pathway
- 结直肠癌发生过程中普拉梭菌丰度变化的研究*
- 持续隐匿性乙肝病毒感染树鼩肠道菌群变化研究*
- TREM1/TREM2在小鼠呼吸机相关性肺损伤中的表达*
- 色素上皮衍生因子联合5-氟尿嘧啶抑制结肠癌细胞凋亡和血管生成的作用研究*
- 葡醛内酯对异烟肼和利福平所致肝损伤小鼠肝组织自噬水平的影响*

