持续隐匿性乙肝病毒感染树鼩肠道菌群变化研究*
陈秀娟,李科志,唐艳萍,涂 鑫,骆成飘,欧 超,曹 骥,杨 春△
(广西医科大学附属肿瘤医院 1.实验研究部;2.病理科;3.检验科,南宁 530021)
乙型肝炎病毒(HBV)感染是威胁人类健康的全球性问题,若不及时、规范治疗,可能会产生乙型病毒性肝炎、肝硬化、肝癌等并发症,严重时危及生命。隐匿性HBV 感染(OBI)是指血清乙肝表面抗原阴性、肝组织存在具有复制能力的HBV DNA,伴或不伴有血清HBV DNA阳性[1]。根据HBV血清学标志物特点,OBI 可分为血清抗体阳性型(HBcAb阳性伴或不伴HBsAb 阳性)和血清抗体阴性型(HBcAb、HBsAb 均阴性)。自1978 年Hoofnagle等[2]首次报道了输注HBsAg(-)/抗-HBc(+)血液引起受血者HBV持续感染,OBI越来越受到人们的关注。
树鼩(tree shrew)是一种小型实验动物,已广泛应用于多种病毒感染性疾病研究,如HBV、流感病毒、腺病毒、单纯疱疹病毒、肠道病毒71 型、轮状病毒等[3]。本课题组前期建立了实验室人工繁育树鼩的基本方法,用培育的树鼩幼崽接种HBV,逐步证实HBV 能在树鼩体内复制,建立一过性感染、急性感染、隐匿性感染、慢性感染等不同HBV 感染状态模型[4-5]。肠道菌群是指在肠道定居并生长的微生物群落,其在维持宿主的新陈代谢、免疫功能等方面发挥重要作用。有研究表明,肠道菌群失调与宿主多种疾病有关,如2 型糖尿病[6]、溃疡性结肠炎[7]、克罗恩病[8]、鼻咽癌[9]、高血压[10]、慢性肾脏病[11]、哮喘[12]等。肠道菌群可以影响HBV 感染状态。Chou等[13]研究发现,运用抗生素清洁肠道可以显著延长小鼠HBsAg 清除时间、降低HBV DNA 清除率,从而使HBV 转为持续感染状态。Zhu 等[14]亦发现,一过性和急性HBV感染小鼠肠道菌群随HBV感染状态变化而改变,这可能与肠道菌群参与宿主介导HBV 特异性免疫应答有关。关于肠道菌群对持续OBI的影响报道尚不多见。本研究基于课题组前期建立的树鼩持续OBI动物模型,通过比较树鼩肠道菌群改变,拟从肠道菌群角度探讨OBI机制。
1 材料与方法
1.1 持续OBI 树鼩模型的建立 经患者知情同意和医学伦理委员会批准后,采慢性乙型肝炎患者血清作为感染源,分装后置于-80 ℃冰箱中保存。此感染源HBV血清学标志物HBsAg(+)、HBeAg(+)、HBcAb(+),HBV-DNA为7.53×108IU/mL,HBV为C基因型。
新生树鼩分别于出生的第1、第3天经双股内侧皮下接种300 μL HBV 病毒液,对照组不作任何处理。分别于树鼩出生后第8、第10、第12、第16、第20、第24、第48、第72 周,经股静脉采血1.5 mL,常规分离后保存于-80 ℃冰箱中。所有动物均饲养于(20±2)℃、湿度40%~60%清洁环境。所有操作均符合广西医科大学动物伦理委员会标准,动物使用许可证号:SYXK-桂2020-0004。
1.2 树鼩血清HBV标志物、HBV DNA拷贝数动态检测 采用酶联免疫吸附试验(ELISA)法检测树鼩血清HBsAg、HBsAb、HBcAb,实时荧光定量PCR(qPCR)TaqMan 探针法检测树鼩血清HBV DNA。HBsAg、HBsAb、HBcAb 检测试剂盒均购自上海科华生物工程股份有限公司,HBV DNA 检测试剂盒购自中山达安生物技术有限公司。PCR 仪(Light-Cycler480 型Ⅱ)购自瑞士Roche公司。
1.3 树鼩粪便收集和16S rDNA V3+V4区高通量测序 所有树鼩一般状态良好,排除稀便、黑便、尿液或毛发污染等不合格粪便样本,收集合格标本,取少许常温保存行大便潜血实验进一步质控,剩余部分液氮速冻后迅速转移至-80 ℃冰箱中保存。采用胶体金法对18例粪便行大便潜血实验,结果均为阴性,无消化系统疾病,标本合格,可用于后续实验。提取粪便总DNA,采用带Barcode 接头特异性引物对16S rDNA V3+V4区进行PCR扩增,产物纯化、扩增子接头、构建DNA文库,Illumina平台PE250上机双端测序。肠道菌群特异性引物序列:341F:5’-CCTACGGGNGGCWGCAG-3’;806R:5’-GGACTACHVGGGTATCTAAT-3’。
1.4 数据处理和生物信息学分析 采用FASTP(版本0.18.0)软件过滤Illumina 低质量测序数据,FLASH(版本1.2.11)软件读取、拼接原始数据,USEARCH(版本7.1)软件UCHIME 算法去除嵌合体、UPARSE 算法以OTU 相似性>97%进行聚类(operational taxonomic units,OTU)。OTU 注释在SILVA SSU rRNA 数据库(http://www.arb-silva.de)中进行。通过QIIME(版本v.1.30.1)软件中Mothur 算法计算基于OTUs水平α多样性、β多样性等相关指标。
1.5 统计学方法 对于肠道菌群分析,采用主坐标分析(PCoA)、非度量多维标度分析(MNDS)计算样本间距离,使用非参数Wilcoxon 秩和检验分析α 多样性、β 多样性,Anosim 检验比较分组信息。同时,采用非参数Kruskal-Wallis秩和检验、Wilcoxon秩和检验、线性判别分析(LDA>2)标准进行LEfSe在线分析(http://huttenhower.sph.harvard.edu/galaxy)。以P<0.05为差异具有统计学意义。
2 结果
2.1 树鼩血清HBsAg、HBsAb、HBcAb 和HBV DNA载量检测结果 在8~72周的观察期内,根据血清HBsAg、HBsAb、HBcAb 和HBV DNA 动态结果共有21 只树鼩符合持续性OBI 标准[1]。考虑年龄、性别因素,筛选10 只树鼩作为OBI 组(n=10),8只未经干预树鼩作为正常对照(NC组,n=8)。两组树鼩雌雄各半、年龄相近。
OBI组树鼩血清HBsAg均为阴性,HBcAb多呈阳性(9/10),呈血清抗体阳性型;HBsAb(-)伴HBcAb(-)仅1 只,呈血清抗体阴性型。OBI 组树鼩HBV DNA 载量呈间歇性低水平波动状态,大多低于200 IU/mL,少数HBV DNA>200 IU/mL。在观察期内,有4 只树鼩(分别为y59-4、271-1、y61-1 和y61-3 号树鼩)血清HBV DNA 自发升高10 倍以上,伴HBsAg(-)/HBsAg(+)血清学转换,其中y59-4 号树鼩血清HBV DNA 较长时间保持在相对高水平(与基线水平相比,14~24 周),另外3 只树鼩随血清HBsAb 出现,HBsAg 很快恢复阴性,血清HBV DNA 也降至基线水平,见图1。观察期内,NC 组树鼩血清均未检测出HBsAg、HBsAb、HBcAb和HBVDNA。
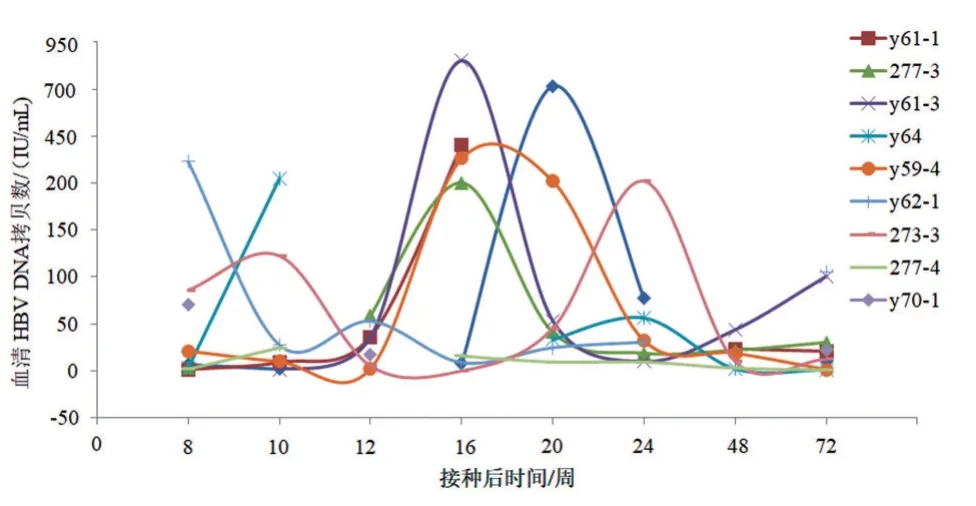
图1 持续OBI树鼩血清HBV DNA拷贝数动态变化
2.2 持续OBI对树鼩肠道菌群OTUs影响 双端测序后OBI 组共得到1 073 881 对原始序列,NC 组共得到871 666 对原始序列,经质量控制后,OBI 组和NC 组分别得到789 098、622 737 对有效测序序列,有效率为73.48%和71.44%。将有效序列进行OTU聚类,OBI 组和NC 组平均每个样本分别得到1 320和1 299 OTU,两组比较,差异无统计学意义(P>0.05)。基于OTU的生物多样性稀释曲线显示可检出的OUT数随测序深度增加已达平台期,表明此次测序深度足以覆盖大多数物种。相对丰度曲线表明,OBI 组物种丰富度高于NC 组,OBI 组样本间物种均匀度优于NC组,见图2。
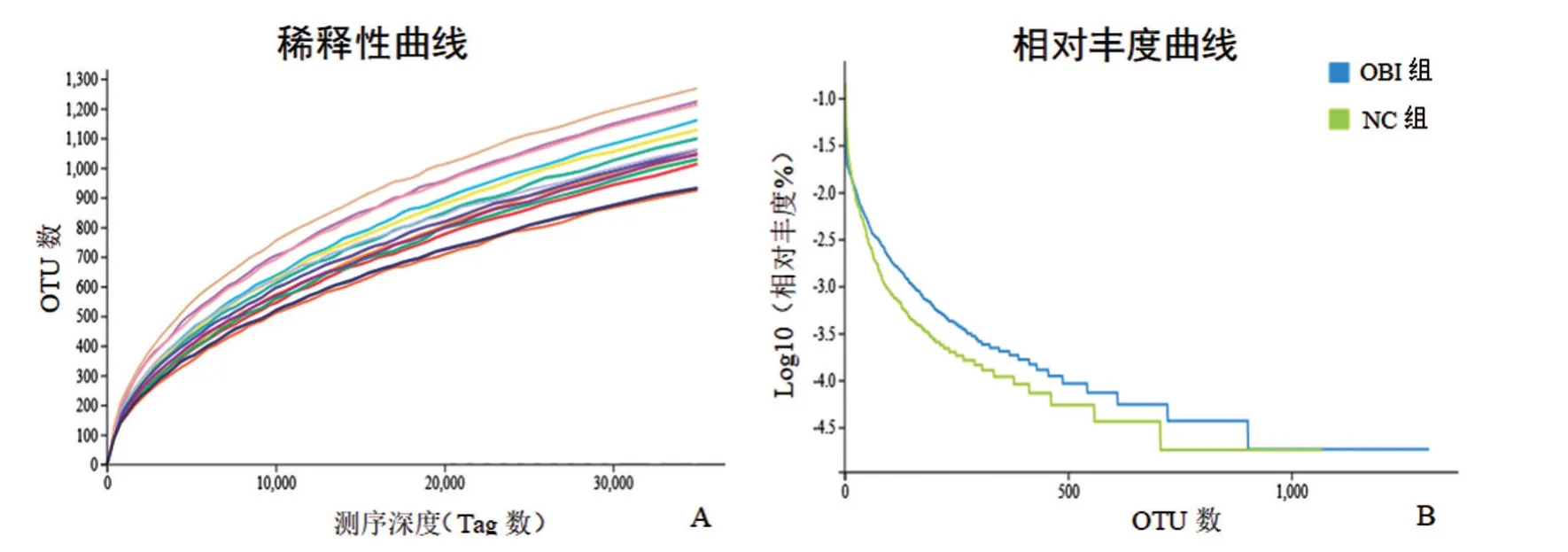
图2 持续OBI对树鼩肠道菌群OTUs影响
2.3 持续OBI 对树鼩肠道菌群α 多样性影响 采用Chao1 指数、Ace 指数、Sobs 指数、Shannon 指数、Simpson 指数、PD 指数等指标反映肠道菌群α 多样性。两组树鼩肠道菌群Chao1指数、Sobs指数、Ace指数、Shannon 指数和Simpson 指数比较,差异均无统计学意义(均P>0.05);在系统进化角度,两组树鼩肠道菌群PD 指数比较,差异亦无统计学意义(P>0.05),表明持续OBI对树鼩肠道菌群α多样性无显著影响。
2.4 持续OBI 对树鼩肠道菌群β 多样性影响 采用PCoA、MNDS 等方法来分析不同样本组内和组间的菌群差异,探讨持续OBI 对树鼩肠道菌群β 多样性影响。PCoA结果显示,PCo1和PCo2两种主坐标贡献率分别为11.73%、10.54%,OBI组和NC组树鼩粪便菌群在进化距离上区分明显(图3A);NMDS结果显示stress 值为0.085,表明模型相似性高(图3B)。在OUT 水平,分别采用Wilcoxon 检验和Anosim检验计算OBI组和NC组树鼩肠道内菌群在组内和组间进化距离,分析组间距离与组内距离差异性。结果显示,OBI 组和NC 组树鼩肠道菌群组内距离无明显差异(P>0.05),组间距离差异明显(P<0.01),表明OBI 组和NC 组树鼩肠道菌群的组间差异大于组内差异,持续OBI可以降低树鼩肠道菌群β多样性,见图3C、图3D。
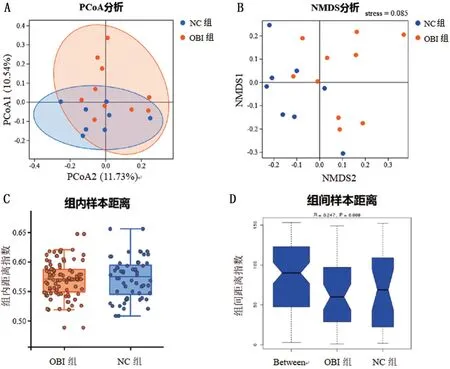
图3 持续OBI对树鼩肠道菌群β多样性影响
2.5 持续OBI 对树鼩肠道粪便样本物种组成差异性影响 为了进一步探讨持续OBI 对树鼩肠道菌群物种组成的影响,本研究从门、纲、目、属等分类学水平分别对树鼩肠道内前10 优势物种进行差异性分析。结果发现,在门水平,树鼩肠道菌群主要由厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、Epsilonbacteraeota、蓝藻门(Cyanobacteria)等组成,其相对丰度在OBI组和NC组树鼩肠道菌群占比分别为99.72%、99.84%。其中,OBI 组树鼩肠道内厚壁菌门的相对丰度(%)显著高于NC组(P<0.05),拟杆菌门在OBI 组和NC 组相对丰度(%)无显著差异(P>0.05)。与NC 组相比,OBI 组树鼩厚壁菌门/拟杆菌门比值(F/B)无明显差异(P>0.05)。在纲水平,持续OBI主要影响树鼩肠道梭状芽孢杆菌(Clostridia),其在OBI 组树鼩肠道相对丰度显著高于NC 组(P<0.01);在目水平,持续OBI 主要影响树鼩肠道梭状芽孢杆菌(Clostridiales),OBI 组树鼩肠道梭状芽孢杆菌目相对丰度显著高于NC组(P<0.01);在属水平,OBI组树鼩肠道大肠埃希―志贺菌(Escherichia-Shigella)、嗜冷杆菌(Psychrobacter)均显著低于NC 组(均P<0.05),见图4。
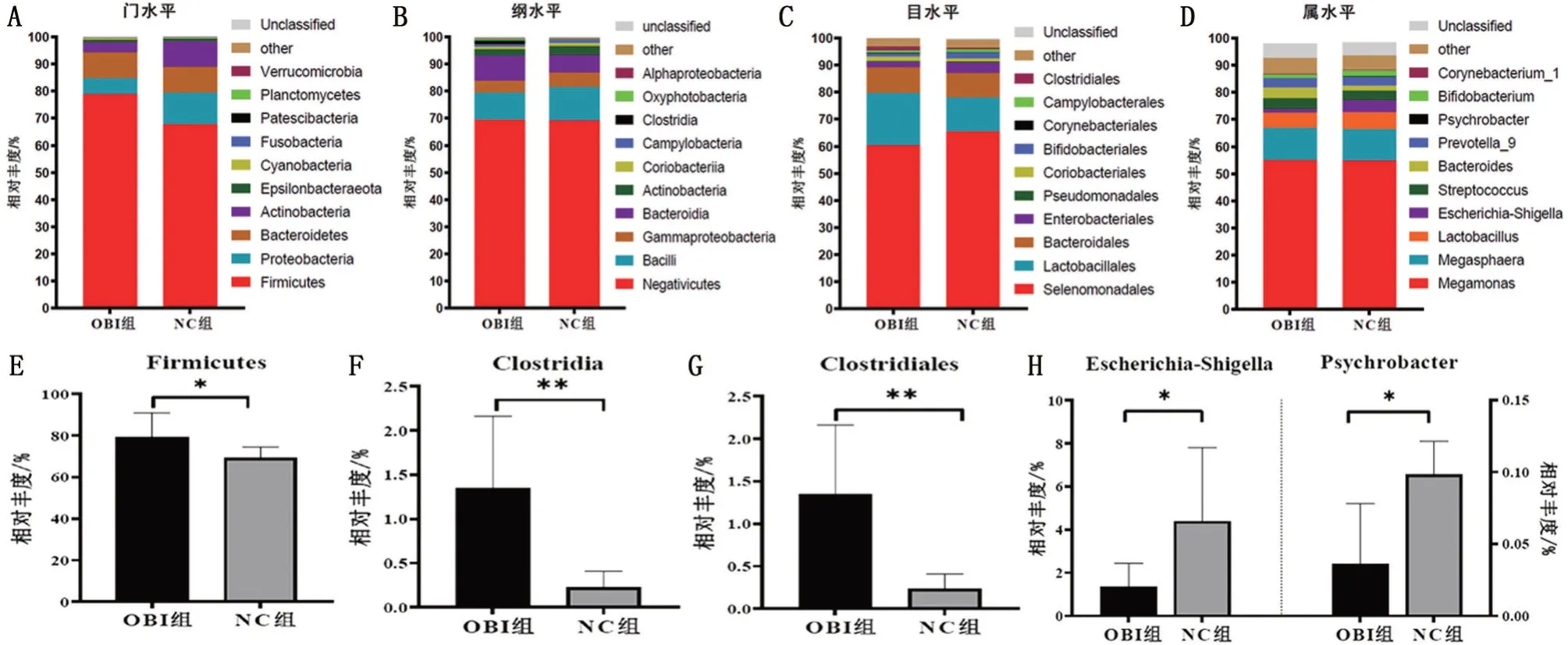
图4 不同分类学水平树鼩肠道内前10优势物种组成差异性分析
2.6 LEfSe法分析持续OBI对树鼩肠道菌群影响 OBI 组和NC 组差异性菌群主要由厚壁菌门、拟杆菌门和变形菌门组成。OBI组树鼩肠道厚壁菌门主要包括梭菌纲(Clostridia,LDA=3.75,P=0.001)、梭菌目(Clostridiales,LDA=3.72,P=0.0059)、瘤胃球菌科(Ruminococcaceae,LDA=3.42,P=0.016)、毛螺菌属(Lachnoclostridium,LDA=2.74,P=0.0076);NC组则主要由气球菌科(Aerococcaceae,LDA=2.47,P=0.033)、气球菌属(Aerococcus,LDA=2.86,P=0.0019)、气球菌种(Aerococcus_urinaeequi,LDA=2.25,P=0.015)、Lactobacillus_ruminis(LDA=3.01,P=0.0032)组成。在拟杆菌门方面,OBI 组树鼩肠道菌群主要包括脆弱拟杆菌(Bacteroides_fragilis,LDA=3.07,P=0.037)、普氏菌属7(Prevotella_7,LDA=3.27,P=0.00042)、Muribaculaceae(LDA=2.58,P=0.041);NC 组树鼩肠道则由Myroides(LDA=2.82,P=0.00058)、Myroides_odoratimimus(LDA=3.02,P=0.00035)、Bacteroides_coprophilus_DSM_18228_JCM_13818(LDA=3.37,P=0.016)等组成。在变形菌门方面,OBI组树鼩肠道菌群主要由Succinivibrionaceae(LDA=2.42,P=0.034)、Snodgrassella(LDA=2.13,P=0.024)、Snodgrassella_alvi(LDA=2.13,P=0.024)、克雷伯菌属(Klebsiella,LDA=3.00,P=0.033)组成;NC 组树鼩肠道菌群则由Vibrionales(LDA=2.50,P=0.0049)、Vibrionaceae(LDA=2.50,P=0.0050)、Moraxellaceae(LDA=2.59,P=0.0077)、嗜冷杆菌属(Psychrobacter,LDA=2.51,P=0.012)、大肠埃希―志贺菌属(Escherichia-Shigella,LDA=4.21,P=0.021)组成,见图5。这些差异菌群均可能成为持续OBI潜在的生物标志物。
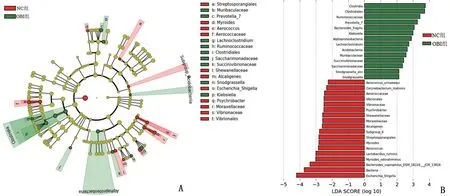
图5 树鼩肠道内前50种主要物种LEfSE分析
3 讨论
OBI由于其特殊性,感染者不易被发现,多进展为肝硬化、肝癌等终末期。目前普遍认为,OBI是隐源性肝癌的主要病因,整体临床预后比HBV/HCV相关性肝癌更差[15]。在慢性丙型肝炎、酒精性肝硬化、非酒精性脂肪肝病等疾病中,OBI是其独立危险因素,可以显著增加肝癌的发病率[16-17]。OBI还与肝移植、输血安全、血液透析等密切相关[16]。Candotti等[18]追踪了3 例血清HBsAg 阴性、HBV<20 IU/mL多次献血OBI感染者,在31位受血者中,9位受血者确诊感染HBV,这严重影响输血安全。因此,探讨OBI机制,清除HBV DNA显得尤为重要。
本研究中,通过给新生树鼩皮下注射106~107IU/mL HBV DNA 病毒液,使树鼩血清HBsAg(-)/HBV DNA(+),成功构建了树鼩持续OBI 动物模型。在持续OBI树鼩中,HBV血清标志物的表达模式呈多样性,以HBcAb(+)最为多见;血清HBV DNA 呈间歇性低水平波动状态,大多低于200 IU/mL,这与樊璐[19]、周怡等[20]、Wu 等[21]等报道结果一致,符合OBI 的表现形式。此外,在OBI 树鼩中,乙肝表面标志物表达形式和血清HBV DNA水平并非一成不变。在OBI 组树鼩中,有4 只(分别为y59-4号、271-1 号、y61-1 号和y61-3 号)树鼩血清HBV DNA 自发性升高10 倍以上,伴HBsAg(-)/HBsAg(+)血清学转换,表现为HBV再激活,这为临床OBI患者敲响警钟,尤其是即将或正在接受免疫抑制治疗患者[22]。值得注意的是,即使特异性HBV 表面标志物均未检出,但血清仍可持续检出低滴度HBV DNA(277-4 号树鼩),这为减少HBV 感染漏诊、传播和预防OBI再激活等提出了新的挑战。
由于肝脏70%血液是由门静脉供应,肠源性毒素、肠道菌群移位、微生物代谢产物等会不断进入肝脏,进而调节肝脏特异性免疫应答,影响HBV 感染状态,HBV感染亦可影响肠道微生物群落的多样性和组成。Zhu等[14]观察5~7周龄一过性HBV感染和持续HBV 感染小鼠肠道菌群动态变化,发现HBV感染可以延缓小鼠肠道菌群发育,影响其多样性。Yun等[23]研究发现,在HBsAg阳性的HBV携带者中,ALT 升高的患者肠道菌群多样性显著低于ALT正常的携带者,表明肠道菌群多样性可能与肝功能损害程度有关。本研究中,持续OBI可以显著降低树鼩肠道菌群β 多样性,这可能是由于树鼩出生即接种HBV 致使肠道内某些细菌无法生长和定植,这还需要进一步研究。厚壁菌门大多为革兰氏阳性菌,可以吸收、消耗大量能量,其被认为与肥胖、脂代谢、胰岛素抵抗有关[24-25]。本研究中,OBI组树鼩肠道内厚壁菌门相对丰度显著高于NC组(P<0.05),表明HBV介导特异性免疫应答需要增加能量消耗,肠道菌群可能通过增加能量消耗促进HBV特异性免疫应答[26]。梭状芽孢杆菌(Clostridia)是胃肠道中最常见的革兰阳性菌之一。Atarashi 等[27]研究发现,梭状芽孢杆菌能促进小鼠表达TGF-β、IL-10,抑 制TNF-α、IL-17 表达,从而促 进CD4+、FOXP3+Treg 细胞增殖和分化,促进Treg 细胞的归巢,其机制可能与梭状芽胞杆菌XIVa、IV、XVIII 决定簇和产生丁酸盐、异丁酸盐等短链脂肪酸有关。短链脂肪酸(SCFAs)在维持健康方面具有多种功能,如增强上皮屏障功能,降低炎症水平,促进外周血Treg细胞的生成等[28]。丁酸盐是短链脂肪酸的一种,是肠道黏膜细胞的主要能量来源,可以激活抗炎因子TGF-β、IL-10,抑制组蛋白脱乙酰基酶的活性,下调NF-κβ 介导的炎症反应[29],在本研究中,持续OBI 树鼩肠道中产生丁酸盐的梭状芽胞杆菌(Clostridia)相对丰度显著高于NC 组,表明其可能通过上述途径参与HBV介导的免疫应答。此外,胆汁酸是微生物的重要调节因子,胆汁酸的异常会导致微生态失调。在本研究中,OBI 组树鼩肠道内产生次级胆汁酸的梭状芽孢杆菌(Clostridiales)显著高于NC 组(P<0.05),表明持续OBI 可以通过改变肠道菌群组成影响胆汁酸的代谢。
本研究基于前期实验室成功构建的树鼩持续OBI 动物模型,比较了持续OBI 树鼩和正常树鼩肠道内微生物差异,这为进一步研究OBI潜在的免疫学机制、减少HBV传播、预防HBV再激活等提供了新思路。
- 广西医科大学学报的其它文章
- Musashi2 gene expression in lung squamous cell carcinoma and its effect on the maintenance of CD44v6(+)lung cancer stem cells mediated by Notch1 signaling pathway
- 结直肠癌发生过程中普拉梭菌丰度变化的研究*
- TREM1/TREM2在小鼠呼吸机相关性肺损伤中的表达*
- 色素上皮衍生因子联合5-氟尿嘧啶抑制结肠癌细胞凋亡和血管生成的作用研究*
- 葡醛内酯对异烟肼和利福平所致肝损伤小鼠肝组织自噬水平的影响*
- 基于网络药理学和分子对接探讨鸡血藤治疗冠脉微循环疾病机制*

