TREM1/TREM2在小鼠呼吸机相关性肺损伤中的表达*
麻日亮,王晓夏,凌茂瑶,廖晓婷,李俊达,潘灵辉
(广西医科大学附属肿瘤医院麻醉科,南宁 530021)
机械通气(mechanical ventilation,MV)是高级生命支持的重要组成部分,其目的是使呼吸机得到休息,同时为机体提供足够的气体交换[1]。然而,呼吸机应用不当可以加重原有的肺损伤,导致呼吸机相关性肺损伤(ventilator induce lung injury,VILI)[2]。MV 可以触发炎性介质的释放,促进炎症反应的级联放大而加重肺损伤[3]。髓样细胞触发受体(TREM)1/TREM2 作为TREMs 免疫球蛋白超家族的成员,广泛分布于巨噬细胞、树突状细胞和小胶质细胞中[4],处在动态平衡过程中[5],在创伤及炎症反应中起重要作用[6-7]。研究表明,TREM1的激活能够促进促炎因子的分泌,加重组织损伤[8]。反之,TREM2 上调则能够增强巨噬细胞的吞噬作用及全身炎症抵抗作用[9]。然而,TREM1/TREM2 平衡在VILI中的作用机制尚未明确。因此,本研究通过建立VILI 小鼠模型,探讨TREM1/TREM2 平衡在VILI中的表达情况。
1 材料与方法
1.1 实验动物 30 只SPF 级健康雄性C57BL/6 小鼠,8周龄,体重(25±2)g,购于广西医科大学实验动物中心,动物合格证号为SCXK桂2020-0003。实验过程中对动物处置符合动物伦理学标准。
1.2 实验分组 将30只小鼠随机分为自主呼吸组(CON组,n=6)、正常潮气量组(NVT组,VT=10 mL/kg,n=6)、大潮气量组(HVT 组,VT=40 mL/kg,n=18),HVT 组再按照通气时间不同分为3 个亚组:HVT 1组(通气时间1 h)、HVT 2组(通气时间2 h)、HVT 3组(通气时间4 h),每组6只。
1.3 VILI 模型建立 参照文献[10-11]方法制备VILI模型。小鼠经腹腔注射1%戊巴比妥钠30 mg/kg 麻醉后连接EZ-SAR-1000 小动物呼吸机(美国)进行MV。呼吸机参数设置:按实验分组设定呼吸机潮气量,吸入氧浓度(FiO2)为21%,吸呼比(I∶E)为 1∶1,通气频率80 次/min,呼气末正压(PEEP)为0 cmH2O。间断腹腔注射1%戊巴比妥钠20 mg/kg维持麻醉。
1.4 肺组织湿/干(W/D)重比值检测 取右肺上叶组织,称湿重(W),放置于65 ℃烘干箱48 h 后称取干重(D),计算W/D比值。
1.5 肺组织病理学观察 取右肺下叶置于4%多聚甲醛过夜,梯度乙醇脱水,石蜡包埋,石蜡切片(5 μm),行苏木精—伊红(HE)染色。光学显微镜下观察肺组织病理学变化,拍照。根据肺泡腔或肺泡间质炎性细胞浸润和肺泡壁厚度进行病理学评分[12],评分越高,损伤越严重。
1.6 肺泡灌洗液(BALF)中炎性因子含量检测 按照酶联免疫吸附试验(ELISA)试剂盒(武汉爱博泰克生物科技有限公司)说明书步骤操作,测定BALF中白细胞介素(IL)-1β、IL-6的水平。
1.7 实时荧光定量PCR(qPCR)法检测肺组织TREM1、TREM2 mRNA 表达 采用TRIzol 提取肺组织总RNA,逆转录为cDNA,按照PCR试剂盒(宝日医生物技术有限公司,RR047A)操作步骤在PCR仪(Thermo Fisher Scientific,Otower)上进行PCR 扩增,PCR 反应条件:95 ℃预变性30 s;95 ℃变性5 s,61 ℃退火、延伸30 s,共40 个循环。采用2-ΔΔCt法计算目的基因相对表达量。引物均由上海生工生物工程合成,序列如下:TREM1 上游:5’-ATGTGTTCACTCCTGTCATCAT-3’,下游:5’-GAGAAGTCCACAGATGACTGAA-3’;TREM2 上游:5’-CTGGAACCGTCACCATCACTC-3’,下游:5’-CGAAACTCGATGACTCCTCGG-3’;β-actin 上游:5’-GGCTGTATTCCCCTCCATCG-3’,下游:5’-CCAGTTGGTAACAATGCCATGT-3’。
1.8 Western blotting 法检测TREM1、TREM2 蛋白表达 取20 mg肺组织,加入RIPA裂解液和蛋白酶抑制剂PMSF,冰上裂解,离心,取上清液,BCA法测定蛋白浓度,蛋白定量后加入蛋白上样缓冲液,煮沸10 min 使蛋白变性。取60 μg 蛋白进行SDSPAGE,200 mA 转膜60 min,TBST 洗涤,5%脱脂牛奶封闭90 min,加入兔抗小鼠TREM1、TREM2和βactin 抗体(北京博奥森生物科技有限公司,稀释比均为1∶500),4 ℃冰箱孵育过夜,TBST洗涤;加入辣根过氧化物酶(HRP)标记的山羊抗兔二抗(武汉爱博泰克生物科技有限公司,AS014,稀释比1∶10 000),室温下孵育1 h,TBST 洗涤3 次。采用电化学发光(ECL)法显影,Image Lab 测量条带灰度值,以目的蛋白与内参β-actin 蛋白条带灰度值的比值为目的蛋白相对表达量。
1.9 统计学方法 采用SPSS 25.0统计软件进行数据分析,计量资料以均数±标准差()表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,相关性分析采用Pearson 相关检验,以P<0.05为差异有统计学意义。
2 结果
2.1 5 组肺组织W/D 比值及病理学评分比较 与CON组相比,HVT 2组和HVT 3组肺组织W/D比值和病理学评分均明显升高(均P<0.05);HVT 2组与HVT 3 组比较,差异无统计学意义(P>0.05),CON组、NVT 组和HVT 1 组比较,差异亦无统计学意义(P>0.05),见表1。
表1 5组小鼠肺组织W/D比值和病理学评分比较
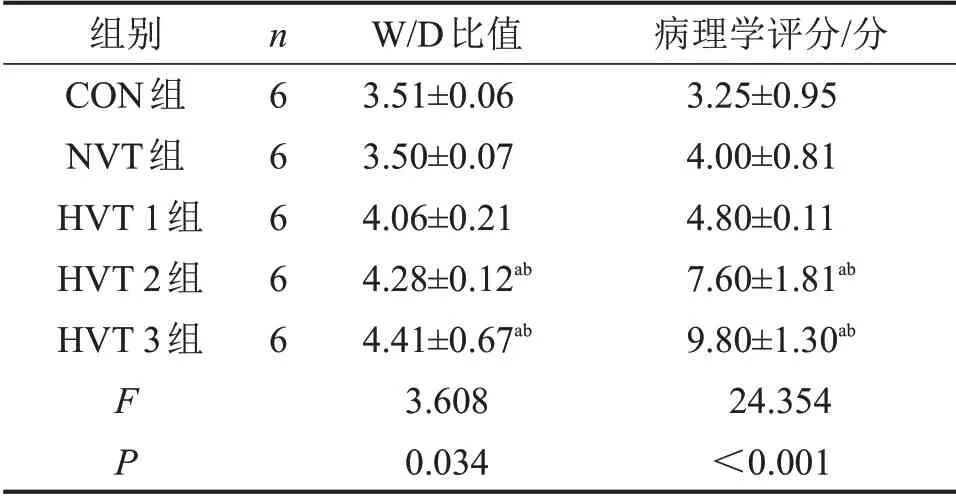
表1 5组小鼠肺组织W/D比值和病理学评分比较
与CON组比较,aP<0.005;与NVT组比较,bP<0.05。
显微镜下可见CON组与NVT组肺泡结构大致正常。随着通气时间延长,HVT 组可见肺泡壁断裂,肺泡融合,肺间质增厚及大量炎性细胞浸润,甚至肺泡腔内有红细胞渗出,见图1。
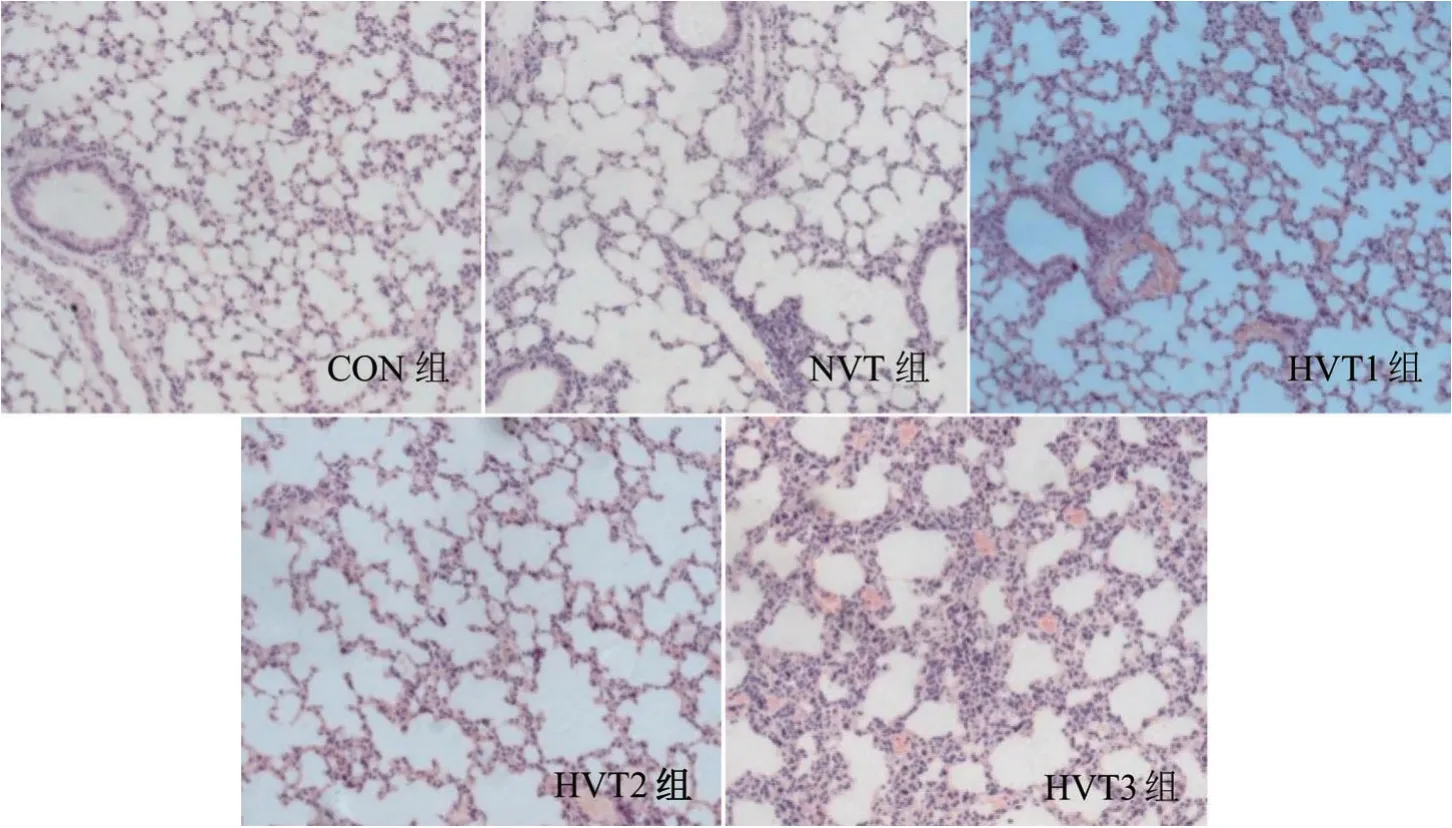
图1 光学显微镜下观察肺组织病理学改变(HE染色,×200)
2.2 5组BALF中总蛋白、IL-1β、IL-6含量比较 与CON组相比,HVT 2组和HVT 3组BALF中总蛋白、IL1-β、IL-6 水平均显著升高(均P<0.05);HVT 3 组BALF 中总蛋白含量显著高于HVT 1 组,IL-1β、IL-6 含量显著高于HVT 1 组和HVT 2 组(均P<0.05);CON 组、NVT 组和HVT 1 组BALF 中总蛋白、IL-1β、IL-6 含量比较,差异均无统计学意义(均P>0.05),见表2。
表2 5组BALF中总蛋白、IL-1β、IL-6含量比较
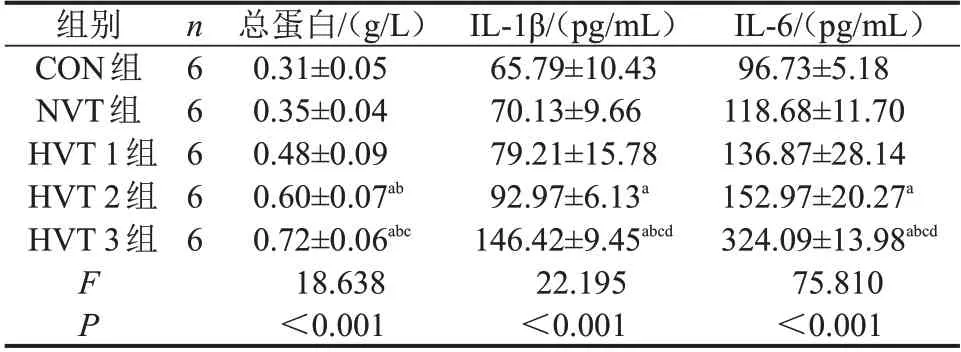
表2 5组BALF中总蛋白、IL-1β、IL-6含量比较
与CON 组比较,aP<0.05;与NVT 组比较,bP<0.05;与HVT 1组比较,cP<0.05;与HVT 2组比较,dP<0.05。
2.3 5 组肺组织TREM1、TREM2 mRNA 和蛋白表达比较 随通气时间延长,肺组织TREM1 表达逐渐增高,TREM2 表达逐渐降低。与CON 组相比,HVT 1 组、HVT 2 组 和HVT 3 组肺组织TREM1 mRNA 和蛋白表达显著增高,TREM2 mRNA 和蛋白表达显著降低,TREM1/TREM2 比值显著高于CON 组和NVT 组(均P<0.05),CON 组与NVT 组比较,差异无统计学意义(P>0.05)。HVT 3 组TREM1 mRNA表达显著高于HVT 1组和HVT 2组(P<0.05),HVT 1 组和HVT 2 组TREM1 mRNA 表达比较,差异无统计学意义(P>0.05);HVT 1 组、HVT 2 组、HVT 3 组TREM2 mRNA 表达两两比较均有明显差异(P<0.05)。HVT 3组TREM1蛋白表达显著高于HVT 1 组(P<0.05),而HVT 3 组TREM2 蛋白表达显著低于HVT 1 组(P<0.05),HVT 1组与HVT 2组、HVT 2组与HVT 3组TREM1和TREM2 蛋白表达比较,差异无统计学意义(P>0.05),见图2、表3。
表3 5组小鼠肺组织TREM1/TREM2 mRNA和蛋白表达比较
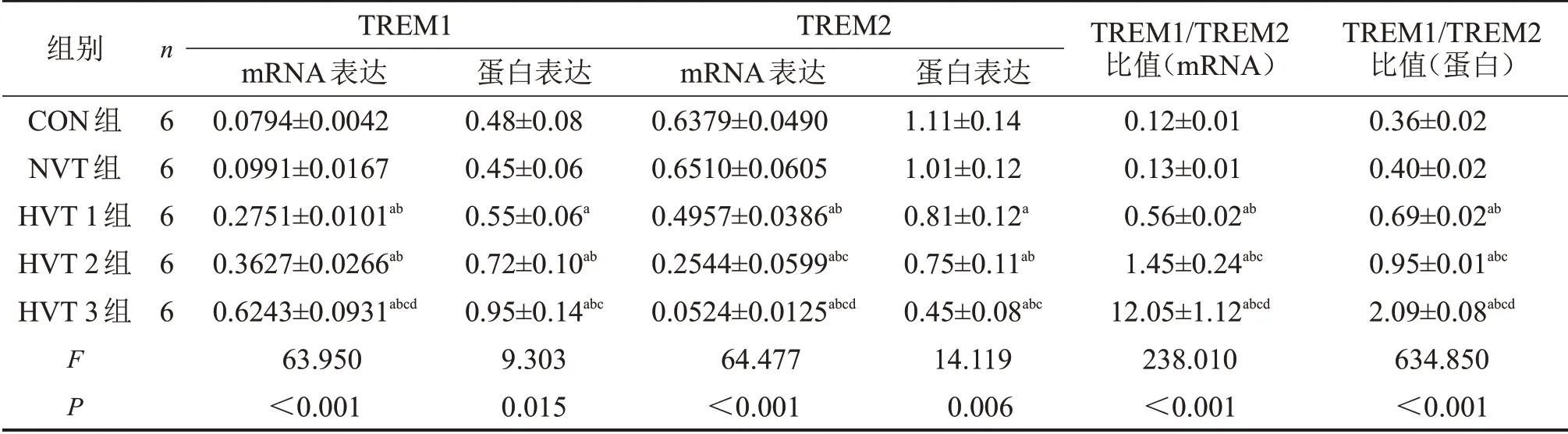
表3 5组小鼠肺组织TREM1/TREM2 mRNA和蛋白表达比较
与CON组比较,aP<0.05;与NVT组比较,bP<0.05;与HVT 1组比较,cP<0.05;与HVT 2组比较,dP<0.05。

图2 肺组织TREM1、TREM2蛋白电泳图
2.4 相关性分析 Pearson 相关分析显示,TREM1与TREM2 mRNA 和蛋白表达均呈负相关关系(r=-0.952,P<0.001;r=-0.683,P=0.03)。
3 讨论
VILI的致病机制复杂,目前认为其发病机制是MV导致肺泡过度扩张、过高肺内外压力差、肺泡周期性打开的物理性损伤和损伤部位释放炎症介质导致临近正常部位或远处器官的炎症性损伤[13]。本研究通过构建VILI小鼠模型,发现随着通气时间延长,肺组织损伤加重,表现为肺组织W/D 值显著增加,肺HE 染色显示肺泡壁断裂,肺泡融合,肺间质增厚及大量炎性细胞浸润,甚至肺泡腔内有红细胞渗出,病理学评分升高,同时BALF 中总蛋白、IL-1β、IL-6含量显著升高(均P<0.05),表明VILI模型构建成功。
TREMs 是一类在先天免疫和适应性免疫中发挥重要调节作用的细胞表面受体家族,与多种生物学功能有关,包括炎症和免疫、凝血、骨代谢、细胞分化、神经可塑性和神经发育[14]。在TREMs家族成员中,TREM1 被视为炎症反应的放大剂,激活的TREM1 通过与TLR 通路协同,触发并放大炎症反应,促进趋化因子和细胞因子的产生[15]。TREM1激动剂促进了HVT造成的炎症反应和肺损伤,而使用TREM1抑制剂则缓解了HVT造成的炎症反应和肺损伤[16]。TREM2 作为髓样细胞上表达的模式识别受体新成员,越来越多的证据证明,其在癌症、神经退行性变及炎症疾病过程中起负调节作用[17-18]。研究表明,TREM2 基因敲除小鼠经LPS 处理后,肺组织中出现更为严重的急性肺损伤,上调TREM2 的表达可缓解LPS所致的急性肺损伤[19]。
正常情况下,机体内高表达TREM2 而低表达TREM1,相关因素处理后改变TREM1和TREM2的平衡,进而导致相应疾病,调整两者平衡,可在一定程度上改善疾病严重程度[20]。经高脂、土霉素饮食处理的小鼠肝脏标本中TREM1的表达随脂肪肝的严重程度而增高,而TREM2 的表达随脂肪肝的严重程度而下降,两者表达呈负相关关系。给予甘氨酸处理后,TREM2的表达增高,而TREM1的表达减低,小鼠肝硬化程度减轻[21]。本研究采用qPCR 法和Western blotting 法检测TREM1 和TREM2 的基因、蛋白表达,结果显示,随着MV 时间延长,HVT组TREM1 mRNA和蛋白表达升高,BALF中炎性因子IL-1β、IL-6 分泌明显增加,而TREM2 的mRNA和蛋白表达降低,TREM1/TREM2比值增加(均P<0.05),表明TREM1 表达上调与炎症反应及肺组织的损伤严重程度相关。TREM1 和TREM2 在VILI中可能互为拮抗。
综上所述,在VILI 小鼠中促炎因子TREM1 与抗炎因子TREM2 的比值显著上调,肺组织炎症因子分泌增加,炎症损伤加重;通过检测TREM1/TREM2比值可以动态评价肺组织的炎症变化。
- 广西医科大学学报的其它文章
- Musashi2 gene expression in lung squamous cell carcinoma and its effect on the maintenance of CD44v6(+)lung cancer stem cells mediated by Notch1 signaling pathway
- 结直肠癌发生过程中普拉梭菌丰度变化的研究*
- 持续隐匿性乙肝病毒感染树鼩肠道菌群变化研究*
- 色素上皮衍生因子联合5-氟尿嘧啶抑制结肠癌细胞凋亡和血管生成的作用研究*
- 葡醛内酯对异烟肼和利福平所致肝损伤小鼠肝组织自噬水平的影响*
- 基于网络药理学和分子对接探讨鸡血藤治疗冠脉微循环疾病机制*

