康益胶囊对大鼠脑缺血再灌注神经功能损伤及氧化应激的影响
丁培娜,崔应麟,王雪可,陈冠廷
(1.河南中医药大学第二临床医学院,河南 郑州 450000;2.河南省中医院,河南 郑州 450002)
缺血性脑血管疾病已经成为严重威胁人类健康的疾病之一。对于脑血管疾病的治疗,及早恢复缺血脑组织血流灌注、改善局部供氧,是降低其病死率、致残率的重要手段之一。但在恢复血流灌注后, 则可能出现更为严重的脑组织结构及功能的损害, 称为缺血/再灌注损伤(ischemia/reperfusion, I/R)[1]。因此,脑缺血再灌注损伤后的诊疗,受到越来越多的重视,而中药制剂在此方面,获得了显著的疗效[2]。脑梗死属中风的范畴,究其病因病机,主要是以虚为本,以风、痰、瘀、火为标,其中又以气虚致脉道不利、瘀血阻络为多见[3]。康益胶囊是在前人基础上,结合多年临床经验,针对中风病因病机特点,筛选的有效药物组成,具有益气活血、通络祛浊之功效。
本实验采取线栓法制备大鼠大脑中动脉急性脑梗死模型,主要观察康益胶囊对脑缺血再灌注损伤后大鼠神经功能缺损症状、脑组织氧化应激水平的影响,探讨康益胶囊的作用机制。
1 材料
1.1 实验动物
健康Wistar雄性大鼠80只,体质量(210±20)g,购自北京维通利华实验动物技术有限公司,生产合格证号:SCXK(京)2016-0011。大鼠分笼喂养,在室温20~25 ℃、相对湿度40%~60%、自然光照情况下给予充足的水和食物,自然昼夜循环。所有动物实验经河南省中医院(河南中医药大学第二附属医院)伦理委员会批准后进行。
1.2 仪器与试剂
水合氯醛(北京索莱宝科技有限公司, 批号:T8590);CPA324S型电子天平 (北京赛多利斯仪器系统有限公司); H1650型离心机 (湖南湘仪实验室仪器开发有限公司);5417型低温高速离心机(Eppendorf公司);脱水机(德国 LEICA AS P300);谷胱甘肽过氧化物酶 (GSH-Px)、过氧化氢酶(CAT)、 过氧化物酶(LDH)(南京建成生物工程研究所)。
1.3 药物
康益胶囊(由河南省中医院自制)是依据急性中风的病因病机特点,由红参、丹参、三七、土鳖虫、水蛭、大黄按照1∶3∶1∶2∶1∶0.6的比例研末配制而成,具有益气活血、通络祛浊之功效;银杏叶片(扬子江药业集团有限公司,国药准字Z20027949,9.6 mg∶2.4 mg/片)。两种药物均配置成混悬液,4 ℃保存备用。
2 方法
2.1 模型制备
参考Longa的实验方法[4],略作改良后制备大鼠大脑中动脉阻塞 (middle cerebral artery occlusion,MCAO)模型。所有大鼠禁食12 h,自由饮水。10%水合氯醛(35 mg/kg)腹腔注射麻醉大鼠。麻醉后的大鼠,仰卧位固定在手术板上,颈正中线开口,逐层分离,暴露右侧颈总动脉(CCA)、颈内动脉(ICA)和颈外动脉(ECA),避免刺激迷走神经。在CCA近心端和ECA近端、紧邻分叉处各置一根丝线并结扎,用动脉夹夹闭颈内动脉,在CCA上距ICA、CCA分叉4 mm地方剪一“V”形切口,将栓线圆钝端沿切口插入ICA,缓缓向前推进18~20 mm,稍遇阻力即停止前进。结扎,固定栓线和防止出血,逐层缝合伤口,栓线末端留1 cm于皮外。2 h后拔出线拴,形成再灌注。假手术组的大鼠不插入线拴,只分离血管。
按照Zea-Longa′s五级标准评分法,术后2 h对大鼠进行神经行为症状评分。评分方法见表1。评分在1~3分者为造模成功,评分为0分、4分及生命体征不平稳的动物剔除。

表1 Zea Longa's五级标准评分法
2.2 分组与给药
将大鼠随机分为假手术组、模型组、康益胶囊低剂量组和康益胶囊中剂量组、康益胶囊高剂量组和银杏叶组,共6组,每组12只。结合前期的预实验结果,各组给药剂量按照人和大鼠体表面积换算,人与大鼠的换算系数为0.018[5],康益胶囊低剂量组给予75 mg/kg混悬液,康益胶囊中剂量组给予150 mg/kg混悬液,康益胶囊高剂量组给予300 mg/kg混悬液,阳性药物组给予银杏叶片150 mg/kg混悬液,模型组、假手术组则灌胃相同体积的溶剂对照。再灌注后24 h开始灌胃给药,每日1次,连续灌胃14 d。
2.3 评价指标
2.3.1 一般情况观察
实验期间每天观察并记录大鼠活动、饮食情况、精神状况、体质量变化等。
2.3.2 神经行为恢复评分
采用改良神经功能评分(mNSS)[6]评估康益胶囊对脑缺血再灌注大鼠神经功能恢复的影响。于术后24 h、第3天、第7天、第14天分别评分,每次固定在同一时间点完成。mNSS总分为18分,神经功能损伤程度随分值增大而加重,其中0~6分为轻度损伤,7~12分为中度损伤,13~18分为重度损伤。
2.3.3 大鼠脑组织中的含水量
第14天评分后,每组大鼠随机选取6只,麻醉后断头取脑,剥离脑组织,生理盐水冲洗,嗅球、低位脑干及小脑去除,用滤纸吸干水分后称重(脑湿重)。置于100 ℃的烘箱中烘烤 24 h后再称重(脑干重)[7]。
脑组织含水量(%)=(脑湿重-脑干重)/脑湿重×100%
2.3.4 大鼠脑组织中CAT、GSH-Px活性和LDH含量的检测
将各组剩余6只大鼠,处死后断头取脑,冰盒内快速分离大脑,取部分右侧大脑半球,准确称重后,按照1∶9的比例加入预冷至4 ℃的生理盐水,在冰上研磨制备成10%组织匀浆,然后在4 ℃下3 000 r/min离心10 min,取上清液。分别按试剂盒说明书测定CAT、GSH-Px的活性和LDH含量。
2.4 统计学方法
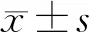
3 结果
3.1 一般情况
康益胶囊各剂量组灌胃期间,大鼠活动、精神、饮食、体质量与余组大鼠无明显差异。
3.2 大鼠神经功能评分(mNSS)比较
假手术组没有神经功能缺损;灌胃前,其余各组间神经功能评分无明显差异(P>0.05)。灌胃14 d后,模型组神经功能缺损改善不明显;康益胶囊低、中、高剂量组和银杏叶组神经功能缺损评分较模型组均显著降低,差异有统计学意义(P<0.05,P<0.01);高剂量组较银杏叶组改善更明显(P<0.01)。结果见表2。

表2 各组大鼠神经功能mNSS评分比较分)
3.3 大鼠脑组织含水量的比较
模型组大鼠的脑组织含水量均明显升高,与假手术组比较有显著性差异(P<0.01);康益胶囊低、中、高剂量组较模型组脑含水量明显降低 (P<0.05,P<0.01);高剂量组与银杏叶组比较无统计学意义(P>0.05)。结果见表3。
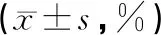
表3 各组大鼠脑缺血后脑组织含水量的比较
3.4 大鼠脑缺血再灌注脑组织CAT、GSH-Px活性的比较
与假手术组相比,模型组CAT、GSH-Px的活性显著下降 (P<0.01);康益胶囊中剂量组及高剂量组CAT活性明显高于模型组 (P<0.05) ;康益胶囊各组及银杏叶组GSH-Px活性明显高于模型组 (P<0.05,P<0.01)。结果见表4。
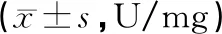
表4 各组大鼠脑缺血再灌注脑组织CAT、GSH-Px活性的比较
3.5 大鼠脑缺血再灌注脑组织中LDH水平的比较
与假手术组相比,模型组LDH的含有量显著增加(P<0.01);康益胶囊各组及银杏叶组LDH的含量明显低于模型组(P<0.05,P<0.01)。结果见表5。
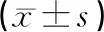
表5 各组大鼠脑缺血再灌注脑组织LDH含量的比较
4 讨论
脑梗死后局部脑组织缺血和缺氧,进一步引起病灶处组织软化、坏死,导致神经功能缺损。及时恢复血流灌注是目前最佳治疗方案。研究显示[8],再灌注治疗可拯救即将死亡的细胞,在功能上恢复可逆性损伤,但大量自由基的生成、氧化应激的激活等仍会持续损伤脑组织进而导致神经功能缺损症状。在健康状态下,脑内存在抗氧化系统,使脑内的氧化作用与抗氧化作用处于平衡状态,保证神经系统功能正常,其中的酶抗氧化系统,包括有CAT、GSH-Px等,它们在自由基的生成、清除及过氧化链式反应的中止等方面发挥着重要作用。脑缺血再灌注损伤时,自由基就会大量生成,同时自由基清除酶活性也会下降,导致自由基清除率降低,自由基大量蓄积,体内抗氧化能力紊乱,损害脑神经功能[9-11]。大量自由基作用于脂质发生过氧化反应,致使蛋白质和核酸等生物大分子氧化损坏,蛋白质氧化引起蛋白质羟基的生成[12-13]。谷胱甘肽过氧化物酶(GSH-Px)是人体内的自由基清除酶、水溶性过氧化物分解酶,可以起神经保护的作用,其活性能够反映机体自由基清除的能力[14];过氧化氢酶(CAT) 是具有还原活性的抗氧化酶,能减轻脂质过氧化损伤,其活性可以反应氧化应激反应的激活状态[15];脑细胞在急性缺氧状态会释放大量乳酸脱氢酶(LDH),LDH可作为反映神经元损伤情况的指标[16]。本实验研究表明,大鼠在脑缺血再灌注后,神经功能缺损症状明显,脑水肿显著,脑组织中自由基清除酶如CAT、GSH-Px的活性明显降低,LDH含量明显升高,脑损伤明显。
本实验研究结果显示,康益胶囊可明显促进大鼠脑缺血再灌注后神经功能缺损症状的恢复;显著降低脑组织含水量;提高MCAO 后大鼠脑组织中CAT、GSH-Px等的活性,明显降低LDH的含量。可见,康益胶囊具有明显的修复神经功能缺损、降脑水肿和抗氧化的作用,对大鼠缺血性损伤起到修复作用。

