UCH37与PRDX1相互作用影响肝癌细胞迁移和侵袭的机制研究
刘海宁 张宁萍 王 平 唐文清 刘韬韬 沈锡中 方 颖
原发性肝癌(以下简称为肝癌)是世界范围内的高发肿瘤,其中70%~90%为肝细胞癌(HCC)[1]。肝癌在全球男性恶性肿瘤年发病率中居第5位,恶性肿瘤病死率中居第2位;肝癌在全球女性恶性肿瘤年发病率中居第9位,恶性肿瘤病死率中居第6位[1]。中国肝癌的发病率远高于其他国家,给家庭和社会带来了沉重的负担。肝癌复发是影响肝癌术后生存时间的重要因素,是肝癌切除术后致死的主要原因。对于肝癌术后复发和转移的中晚期患者,目前唯一有效的靶向治疗药物索拉菲尼也只能延长约3个月的生存期[2]。因此,亟需探索肝癌术后复发和转移的分子机制,以期寻找新的可早期诊断肝癌术后复发和转移的生物学标志物。
泛素羧基末端水解酶37(UCH37)是一种去泛素化酶,通过泛素-蛋白酶体降解途径参与蛋白质的降解。过氧化物酶1(PRDX1)是PRDX家族的一员,可有效消除活性氧,在氧化应激中起着至关重要的作用。本课题组的前期研究发现,UCH37和PRDX1分别在肝癌组织中呈高表达和低表达,与肝癌术后预后不良相关;UCH37和PRDX1分别能促进和抑制肝癌细胞的迁移和侵袭;此外,还发现PRDX1与UCH37相互作用后可影响由UCH37所致的促进肝癌细胞迁移和侵袭的能力[3-4]。c-Myc属于Myc蛋白家族成员,在多种恶性肿瘤细胞中呈高表达。文献报道,PRDX1可通过结合c-Myc的Myc 盒Ⅱ(MB Ⅱ)结构域,特异性抑制c-Myc的转录活性,从而发挥抑制肿瘤进展的作用[5-6]。本研究进一步探索UCH37与 PRDX1相互作用后通过c-Myc促进肝癌细胞迁移和侵袭的分子机制。
1 材料与方法
1.1 细胞与试剂
293T细胞购自中国科学院上海生命科学研究院。小鼠抗人UCH37单克隆抗体、小鼠抗人PRDX1单克隆抗体购自美国Santa Cruz公司,兔抗人UCH37多克隆抗体购自美国Abcam公司,转染试剂Lipofectamine 2000购自美国Invitrogen公司,蛋白酶抑制剂MG132购自德国Merck公司,BCA蛋白质定量检测试剂盒购自生工生物工程(上海)股份有限公司,蛋白A-琼脂糖购自美国Roche公司。
1.2 转染
将细胞按5×105个/孔接种于6孔板内,待生长汇合到75%密度时,按照Lipofectamin 2000试剂盒说明书进行如下转染。将10 μL Lipofectamine 2000滴加至90 μL无血清培养基中,混匀,室温孵育5 min。将10 μL稀释的质粒滴加至90 μL无血清培养基中,混匀。将含有质粒和Lipofectamine 2000的无血清培养基混匀,室温孵育20 min。换2 mL无血清培养基,将Lipofectamine 2000和质粒混合物加入6孔板培养皿中,混匀。在37 ℃、5% CO2细胞培养箱中培养5 h,换有血清培养基,并观察荧光以确定转染效率。48 h后收集细胞,提取蛋白行蛋白质印迹法(Western blotting)检测。
1.3 Western blotting检测
收集细胞前12 h,在培养基中加入10 μmol MG132以减少细胞蛋白降解。离心收集细胞,加适量细胞裂解液裂解细胞,收集细胞裂解液,冰上预冷30 min后,4 ℃ 12 000 r/min 离心10 min,收集细胞蛋白。用BCA蛋白质定量检测试剂盒对细胞蛋白进行定量分析。取适量蛋白加5×蛋白上样缓冲液,100 ℃水煮8 min,使之变性。蛋白样品在12%的分离胶中电泳数小时后转移到NC膜上。将膜置于5%牛奶封闭液中,在室温下封闭1 h,置入适量一抗溶液,4 ℃孵育过夜。次日,洗膜,加入适量二抗溶液,室温孵育1 h,放入仪器中曝光并记录图片。
1.4 免疫共沉淀
先对蛋白A-琼脂糖进行预处理:将蛋白A-琼脂糖混匀,加入1 mL 1×PBS,4 ℃ 3 000 r/min离心2 min,弃去上清,重复3次。收集细胞蛋白,加入适量一抗溶液,4 ℃旋转10 h。加入适量已预处理的蛋白A-琼脂糖,4 ℃旋转过夜。次日将混合物于4 ℃ 3 000 r/min离心5 min,弃上清液,重复3次,最终获得免疫共沉淀的沉淀物,用于Western blotting检测。
1.5 细胞免疫荧光及激光共聚焦实验
在24孔板中接种细胞,待细胞贴壁后弃去培养基,用1×PBS轻轻洗1遍。将预先混合好并冰浴的丙酮、甲醇混合液(以体积1∶1混合)加入细胞培养板孔中,室温放置2 min,吸弃混合液,用1×PBS轻轻洗3遍。在细胞培养板孔中,加入溶于1×PBS的5%胎牛血清溶液,37 ℃恒温箱中封闭1 h。PBS-T(1×PBS中加入0.2% Triton X-100)冲洗3次,加入适量一抗溶液,4 ℃孵育过夜。加入不同荧光标记的二抗溶液,37 ℃恒温箱中避光孵育1 h。用DAPI溶液进行细胞核染色,PBS-T洗涤3次。取出盖玻片,用荧光淬灭剂封片,激光共聚焦显微镜下观察并拍照记录。
2 结果
2.1 UCH37高表达后PRDX1与c-Myc的结合情况
在本课题组的前期研究中,免疫共沉淀和激光共聚焦结果已证实UCH37与PRDX1之间存在相互作用[4]。本研究中探讨了UCH37、PRDX1和c-Myc之间的关系。免疫共沉淀结果显示UCH37与c-Myc、PRDX1与c-Myc之间存在相互结合(图1A、1B),激光共聚焦结果显示UCH37和c-Myc共定位于细胞核内(图1C)。随后,在6孔板中种植293T细胞,待细胞长至75%密度时转染质粒。第1个孔转染PRDX1质粒3 μg,第2个孔转染PRDX1质粒3 μg和c-Myc质粒2 μg,第3、4、5个孔在转染PRDX1质粒3 μg和c-Myc质粒2 μg的基础上再分别转染UCH37质粒1 μg、3 μg和6 μg。通过PRDX1抗体进行免疫共沉淀,检测与其结合的c-Myc强度,结果显示随着UCH37转染质粒量的梯度增高,用相同量的PRDX1进行免疫共沉淀后,与PRDX1结合的c-Myc蛋白表达量逐渐降低(图1B)。
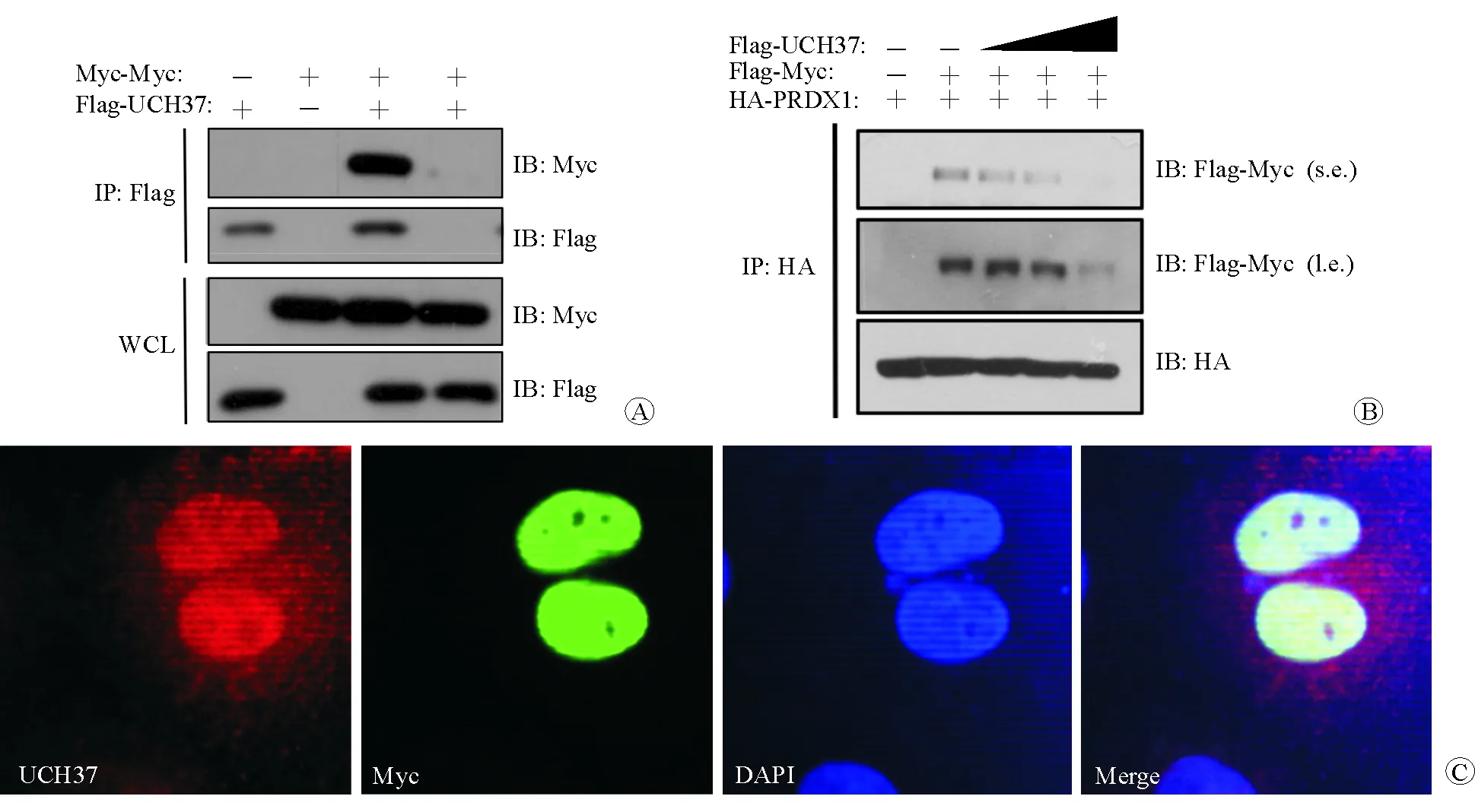
注:Flag为融合了Flag标签蛋白;HA为融合了HA标签蛋白;IP为免疫共沉淀;IB为蛋白质印迹;WCL为全细胞溶解;s.e.为短时间曝光;l.e.为长时间曝光
2.2 UCH37高表达后PRDX1的表达情况
在上述实验中获取的细胞总蛋白行Western blotting检测,结果显示,随着UCH37的梯度表达增高, PRDX1蛋白表达量逐渐降低(图2A)。神经前体细胞表达发育调控蛋白4(NEDD4)蛋白属于含HECT结构域的泛素E3连接酶。本研究通过免疫共沉淀及激光共聚焦技术,发现UCH37与NEDD4之间存在相互作用(图2B、2C)。此外,还发现过表达NEDD4后,PRDX1的泛素化水平明显增高(图2D)。由此可见,UCH37高表达后,通过NEDD4对PRDX1泛素化降解增加而使其呈低表达。
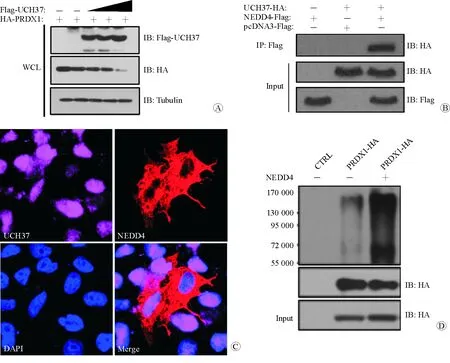
注:Input为阳性对照;CTRL为阴性对照
2.3 UCH37高表达后细胞核内c-Myc蛋白表达情况
本研究进一步探讨了c-Myc在细胞内的表达情况。激光共聚焦结果显示,PRDX1在细胞核和细胞质内均有表达,c-Myc主要在细胞核内表达,两者共定位于细胞核内(图3A)。在6孔板中种植293T细胞,待细胞长至75%密度时转染质粒。每个孔都转染PRDX1质粒3 μg,第1个孔未转染UCH37质粒,第2、3、4个孔分别转染UCH37质粒2 μg、4 μg和8 μg。转染48 h后收集细胞,用试剂盒分离细胞质和细胞核蛋白分别行Western blotting检测(图3B)。结果显示,c-Myc主要在细胞核中,细胞质中基本没有表达。此外,随着UCH37的梯度表达增高,细胞核内c-Myc蛋白表达量逐渐增高。
3 讨论
依赖泛素的蛋白质降解途径(UPP)可选择性地降解细胞内的蛋白质,是一条重要的非溶酶体蛋白降解途径,对蛋白质翻译后修饰和降解起着关键作用[7-9]。UCH37是一种去泛素化酶。目前关于UCH37发挥去泛素化酶作用的机制研究得较为深入,即UCH37和26S蛋白酶体的一个亚基hRpn13通过C末端共同的KEKE模序,将UCH37富集到26S蛋白酶体的表面,解除UCH37自主抑制作用,从而激活其去泛素化酶的活性[10]。然而,关于UCH37在信号转导、作用的底物蛋白、细胞功能等方面的研究较少。有文献报道,UCH37可上调转化生长因子-β(TGF-β)通路[11];可能通过与人Ino80染色质重塑复合物(hINO80)结合发挥调控基因转录的作用[12];通过Wnt通路参与肿瘤的发生、发展[13]。UCH37在肿瘤中的作用研究甚少。
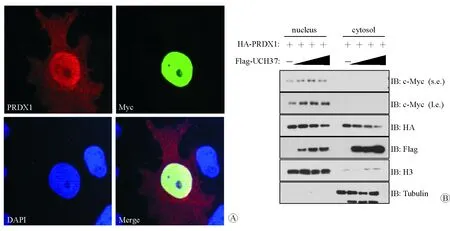
图3 c-Myc的表达情况 A PRDX1与c-Myc的激光共聚焦结果 ×400 B UCH37梯度表达增高后c-Myc表达变化
本课题组前期开展了UCH37与肝癌之间关系的研究,发现UCH37在肝癌组织中呈高表达,并且是肝癌术后无瘤生存的独立危险因素;体外实验结果显示,UCH37可促进肝癌细胞的迁移和侵袭[3]。此外,应用免疫共沉淀技术,在肝癌组织中分离和富集了与UCH37相互作用的蛋白质;对免疫共沉淀产物进行双向电泳,联合质谱技术及高效的数据库搜索手段,筛选出27种与UCH37相互作用的蛋白质。同时应用原核细胞表达、纯化蛋白的技术,在体外得到了纯化的GST-UCH37融合蛋白,将此融合蛋白与Huh7细胞总蛋白进行GST pull-down实验,对沉淀产物行SDS-PAGE电泳,联合质谱技术及高效的数据库搜索手段,筛选出63种与UCH37相互作用的蛋白质。分析两组结果,发现了一种共同的蛋白质PRDX1。
PRDX1是过氧化物酶家族成员,主要分布在细胞质,具有清除体内生物活性氧[14]、调节信号转导通路[15-16]和分子伴侣[17]等功能。有研究显示,PRDX1在乳腺癌、肺癌、前列腺癌、结肠癌、肝癌等组织中均呈高表达[18-23],与预后不良相关[24-27];PRDX1基因敲除能增强化学治疗药物的效果[28]。然而,另有研究显示PRDX1是一种抑癌因子,在肿瘤组织中呈低表达,可抑制肿瘤的复发、转移[29-30]。
鉴于PRDX1在肝癌中发挥促癌还是抑癌作用尚未明确,本课题组就PRDX1在肝癌组织中的表达情况及其对肝癌细胞生物学行为的影响进行了研究,结果发现PRDX1在肝癌组织中呈低表达,且是肝癌术后无瘤生存和总体生存的独立危险因素;体外实验结果显示,PRDX1可抑制肝癌细胞的迁移和侵袭[4]。
文献报道,PRDX1通过结合癌蛋白c-Myc的MB Ⅱ结构域,特异性抑制c-Myc的转录活性,调节c-Myc靶基因的表达,从而发挥其抑癌基因的特性[5-6]。c-Myc属于Myc蛋白家族成员,是一种转录调控蛋白。正常细胞不表达或低表达c-Myc,恶性肿瘤细胞中c-Myc呈异常高表达,包括乳腺癌、结肠癌、宫颈癌、髓性白血病、黑色素瘤、骨肉瘤、恶性胶质瘤、小细胞肺癌及成神经管细胞瘤[31-33]。近年来有研究表明,c-Myc在肝癌组织中同样发挥促肿瘤发生、发展的作用,并开始探索针对Myc的靶向治疗药物[34]。对其进一步的分子机制研究显示,c-Myc具有促进肿瘤细胞增殖、抑制干细胞分化、促进肿瘤血管生成、促进肿瘤细胞转移、干扰肿瘤细胞凋亡的作用。在细胞内,c-Myc通过促进或抑制靶基因的转录而发挥作用:一方面,c-Myc通过促进CDC25A、周期素依赖性蛋白激酶4(CDK4)、细胞周期蛋白D2(Cyclin D2)、Cyclin E、Cyclin A等细胞周期相关生长因子的表达,促进细胞增殖及恶性转化;另一方面,c-Myc通过抑制特异性生长阻滞基因1(GAS1)、p15、p21、p27、生长阻滞及DNA损坏基因(GADD)等生长抑制基因,解除生长抑制基因对细胞无限生长的抑制,进而促进细胞增殖及恶性转化[35-40]。此外,c-Myc能够调控miRNA,也受miRNA调控[41]。有研究发现,c-Myc通过泛素/蛋白酶体通路进行降解[42]。基于上述研究成果和本课题组前期的研究基础,我们提出假设并验证,即UCH37高表达后通过与PRDX1结合,使PRDX1与c-Myc结合减少,释放出c-Myc聚集在细胞核内,发挥促进肿瘤进展的作用。
本实验发现UCH37高表达后通过以下两个方面发挥促进肝癌发生、发展的作用(图4):首先,UCH37高表达后对PRDX1泛素化降解增加而使其呈低表达,而在本课题组的前期研究中发现PRDX1在肝癌中是一个抑癌因子,发挥着抑制肝癌细胞迁移和侵袭的作用;其次,随着UCH37的梯度表达增高,用相同量的PRDX1进行免疫共沉淀后,与PRDX1结合的c-Myc蛋白逐渐减少,同时细胞核内c-Myc蛋白逐渐增多,表明释放出的c-Myc聚积在细胞核中,发挥其促进肿瘤进展的作用。因此,UCH37高表达后通过降低抑癌因子PRDX1的表达和增高促癌因子c-Myc的表达,从而发挥促进肝癌发生、发展的作用。在既往研究中,本课题组在肝癌细胞系Huh7细胞中构建UCH37与PRDX1过表达和下调的稳定的单克隆细胞株,从中探索UCH37、PRDX1与肝癌发生、发展之间的关系[3-4],由于本研究只是初步探索UCH37通过PRDX1促进肝癌发生、发展的分子机制,只在293T细胞中进行了研究,今后将拓展至肝癌细胞系中进行深入研究。
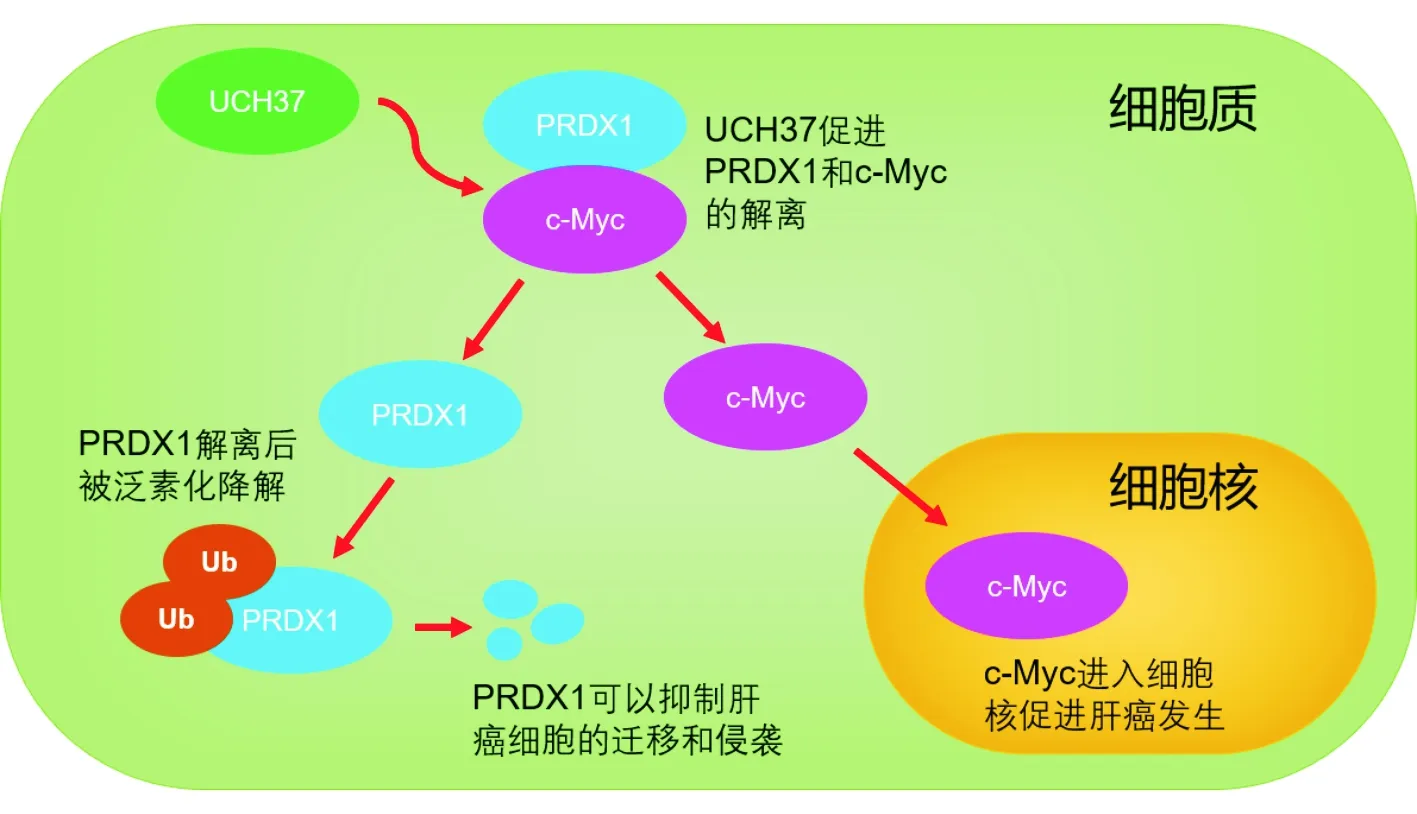
图4 UCH37通过PRDX1影响c-Myc表达的作用机制
综上所述,本研究显示,UCH37高表达后对PRDX1泛素化降解增加而使其呈低表达,同时UCH37通过与PRDX1结合使PRDX1与c-Myc结合减少,释放出c-Myc聚集在细胞核内,从而发挥促进肝癌进展的作用。此研究结论为肝癌发生、发展的机制研究提供了新的思路。
——一道江苏高考题的奥秘解读和拓展

