血清尿酸水平对胃癌前病变及胃癌的诊断价值
陈 莹 傅承宏 唐珊珊 彭永德 徐浣白 徐 琦
高尿酸血症(HUA)是一种由嘌呤代谢紊乱引起的慢性代谢性疾病。既往研究表明,尿酸(UA)既是一种致病性炎性介质,又是一种抗氧化剂[1]。流行病学调查显示,高血清尿酸(SUA)水平与肿瘤的发生、复发和死亡的风险有关[2]。UA水平升高也是肥胖[3]、心血管疾病[4]、代谢综合征[5]、糖尿病[6]等疾病的常见危险因素。此外,有研究显示SUA在神经退行性疾病中具有神经保护作用[7]。目前SUA预测肿瘤的作用尚存争议,需要更多的研究来探索其与肿瘤的关系。
目前中国胃癌(GC)的年发病率为679.1/10万,死亡率为498.0/10万,死亡率仅次于肺癌[8]。GC的发展是一个渐进的过程,胃癌前病变(PLGC)包括胃溃疡、慢性萎缩性胃炎、肠上皮化生、异型增生等。由于GC早期诊断率较低,约70%患者确诊时已错过手术治疗的最佳时机[9],故应加强胃癌的早期筛查、诊断和干预。本研究旨在分析SUA水平与PLGC及GC之间的关系,探讨SUA检测在PLGC和GC筛查中的价值。
1 资料与方法
1.1 一般资料
本研究收集了2018年2月至2020年2月在上海交通大学附属第一人民医院行胃镜检查的326例受检者的临床资料,其中男性136例,女性190例;年龄24~88岁,平均年龄为(57.87±12.55)岁;PLGC组123例(37.7%),GC组57例(17.5%),对照组146例(44.8%)。所有受检者均在胃镜下于病灶处取胃黏膜活组织行病理检查。根据日本胃癌协会的第3版GC分类指南[10],将GC组患者分为分化型40例[包括高分化(Ⅰ级)的乳头状腺癌或管状腺癌、中分化(Ⅱ~Ⅲ级)的乳头状腺癌或管状腺癌]和未分化型17例(包括分化Ⅳ级的乳头状腺癌或管状腺癌、印戒细胞癌和黏液腺癌)。将胃划分为上部、中部、下部,上部包括胃底、贲门和上部胃体,中部包括中部胃体、下部胃体和胃角,下部包括胃窦和幽门。病变的浸润深度分为黏膜层及黏膜下层。
纳入标准:(1)受试者年龄≥18岁;(2)临床资料完整;(3)签署书面知情同意书。排除标准:(1)急性并发症、糖尿病、严重心脑血管疾病、严重肝肾功能障碍、恶性肿瘤、白血病等;(2)近期使用过一些药物,包括利尿剂、调脂药、阿司匹林、血管紧张素转换酶抑制剂、血管紧张素受体拮抗剂、促进UA排泄和抑制UA生成的药物;(3)SUA水平<180 μmol/L;(4)妊娠、哺乳期妇女。本研究经医院医学伦理委员会批准执行。
1.2 方法
收集受检者的临床资料,包括年龄、性别、身高、体质量,计算BMI,以BMI≥28 kg/m2为肥胖。采用全自动生化分析仪检测三酰甘油(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、SUA、血肌酐(Cr),记录吸烟、饮酒史情况,并对结果进行分析。此外,本研究以SUA的中位数为界值,将GC组患者分为高SUA组和低SUA组[11]。
1.3 统计学分析
应用SPSS 24.0软件进行统计学分析。计量资料以均数±标准差表示,计数资料以例(%)表示,两组独立、正态、方差齐资料组间比较采用t检验;样本率的比较采用卡方检验或Fisher确切概率法;将单因素分析有统计学意义的指标纳入多因素分析,多因素分析采用logistic回归模型。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料的比较
本研究共纳入326例受检者临床资料。所有受检者均在胃镜下于病灶处取胃黏膜活组织行病理检查,根据病理结果将受检者分为对照组146例(胃黏膜正常或轻度非萎缩性胃炎)、PLGC组123例(55例慢性萎缩性胃炎、37例胃溃疡、31例肠上皮化生)及GC组57例。根据326例受检者的SUA(180 μmol/L~514 μmol/L),其中位数为296.95 μmol/L。按SUA中位数将GC组患者分为两组,低SUA组中诊断为分化型的有7例、未分化型6例,高SUA组中诊断为分化型的有33例、未分化型11例。
结果显示,与对照组相比,PLGC组中女性较多,BMI、TG、SUA和Cr水平较高(P<0.05)。而GC组则较对照组的年龄大,SUA水平高(P<0.05)。此外,与PLGC组比较,GC组的SUA水平较高(P<0.001)。见表1。

表1 3组的一般资料比较
2.2 PLGC和GC发生的影响因素分析
将性别(男=1,女=0)、TG(原始值录入)、BMI(原始值录入)、SUA(原始值录入)、Cr(原始值录入)作为自变量,将病理诊断是否为PLGC(是=1,否=0)作为因变量,纳入多因素logistic回归分析,结果显示性别、TG、BMI、SUA是PLGC的影响因素。将年龄和SUA(原始值录入)作为自变量,将病理诊断是否为GC(是=1,否=0)作为因变量,纳入多因素logistic回归分析,结果显示年龄和SUA是GC的影响因素。见表2。
2.3 SUA对PLGC及GC的诊断价值
如图1所示,SUA诊断PLGC的ROC曲线下面积(AUC)为0.926(95%CI:0.895~0.957),敏感度为78%,特异度为78.8%,最佳截断值为318 μmol/L;SUA诊断GC的AUC为0.896(95%CI:0.840~0.952),敏感度为73.7%,特异度为87.7%,最佳截断值为342.9 μmol/L。上述结果提示SUA对PLGC和GC具有较好的诊断效能。

表2 影响PLGC和GC发生的多因素logistic回归分析
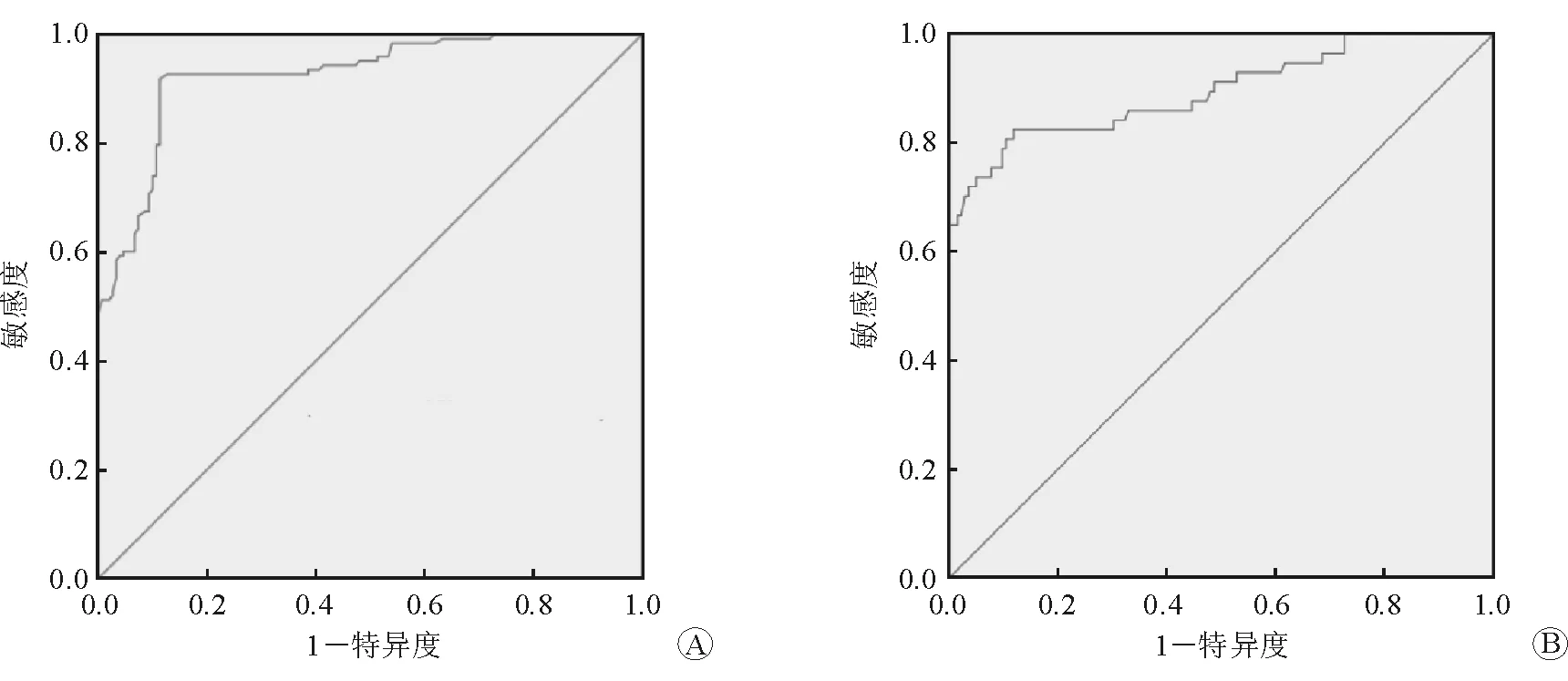
图1 SUA诊断PLGC和GC的ROC曲线 A PLGC B GC
2.4 胃部疾病各组与对照组的SUA水平比较
胃部疾病各组(慢性萎缩性胃炎组、胃溃疡组、肠上皮化生组和GC组)的SUA水平均高于对照组, 胃溃疡组、肠上皮化生组和GC组的SUA水平均高于慢性萎缩性胃炎组,差异均有统计学意义(P均<0.05)。胃溃疡组与肠上皮化生组之间,以及两者分别与GC组之间的SUA水平相比较,差异均无统计学意义(P均>0.05)。见表3。

表3 各组的SUA水平比较()
2.5 不同分化程度的GC患者的临床资料比较
如表4所示,GC的分化程度与年龄、淋巴结转移、高SUA水平有关(P<0.05),而与患者的性别、病变部位、病灶大小、浸润深度无明显关系(P>0.05)。高SUA水平的GC患者中,分化型患者比例更高,肿瘤恶性程度较低。
3 讨论
UA在肿瘤研究中得到了广泛的关注。UA是人体血液中含量丰富的抗氧化分子,被认为具有预防肿瘤的作用[12]。然而,在不同肿瘤类型患者及亚组研究中,乳腺癌、肾癌,以及一线化学治疗的非小细胞肺癌患者的UA升高明显,与预后不良相关[13-15]。既往研究结果显示,UA是影响晚期GC患者预后的不良因素[16]。与本文结果基本保持一致。本研究结果显示,SUA是PLGC和GC发生的影响因素。近年来中国GC的发病率和死亡率呈升高趋势,GC早期确诊率不高,不能及时诊断和有效治疗导致多数患者在确诊时已处于晚期,并且手术和化学治疗后的复发率也较高,故GC患者的预后不佳。因此,探寻有效的早期GC诊断指标对于改善患者预后非常重要。
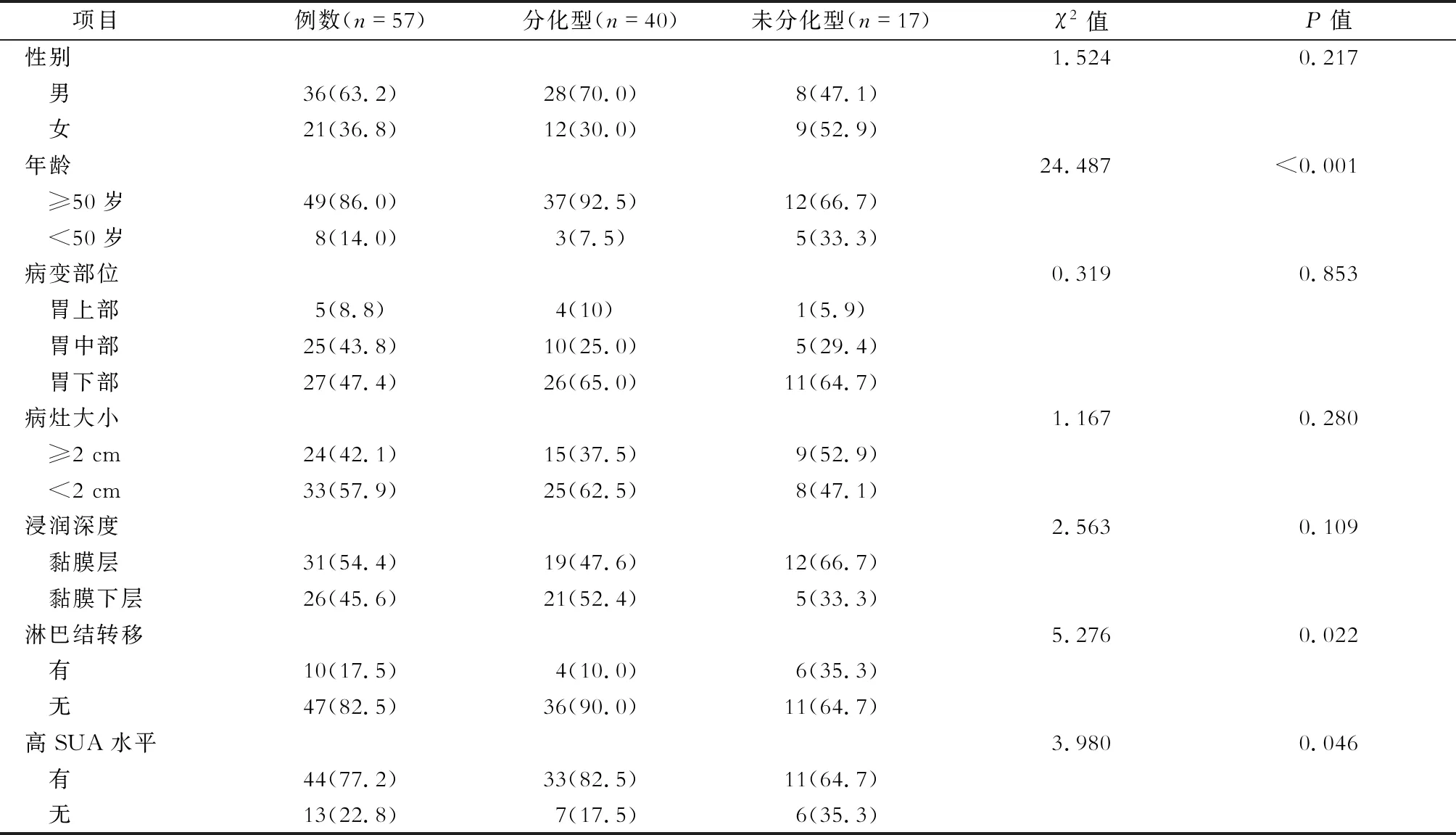
表4 不同分化程度的GC患者的临床资料比较/例(%)
研究表明GC发病率随着年龄的增长而逐渐升高,吸烟、饮酒等不良生活习惯,慢性萎缩性胃炎、肠上皮化生等PLGC,遗传基因,环境因素等与GC的发生也密切相关[17]。本研究中,多因素logistic回归分析结果显示,性别、TG、BMI、SUA是PLGC发生的影响因素,年龄、SUA是GC发生的影响因素。本研究结果显示吸烟及饮酒与GC发生不明显相关,与以往研究结果存在差异,这可能与统计方法及样本量的差异有关,今后有待扩大样本量并排除混杂因素的影响,进一步探讨。此外,本研究结果显示,SUA诊断PLGC的AUC为0.926(95%CI:0.895~0.957),敏感度为78%,特异度为78.8%,最佳截断值为318 μmol/L;SUA诊断GC的AUC为0.896(95%CI:0.840~0.952),敏感度为73.7%,特异度为87.7%,最佳截断值为342.9 μmol/L;结果提示SUA对PLGC和GC具有较好的诊断效能,有助于GC的早期诊断。
从胃正常黏膜到多灶性萎缩、肠上皮化生,再到异型增生甚至癌变的病理过程是一个多步骤、递进演变的过程。在本研究中,PLGC组(慢性萎缩性胃炎、胃溃疡、肠上皮化生)与GC组的SUA水平均明显高于对照组(P均<0.05)。此外,GC组的SUA水平仅与PLGC组中的慢性萎缩性胃炎患者的SUA水平差异有统计学意义(P<0.05)。上述结果提示,在PLGC和GC筛查中,SUA水平可能是临床诊断的重要参考指标。此外,本研究还发现GC的分化程度与SUA有关(P<0.05),高SUA水平的GC患者的分化型比例较高,肿瘤恶性程度较低。由于正常胃—PLGC—GC的病理生理过程涉及多种因素,SUA可能是影响GC发生、发展因素的其中之一,形成促进肿瘤细胞突变和增殖的内环境,具体机制有待进一步探究。
UA是嘌呤代谢的最终产物,具有抗氧化功能,可清除氧自由基,避免机体受损。鉴于氧化应激在癌变中的重要作用,UA被认为具有抗肿瘤的保护效应。研究表明,高UA水平的肿瘤患者的病死率较低,生存期较长[18-19]。然而,UA有双重作用,也可作为促氧化剂[20]。既往研究表明,UA升高与肿瘤病死率高及生存率低有关[13-15],这提示UA在肿瘤发展中可能起着一定的作用。UA作为促氧化剂,可产生氧自由基,其促炎作用可介导肿瘤细胞的突变过程,参与恶性肿瘤的发生、发展。SUA参与GC发生、发展的具体机制尚不明确,可能是由于炎性介质是肿瘤局部环境的重要组成部分,炎性反应可促进肿瘤细胞的增殖和生存[21],而UA可促进炎性反应,其可进入机体细胞激活MAPK,进一步激活NF-κB炎性反应通路,诱导单核细胞趋化蛋白-1(MCP-l)、C反应蛋白(CRP)等炎性介质的表达[22]。CRP、脂联素、瘦素与UA共同构成慢性炎性反应环境,长期慢性炎性反应可能促进肿瘤的进展[21]。此外,UA进入肿瘤细胞后可抑制黄嘌呤氧化还原酶(XOR)的表达,低水平的XOR可刺激分化蛋白抑制剂的表达,通过调节环氧合酶(COX-2)和基质金属蛋白酶-1(MMP-1)的分泌,从而增强肿瘤细胞的侵袭性[23]。由此可见,UA可能通过介导炎性反应,诱导GC的发生、发展,影响患者的预后。
本研究存在一定的局限性:(1)本研究是单中心回顾性分析;(2)由于条件限制,未进行长期随访,未进行生存分析。综上所述,SUA在GC患者中表达水平升高,并高于PLGC患者,且其表达水平与GC的分化程度相关,故SUA对诊断PLGC及GC具有重要意义。

