胃恶性黑色素瘤一例
程中华 冯 珍 唐 楠 荆佳晨
1 病例资料
患者,女性,67岁,工人。因“腹痛、黑便3周”于2020年4月8日入院。患者入院1周前曾因解黑便就诊于九江市都昌县人民医院,当地行胃镜检查示贲门下缘胃体可见巨大不规则菜花样隆起,病理示胃体恶性肿瘤,淋巴瘤可能性较大,不排除低分化癌,免疫组织化学检测结果示CK(-)、CAM5.2(-)、CD3(-)、CD79a(-)、约45% Ki-67(+),诊断胃体恶性肿瘤伴溃疡,考虑淋巴瘤,建议加做相关抗体及基因检测辅助诊断。患者既往有10年高血压病史,最高可达165/105 mmHg(1 mmHg=0.133 kPa),平时口服氯沙坦钾片,血压控制尚可。患者6年前行胆囊切除术。否认药物过敏史,否认遗传病、肿瘤家族史,无吸烟、饮酒嗜好。查体示:皮肤、球结膜稍苍白,全身皮肤表面无异常黑痣等改变,未触及肿大淋巴结,心肺听诊无特殊,腹软,上腹轻压痛,无反跳痛、未扪及包块,双下肢不肿。
患者入院后行上腹部增强CT检查,结果示:(1)胃底及贲门处胃壁肿块,周围脂肪间歇模糊伴多发肿大坏死淋巴结;(2)胆囊切除术后所见,肝内外胆管扩张;(3)肝右叶小囊肿,右肾小囊肿。见图1。PET-CT示:(1)胃癌,胃周多发淋巴结转移;(2)两侧肺门淋巴结炎性增生,左附件囊肿;(3)左胸壁、下腹壁炎性结节可能,左后颈肌肉生理性摄取可能。4月15号再次复查胃镜示:胃体近贲门口见一直径5 cm新生物,表面坏死,伴污垢及自发性出血(见图2)。复旦大学附属中山医院病理科会诊意见:胃体恶性肿瘤,目前免疫组织化学检测结果未提示B细胞淋巴瘤、神经内分泌肿瘤等来源,建议手术切除后进一步明确类型。免疫组织化学检测结果示CK7(-)、CD20(-)、CD5(-)、Bcl-2(-)、约30% Bcl-6(+)、CD10(+)、约70% Ki-67(+)、Syn(-)、CD56(-)、部分淋巴细胞CD79a(+)、EMA(-)、CD30(-)、原位杂交EBER(-)。患者转入本院外科后于5月5日行手术治疗,术中所见胃体小弯侧近贲门2 cm处一浸润性肿块,约5.0×5.5 cm,质地硬,边界欠清,未侵犯浆膜层,无周围组织浸润,肝脏、结肠、小肠未见占位,肿瘤周围淋巴结明显肿大,脾门部淋巴结融合成团,约3.0×3.6 cm,行胃癌根治术+全胃切除食管空肠Y型吻合术。全胃切除标本病理示:恶性肿瘤,光镜下可见肿瘤细胞呈圆形或不规则形,包浆丰富,嗜酸,核偏位,细胞异型性显著,可见散在分布的黑色素颗粒(见图3A),形态学及免疫表型符合转移性恶性黑色素瘤(MM),肿物大小约5.5×5.0×2.0 cm,溃疡型,伴大片坏死,浸润深肌层外纤维结缔组织;胃小弯处融合结节示MM,大小约5×3×2 cm;脉管内见癌栓,未见明确神经侵犯。食管二次切缘病理示:胃两切缘及大网膜未见肿瘤组织;胃小弯淋巴结未见肿瘤转移,胃小弯另见MM结节1枚,直径约0.5 cm;胃大弯淋巴结未见肿瘤转移。免疫组织化学检测结果示HMB-45(+)、SOX-10(+)、S-100(+)、Melan-A(+)、约80% Ki-67(+)、MPO(-)、Vimentin(+)、核旁点状AE1/AE3(+)、PD-1[克隆系:ZM43,肿瘤细胞(-),间质淋巴细胞(-)],PD-L1[克隆系:SP142,约10%肿瘤细胞(+),约5%间质淋巴细胞(+)]。见图3B~D。术后再次经临床全面细致检查未发现皮肤、肛周黏膜等处黑痣样病变或结节,追问病史发现患者曾在2016年因右侧上眼睑赘生物于当地医院行手术治疗,术后病理示非典型痣。借原眼部手术病理片于华山医院进一步就诊,明确诊断为眼部黑色素瘤。经电话随访,本例患者术后口服伊马替尼行靶向治疗,9月复查腹部增强CT示肝、肺转移,患者于10月死亡。
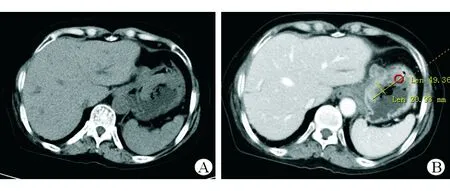
图1 上腹部增强CT检查结果 A 平扫期胃底及贲门处胃壁可见大小约49×21 cm不规则软组织肿块影凸向胃腔 B 增强后可见不均匀强化

图2 胃镜检查结果 A 胃体前壁近贲门口见一直径约5 cm 新生物 B 胃体其余部分及胃窦黏膜光滑
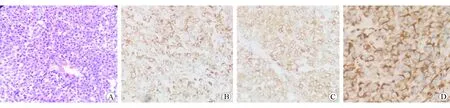
图3 手术大体标本 A 手术大体标本可见散在黑色素颗粒 H-E染色 ×100 B HMB-45表达阳性 免疫组织化学染色 ×400 C Melan-A表达阳性 免疫组织化学染色 ×400 D Vimentin表达阳性 免疫组织化学染色 ×400
2 讨论
MM是发生于黑色素细胞的高度恶性肿瘤,容易发生血行转移和淋巴结转移,临床以皮肤和眼部MM多见,发病危险因素包括遗传、环境、社会经济和职业因素,以及外伤、年龄等。年龄越大,发病率越高。长时间紫外线过度照射被认为是最重要的原因[1]。MM一般经淋巴管和血管转移,多转移至肺、肝、脑、骨等器官,眼和直肠来源的黑色素瘤容易发生肝转移[2],胃肠道转移少见,而小肠因血运丰富成为MM胃肠道转移的常见部位(67%),其次为结肠(9%)、胃(6%)和直肠(2%)。胃肠道MM罕见,且多为转移性,原发性少见,胃肠道MM患者中4%~12%不能发现原发灶[3]。
胃肠道MM临床表现无特异性,早期可无症状,中晚期可出现腹胀、腹痛、反酸、嗳气、恶心、呕吐、消瘦、贫血等不典型症状,甚至合并出血、穿孔、肠梗阻等并发症。因胃肠道MM缺乏特异性的临床表现,且医生对此病缺乏认识,极易被漏诊、误诊,详细的病史询问和仔细的体格检查有助于提高胃肠道MM的诊断率。目前消化内镜检查是发现胃肠道MM的常用方法。胃肠道MM内镜下的表现无特异性。近10年来的报道指出,胃肠道MM内镜下多表现为多发黑色结节样隆起性病变,单发病变非常少见;亦有少部分患者表现为隆起溃疡性病变,易误诊为胃癌或淋巴瘤。组织病理学检查是胃肠道MM诊断和分期的金标准,常规病理H-E染色切片中是否含有黑色素颗粒是诊断MM的指标之一,但40% MM的肿瘤细胞及间质内不含黑色素颗粒。本例患者入院时未提及右眼非典型痣手术史,体格检查结果示全身皮肤未见明显黑痣及肿块,2次胃镜检查结果均显示胃体隆起性肿块,表面有坏死及自发性出血,但镜下均未见明显黑色素颗粒存在,给最初诊断带来困难。免疫组织化学检测主要用于鉴别诊断,S-100、HMB-45、Melan-A、SOX-10及Vimtentin 阳性有助于鉴别胃肠道MM与恶性淋巴瘤或其他胃肠道恶性肿瘤。研究发现,S-100蛋白免疫组织化学染色用于诊断MM的敏感度较高,但特异度较低;HMB-45免疫组织化学染色用于诊断MM的特异度较高,与S-100联合应用可提高对MM的诊断率[4]。Vimentin是黑色素细胞和黑色素瘤细胞所特有的,在鉴别无色素性黑色素瘤与上皮或者神经源性肿瘤方面具有重要意义,也可用于黑色素瘤的辅助诊断。本例患者手术后标本的免疫组织化学染色结果显示S-100、SOX-10、HMB-45、Melan-A和Vimentin均呈阳性表达,诊断为胃肠道MM。原发性胃肠道MM较罕见,需进一步寻找原发病灶。经详细询问病史,高度质疑患者3年前右侧上眼睑手术的非典型痣病理诊断,对该病理切片再次行免疫组织化学检查,最终明确诊断为眼部黑色素瘤术后胃肠道转移。
胃肠道MM转移早、预后差,早期发现、早期治疗是改善预后的关键。早期以手术治疗为主要治疗方法,手术方式为扩大切除。Ahn等[5]发现手术可延长原发性及继发性胃肠道MM患者的生存期。Shenoy等[6]认为姑息性手术可明显缓解胃肠道转移性MM患者症状。对于中晚期患者,术后可联合化学治疗、免疫治疗及靶向治疗。干扰素α+达卡巴嗪常作为黏膜MM的经典术后辅助化学治疗方案。靶向治疗和免疫治疗是目前治疗恶性MM的研究热点。常用的靶向药物包括维罗非尼和伊马替尼。免疫治疗的发展迅速,目前国内已有2种PD-1单抗获批,分别为帕博利株单抗和特瑞普利单抗,均可用于治疗接受全身系统治疗失败的、不可切除或转移性黏膜MM患者[7]。
综上所述,胃肠道MM临床上较为罕见,恶性程度高,病情进展快,患者生存期短,但因缺乏特异性的临床表现,容易误诊、漏诊。临床医生需提高对该病的认识,早诊断、早治疗尤为重要。

