氯化镁和碳/氧自由基捕获剂协同阻化煤自燃的实验研究
王 婕,李 琨,张玉龙,王俊峰,周春山
(1.太原理工大学 安全与应急管理工程学院,山西 太原 030024; 2.山西晋神沙坪煤业有限公司,山西 忻州 034000)
在我国,煤炭自燃现象严重,60%以上的煤矿存在着煤炭自然发火问题。煤在自燃过程中产生大量的污染性气体,对环境产生污染,造成资源严重浪费。同时,由于煤矿井下作业空间狭小,有毒有害气体沿着巷道扩散,对井下作业人员的生命健康安全造成严重威胁[1-2]。因此,针对如何有效防止矿井煤炭自然发火的研究备受关注。
阻化剂在煤自燃防治中被广泛应用,其具有工艺简单、操作方便和阻化效果突出等优点。阻化剂阻燃机理包括:隔氧、吸热、抑制自由基链反应等[3-5]。无机盐类阻化剂是通过在煤表面形成含水液膜,该膜包裹煤体并发挥吸热降温、隔绝氧气的作用,但是单一无机盐类阻化剂的阻化效果会随时间的推移而减弱,在煤自燃后期阻化效果较差[6]。因此,有研究者提出将无机盐类阻化剂与其他阻化剂组合配制成复合阻化剂,旨在实现持续、高效地抑制煤自燃,其中自由基捕获剂受到了广泛的关注。
自由基捕获剂是基于煤自燃过程中自由基反应机理提出的,通过对煤自燃体系中存在的游离自由基进行捕获,抑制自由基链式反应,本质上是终止煤氧化反应过程实现阻化效果[7-9]。许多研究者针对自由基捕获剂抑制煤自燃的效果进行了大量实验[10-12],认为自由基捕获剂可以应用于煤自燃的防治中,并能取得较好的抑制效果。然而,研究者更倾向于将自由基捕获剂以单一化学阻化剂的形式应用于煤自燃防治,缺少将自由基捕获剂与其他类型阻化剂进行复合的实验研究。此外,针对自由基捕获剂的研究主要集中在对煤自燃体系中含氧自由基的捕获能力,缺乏对煤中碳自由基或者其他自由基进行捕获的化学阻化剂的研究,鲜有将碳、氧自由基捕获剂在煤自燃过程中的自由基链式反应进行对比的研究。
笔者将碳、氧自由基捕获剂分别与无机盐类阻化剂组合进行复配,采用热重实验、阻化性能测定实验和红外光谱分析实验,考察2种复合阻化剂抑制行为的差异性,深入探究煤自燃自由基链式反应机制,为煤自燃防治技术的发展提供新技术。
1 实验与方法
1.1 实验材料
实验选择氯化镁作为无机盐类阻化剂代表,选择氧自由基捕获剂2,6-二叔丁基-4-甲基苯酚(BHT)和碳自由基捕获剂N, N-二苄基羟胺(DBHA)进行对比研究[13-14],自由基捕获剂的部分性质参数如表1 所示。
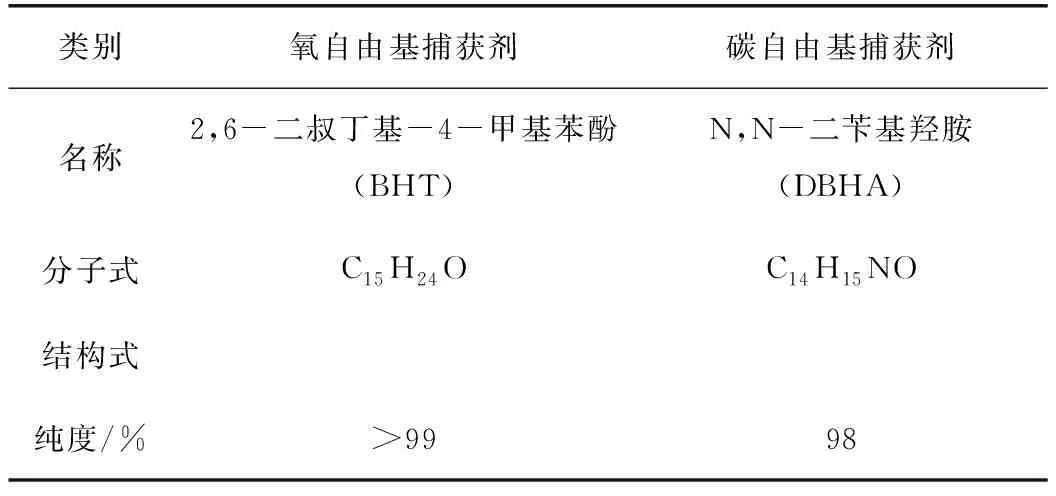
表1 自由基捕获剂的部分性质参数
1.2 实验样品制备
实验煤样为内蒙古锡盟矿褐煤,其变质程度低、易氧化。取新鲜煤样并进行粉碎,筛分出粒径0.30~0.45 mm的煤样,密封低温保存。称取5.0 g MgCl2溶于40 mL水中,制备无机盐类阻化剂,作用于80 g煤样,将此煤样记作M煤;称取BHT和DBHA各0.2 g,分别溶于40 mL无水乙醇中,与无机盐溶液混合后,作用于80 g煤样,所得煤样分别记作MB煤和MD煤。将制备得到的3种煤样,置于低温干燥处浸泡24 h,原煤中加入同等质量清水进行对照。将原煤、M煤、MB煤和MD煤取出后置于真空干燥箱中,在30 ℃下干燥24 h。
1.3 实验过程
1.3.1 热重(TG-DSC)分析实验
实验采用STA-449-F5(NETZSCH,Bavaria,Germany)热分析仪,可以实时测定煤升温氧化过程中热量和质量的变化值,热分析仪如图1所示。

图1 热分析仪
实验称取10.0 mg煤样(0.30~0.45 mm),均匀覆盖氧化铝坩埚底部,并持续通入流速为50 mL/min的干燥空气,设定升温速率为10 K/min,由室温升至700 ℃。
1.3.2 阻化性能测定实验
阻化性能测试采用程序升温氧化系统,包括程序升温装置和气相色谱装置等,实验设备如图2 所示。

图2 程序升温装置
实验称取煤样40.0 g,装入煤样罐,供给流速为 100 mL/min 的干燥空气,以1 ℃/min的升温速率由室温升至 200 ℃,煤体温度每上升10 ℃取1次气样并进行分析和记录。
1.3.3 红外光谱分析实验
红外光谱分析采用Germany Bruker VERTEX 70型原位傅里叶红外光谱仪,如图3所示。

图3 原位傅里叶红外光谱仪
实验以干燥KBr做背景对比图,实验波长扫描区间为4 000~500 cm-1,分辨率为2 cm-1,扫描次数为64次/s。在程序升温条件下,测定煤样特定温度点的红外光谱,温度范围为30~220 ℃,升温速率为1 K/min。
2 实验结果与讨论
2.1 质量变化和热量释放特性
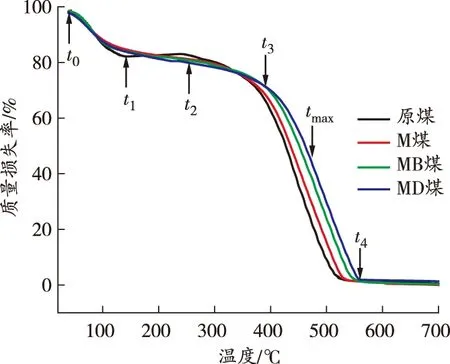
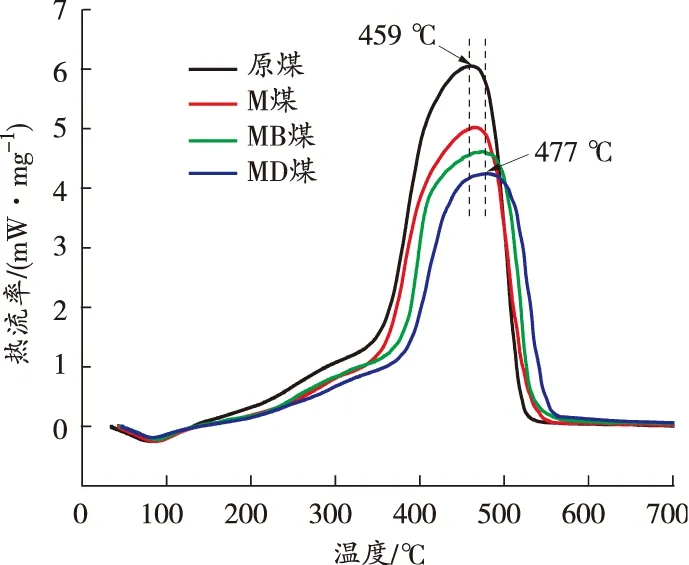
采用TG-DSC热分析技术对升温过程中煤样质量和热量的变化规律进行研究。不同煤样的TG和DSC曲线如图4所示。
(a)煤样质量变化
(b)煤样热量变化
由图4确定了煤样燃烧过程中的5个特征温度点:干裂温度t1、最大质量温度t2、着火温度t3、失重率最大点温度tmax、燃尽温度t4,并将TG曲线划分为4个阶段[15]。实验煤样特征温度点和3种阻化煤样与原煤的失重率差值DW如表2所示。
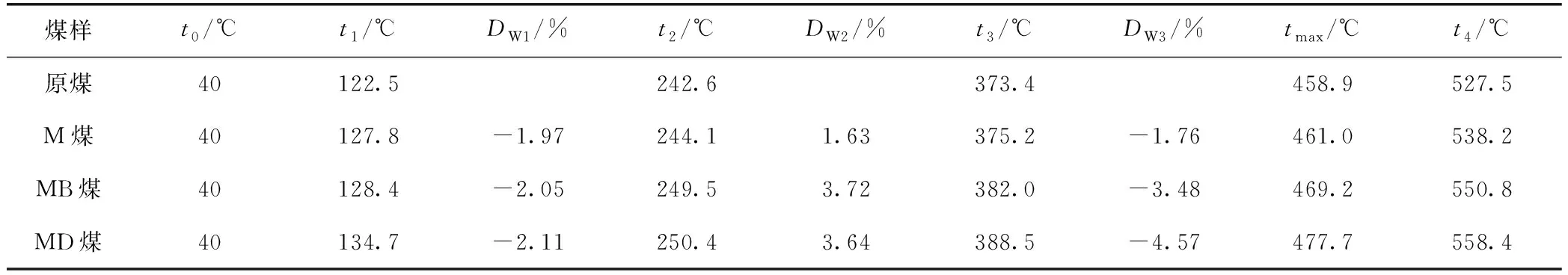
表2 TG曲线特征温度点和煤样失重率差值
由图4和表2可以看出:
t0~t1阶段,原煤TG曲线斜率最大,即质量下降速率最快,DSC曲线上的吸热峰值最大,其他煤样的质量下降速率和吸热量均低于原煤,并且3种阻化剂处理的煤样失重率差值基本一致,吸热量接近,说明此阶段中3种阻化剂对煤样质量的影响主要归因于MgCl2的物理保水作用,而BHT和DBHA在此阶段的阻化作用相对较弱;t1~t2阶段,原煤TG曲线出现上升趋势,而阻化剂处理的煤样的TG曲线均较平缓,失重率差值分别为1.63%、3.72%、3.64%,MB煤和MD煤的失重率差值约为M煤的2倍,且MB煤的失重率差值最大,说明此阶段中自由基捕获剂的抑制作用显著,BHT对煤与氧气化学吸附反应的抑制效果最好;t2~t3阶段,MD煤失重率均低于其他煤样,TG曲线斜率最小,说明MD煤的抑制效果最明显;t3~t4阶段,原煤的放热量最高,MD煤的放热量最低,原煤放热峰值温度点tmax为458.9 ℃,而M煤、MB煤和MD煤的tmax分别推后至461.0、469.2、477.7 ℃,说明此阶段DBHA仍能持续发挥自由基捕获作用,使MD煤的抑制效果突出。
2.2 气相产物释放规律和抑制率对比
煤自燃过程中CO释放量与煤体温度密切相关,常被用作煤自燃指标气体[16-17]。各煤样CO释放量变化情况如图5所示。
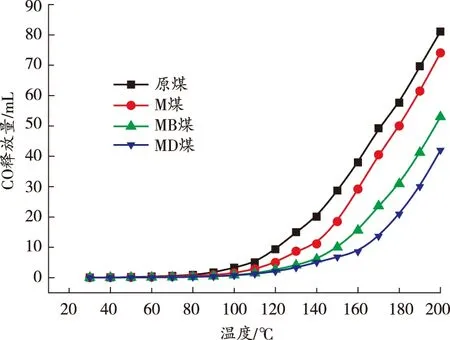
图5 各煤样CO释放量对比图
由图5可知:在80 ℃之前,MgCl2发挥主要物理阻化作用,使阻化煤样的CO释放量均低于原煤;在 80~140 ℃时,原煤和M煤的CO释放量快速增加,而MB煤和MD煤的CO释放量都呈缓慢增加的趋势,曲线斜率小于原煤和M煤;在140 ℃之后,原煤和M煤的CO释放量呈指数趋势上升,而MB煤和MD煤的CO释放量仍呈缓慢增加趋势,并且MD煤的CO释放量最低;在200 ℃时,MD煤的CO释放量约为原煤的50%。原煤CO快速释放特征温度点为110 ℃左右,而其他煤样分别推后了9、18、27 ℃。此外,实验测得原煤的CPT(交叉点温度)为153.2 ℃,而M煤、MB煤和MD煤的CPT较原煤分别增加了5.6、11.1、17.5 ℃。说明DBHA复合阻化剂的协同抑制效果最佳。
将CO产生量作为指标参数计算煤自燃阻化剂的抑制率,可直观反映阻化剂效果。其计算式如下[6]:
(1)
式中:R为阻化剂的抑制率,%;A为原煤在程序升温过程中CO的释放量,mL;B为同等条件下经阻化剂处理的煤样CO的释放量,mL。
各温度点阻化剂处理煤样的抑制率如图6所示。

图6 抑制率随温度变化图
由图6可知,M煤的抑制率以100 ℃为分界点,呈现出先增高后降低的趋势,在100 ℃时达到最大值54.0%,说明MgCl2在100 ℃左右抑制效果最佳;与M煤相比,氧化升温过程中,MB煤抑制率均较高(尤其在100 ℃后),可将其变化趋势分为3个阶段:80 ℃ 之前,抑制率快速增高;80~120 ℃时,抑制率均在60%以上,并呈缓慢增高趋势,120 ℃时达到最大值75.0%,增高速率低于80 ℃之前;120 ℃之后抑制率迅速下降。
此外,MD煤的抑制率变化趋势也可划分为3个阶段:在100 ℃之前抑制率持续上升,100 ℃时达到第1个峰值74.7%;在100~140 ℃时,抑制率呈稳步上升趋势,且均在70.0%以上,在140 ℃时达到第2个峰值75.1%;在140 ℃之后,抑制率缓慢下降。其中第1个峰值出现在100 ℃是由于DBHA与煤中水分子形成分子间氢键,与MgCl2实现协同抑制;第2个峰值出现是由于氧化后期,DBHA仍能捕获煤中多种类型的自由基,持续发挥抑制作用。
2.3 活性官能团变化规律
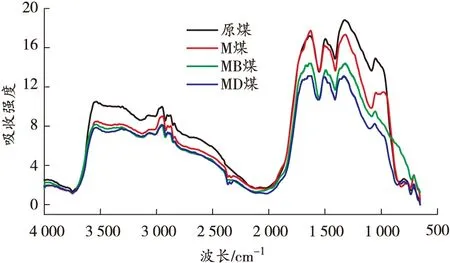
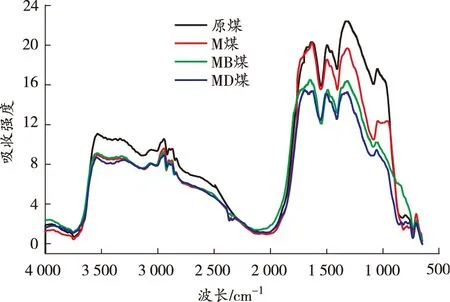
原位傅里叶变换红外光谱是观察煤分子内部微观结构变化最有效的方法[18]。本节主要分析温度和自由基捕获剂对煤中活性基团产生的影响。基于40、80、120、160、200 ℃的红外光谱图,从微观角度对比分析碳、氧自由基捕获剂的抑制作用,得到各温度点煤样的红外光谱图如图7所示。
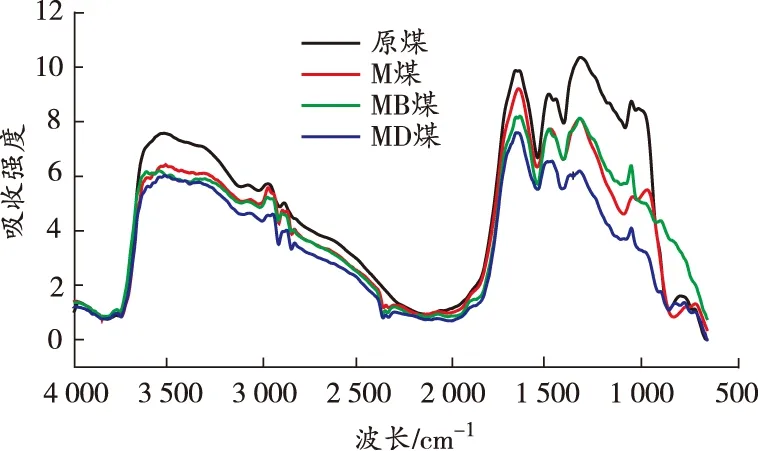
(a)40 ℃
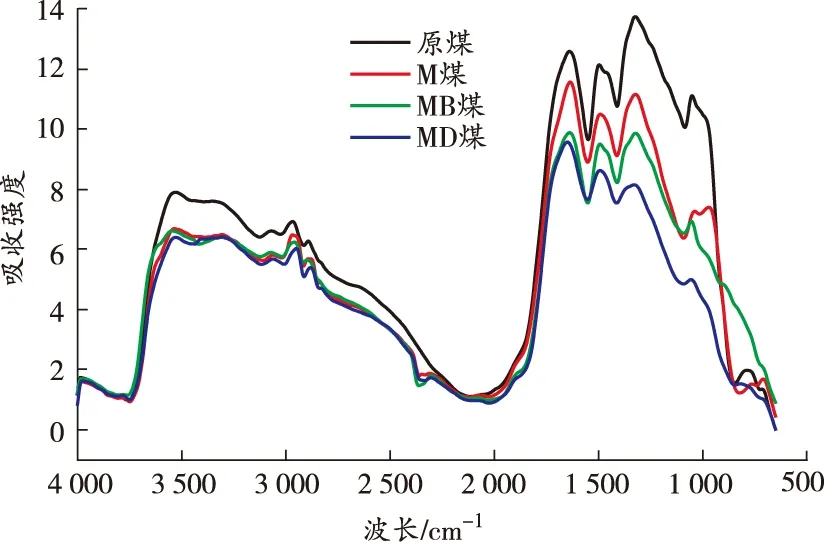
(b)80 ℃
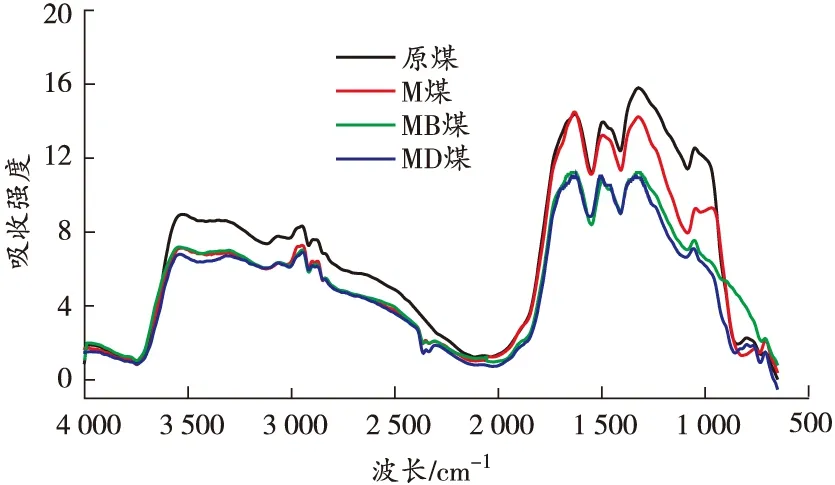
(c)120 ℃
(d)160 ℃
(e)200 ℃
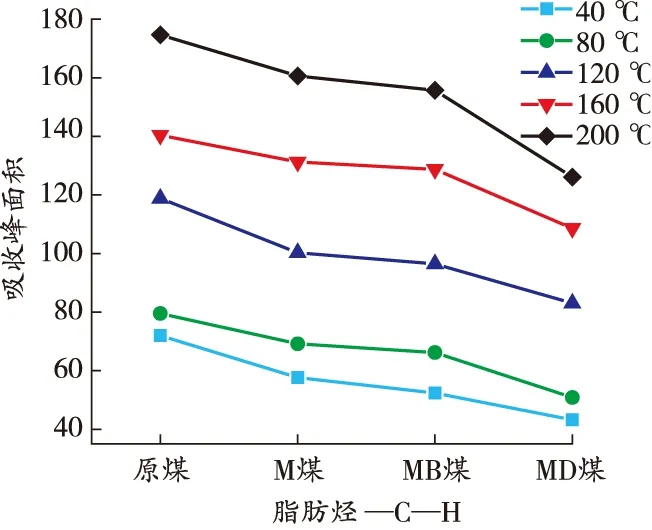
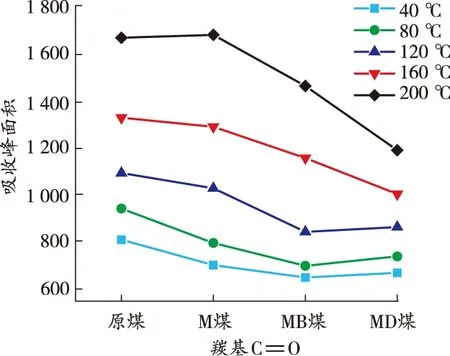
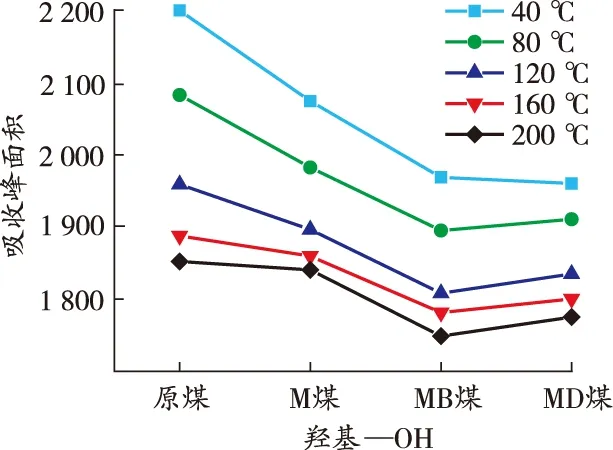
由图7可知:煤样在升温过程中各活性官能团对应的特征吸收峰的高度和强度存在差异,其中羟基、脂肪烃—C—H、芳香烃 CO 变化明显,红外光谱中分别对应为3 700~3 000、3 000~2 800、1 850~1 500 cm-1[19]。利用Peakfit软件计算活性官能团各温度点不同官能团的峰面积,结果如图8 所示。
(c)1 850~1 500 cm-1
(b)3 000~2 800 cm-1
(a)3 700~3 000 cm-1
由图8可知:各煤样羟基数量与温度呈负相关关系。在升温过程中,M煤的羟基含量由明显低于原煤转变为逐渐接近原煤,原因在于MgCl2发挥保水作用,使得煤中水分子以结晶水的形式存在,游离的羟基含量明显减少。整个升温过程中,MB煤的羟基含量始终低于其他煤样,MD煤的羟基含量始终低于原煤和M煤,但略高于MB煤,表明DBHA和BHT对煤中自由基的捕获机理存在差异。
2.4 阻化机理探讨
BHT可以作为电子和氢供体,捕获煤氧化反应中生成的含氧活性自由基,并将自由基转化为相对稳定的化合物,从而终止自由基链式氧化反应[11]。红外分析表明,BHT提供的氢离子能与煤中水分子形成分子间缔合氢键,并捕获煤中游离的羟基和含氧自由基,从而降低羟基活性,减少含羰类化合物的生成量。
DBHA结构中的羟基具有较高的活性,羟基中的H原子容易游离,从而产生含氧的孤电子结构,孤电子在C—N共价键的作用下会发生迁移,从而导致DBHA分子结构有多个吸收位点,可以参与多种自由基反应[13]。红外分析表明,DBHA可与煤中自由基结合生成含羟基官能团的稳定结构,导致了羟基含量的增加。并且在升温过程中DBHA能持续捕获不同类型的自由基,抑制自由基链式反应。
3 结论
1)碳/氧自由基捕获剂与MgCl2形成的复合阻化剂协同抑制效果远高于单一MgCl2阻化剂。与M煤相比,MB煤和MD煤各个阶段的失重率均有明显下降;CO释放量明显降低,CPT和抑制率则明显升高;羟基、羰基和脂肪烃—C—H含量均有所减少。
2)在80~120 ℃时,BHT和MgCl2复合阻化剂的协同抑制效果优于DBHA与MgCl2复合阻化剂。MB煤的增重率和羰基含量略低于MD煤,而抑制率高于MD煤。这说明此阶段,BHT通过释放氢离子对煤氧化反应中产生的含氧活性自由基进行捕获的能力大于DBHA,更有效地抑制了煤中含氧活性自由基的链式反应。
3)相比于BHT,DBHA在氧化反应后期对煤中自由基的捕获能力更强,稳定性更高。在120 ℃之后,MD煤的抑制率均在70%以上,而MB煤的抑制率仅在 100~130 ℃时达到70%以上;在160 ℃以后,MD煤抑制率开始缓慢下降,而MB煤的抑制率在130 ℃开始下降,并且下降速率明显大于MD煤;此外,在170 ℃以后,MD煤中羟基、羰基和脂肪烃—C—H含量仍出现明显的降低趋势。

