基于网络药理及分子对接探讨茵陈五苓散治疗原发性胆汁性胆管炎的作用机制
戚璐 徐俊 许杰 楼汪洲洋 程良斌

摘要 目的:基于網络药理学及分子对接技术探讨茵陈五苓散治疗原发性胆汁性胆管炎(PBC)的潜在作用机制。方法:运用系统药理学数据库和分析平台(TCMSP)检索茵陈五苓散的活性成分和作用靶点。通过GeneCard、OMIM数据库收集疾病靶点。运用Cytoscape3.7.2软件构建化合物-靶点网络。采用R语言进行基因本体(GO)功能富集分析和京都基因与基因组百科全书(KEGG)通路富集分析。将药理网络中的核心活性化合物与法尼醇X受体(FXR)进行分子对接,同时比较推荐的化学药物与FXR的结合活性。结果:化合物-靶点网络筛选出茵陈五苓散核心活性化合物为槲皮素、异鼠李素、β-谷甾醇、阿特匹林A、猪毛蒿、芫花黄素、茵陈黄酮、3β-乙酞氧基苍术酮、二氢槲皮素、去甲氧基茵陈色原酮等。得到GO条目2 189条(P<0.05),KEGG通路富集分析得到155条信号通路(P<0.05)。分子对接结果显示核心活性化合物与FXR亲和力与推荐药物相近。结论:茵陈五苓散对PBC的干预作用的潜在机制可能是槲皮素、异鼠李素、β-谷甾醇、阿特匹林A、猪毛蒿、芫花黄素、茵陈黄酮、3β-乙酞氧基苍术酮、二氢槲皮素、去甲氧基茵陈色原酮等活性化合物通过与FXR结合作用于AKT1、JUN、MAPK1、RELA、IL6、MAPK14、EGFR、ESR1、FOS、CCND1等靶点调节多条信号通路而发挥作用。
关键词 网络药理学;分子对接;茵陈五苓散;原发性胆汁性胆管炎;原发性胆汁性肝硬化
The Mechanism of Yinchen Wuling Powder on Primary Biliary Cholangitis Based
on Network Pharmacology and Molecular Docking
QI Lu1,XU Jun1,XU Jie1,LOU Wangzouyang1,CHENG Liangbin1,2
(1 Clinical College of Traditional Chinese Medicine,Hubei University of Chinese Medicine,Wuhan 430061,China;
2 Department of Hepatology,Hubei Provincial Hospital of Traditional Chinese Medicine,Wuhan 430061,China)
Abstract Objective:To explore the potential mechanism of intervention effect of Yinchen Wuling Powder on primary biliary cholangitis(PBC) based on network pharmacology and molecular docking.Methods:The chemical composition and target of Yinchen Wuling Powder were retrieved by traditional Chinese medicine systems pharmacology(TCMSP).Disease targets were collected by GeneCard and OMIM databases.Cytoscape3.7.2 software was used to construct the compound-target network of medicinal materials.Gene ontology(GO) functional enrichment analysis and Kyoto Encyclopedia of Genes and Genomes(KEGG) pathway enrichment analysis were carried out by R language.The core active compound in the pharmacological network is molecularly docked with the farnesoid X receptor(FXR),and the binding activity of recommended chemical drugs and FXR were compared.Results:The compound-target network screened out the core active compounds of Yinchen Wulingsan as quercetin,isorhamnetin,β-sitosterol,atropirin A,Artemisia serrata,Daphne flavonoids,flavonoids,3β-Beta Phthalooxy atractylone,dihydroquercetin,demethoxy chromogenone,etc.2189 GO entries were obtained(P<0.05),and KEGG pathway enrichment analysis yielded 155 signal pathways(P<0.05).The molecular docking results showed that the affinity of the core active compound and FXR was similar to the recommended drug.Conclusion:The potential mechanism of Yinchen Wuling Powder′s intervention on PBC may be quercetin,isorhamnetin,β-sitosterol,atropyrin A,Artemisia halodendron,Daphne flavonoid,Yinchen flavone,3β-ethylphthalide active compounds such as oxyatractone,dihydroquercetin,and demethoxyl chromogenone can act on AKT1,JUN,MAPK1,RELA,IL6,MAPK14,EGFR,ESR1,FOS,CCND1 and other targets by binding to FXR point adjusts multiple signal pathways to play a role.
Keywords Network Pharmacology; Molecular Docking; Yinchen Wuling Powder; Primary Biliary Cholangitis; Primary Biliary Cirrhosis
中图分类号:R285.6文献标识码:Adoi:10.3969/j.issn.1673-7202.2021.02.005
原发性胆汁性胆管炎又称原发性胆汁性肝硬化(Primary Biliary Cirrhosis,PBC),是一种由自身免疫性疾病引起的慢性非化脓性胆汁淤积性肝病。其发病机制复杂,病程较长。胆汁合成、转运、排泄等异常导致胆汁淤积,是PBC疾病发展的共同病理过程。胆汁酸和其他毒性代谢产物在肝脏或体循环中异常堆积,发为包括PBC在内的胆汁淤积性疾病,引起肝细胞损伤、肝内胆管的炎性反应、肝纤维化,最终发展为肝硬化、肝癌、胆管癌等[1]。
目前,临床仍缺乏特异性高、疗效好、不良反应小的治疗药物。法尼醇X受体(Farnesoid X receptor,FXR)是目前治疗PBC认可度较高的靶标。FXR是一种以胆汁酸为天然配体的核受体,具有抑制胆汁酸合成、降低胆汁酸毒性、促进胆汁酸转运、抗肝纤维化等功能[2]。熊去氧胆酸(Ursodexoxycholicacid,UDCA)和奥贝胆酸(Obeticholic Acid,OCA)是目前被美国食品药品监督管理局(FDA)批准用于治疗PBC的药物[3],也是中华医学会肝病学分会PBC诊断与治疗共识推荐使用的药物[4]。但UDCA、OCA仍存在皮肤瘙痒、乏力、腹痛、皮疹、头晕、关节痛、湿疹、甲状腺功能异常等不良反应,且部分患者应答不佳[5-6]。中药茵陈五苓散是治疗湿热黄疸的经典方剂,临床上广泛用于胆汁淤积的相关病证[7]。本研究基于网络药理及分子对接技术探讨茵陈五苓散治疗PBC的药效物质基础及潜在作用机制,旨在为后期研究提供指导,为临床用药提供参考。
1 材料与方法
1.1 材料 检索茵陈五苓散的活性化合物及靶点运用中药系统药理学数据库和分析平台(TCMSP)(http://tcmspw.com/tcmsp.php)检索茵陈五苓散中各味药材的有效成分。以口服生物利用度(OB)≥30%和類药性(DL)≥0.18为筛选条件。通过TCMSP数据库中的靶点预测功能检索活性化合物的相关靶点。
1.2 方法
1.2.1 构建化合物-靶点药理网络 运用GeneCard数据库(https://www.genecards.org/)、OMIM数据库(https://www.omim.org/),以“primary biliary cirrhosis”作为关键词检索PBC的靶点。疾病靶点与活性化合物靶点取交集后用R语言生成网络文本,载入Cytoscape3.7.2软件对茵陈五苓散的药理网络进行可视化分析。
1.2.2 构建蛋白质相互作用网络 将茵陈五苓散与PBC的交集靶点导入STRING数据库(https://string-db.org/),来源选择人类,以高置性度(0.9)为筛选条件,构建蛋白质相互作用网络(Protein-protein Interaction,PPI)。PPI网络用R语言进行可视化处理。
1.2.3 基因富集分析和通路分析 采用Bioconductor平台(https://www.bioconductor.org/)和R语言ClusterProfiler模块对得到的基因进行GO功能富集分析和KEGG通路分析,将排名前20的通路进行可视化处理。
1.2.4 分子对接分析 从蛋白晶体结构数据库(http://www.rcsb.org)中下载FXR的PDB格式文件(ID:3P89)。运用pymol程序,删除结晶水、杂链及杂原子,加氢后保存为pdb格式,作为对接受体。从TCMSP数据库下载活性化合物mol2格式文件,从PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)下载熊去氧胆酸、奥贝胆酸的sdf格式文件,载入Discovery Studio 3.5 Client程序,加氢后保存为pdb格式。活性化合物、熊去氧胆酸、奥贝胆酸作为对接配体。在Lunix操作系统下,用AutodockTool1.5.6程序,添加原子电荷、分配原子类型后保存为pdbqt格式。
在Lunix操作系统下采用Autodock Vina1.1.2[8]进行分子对接将配体对接。配体设置为柔性,受体设置为刚性。搜寻精度exhaustiveness均设为64,num_modes均设置为20,energy_range均设置为5;格点间距均为1 ;FXR的格点中心为x=126.662,y=158.719,z=105.100;盒子大小为x=60,y=40,z=40;其他参数默认。
2 结果
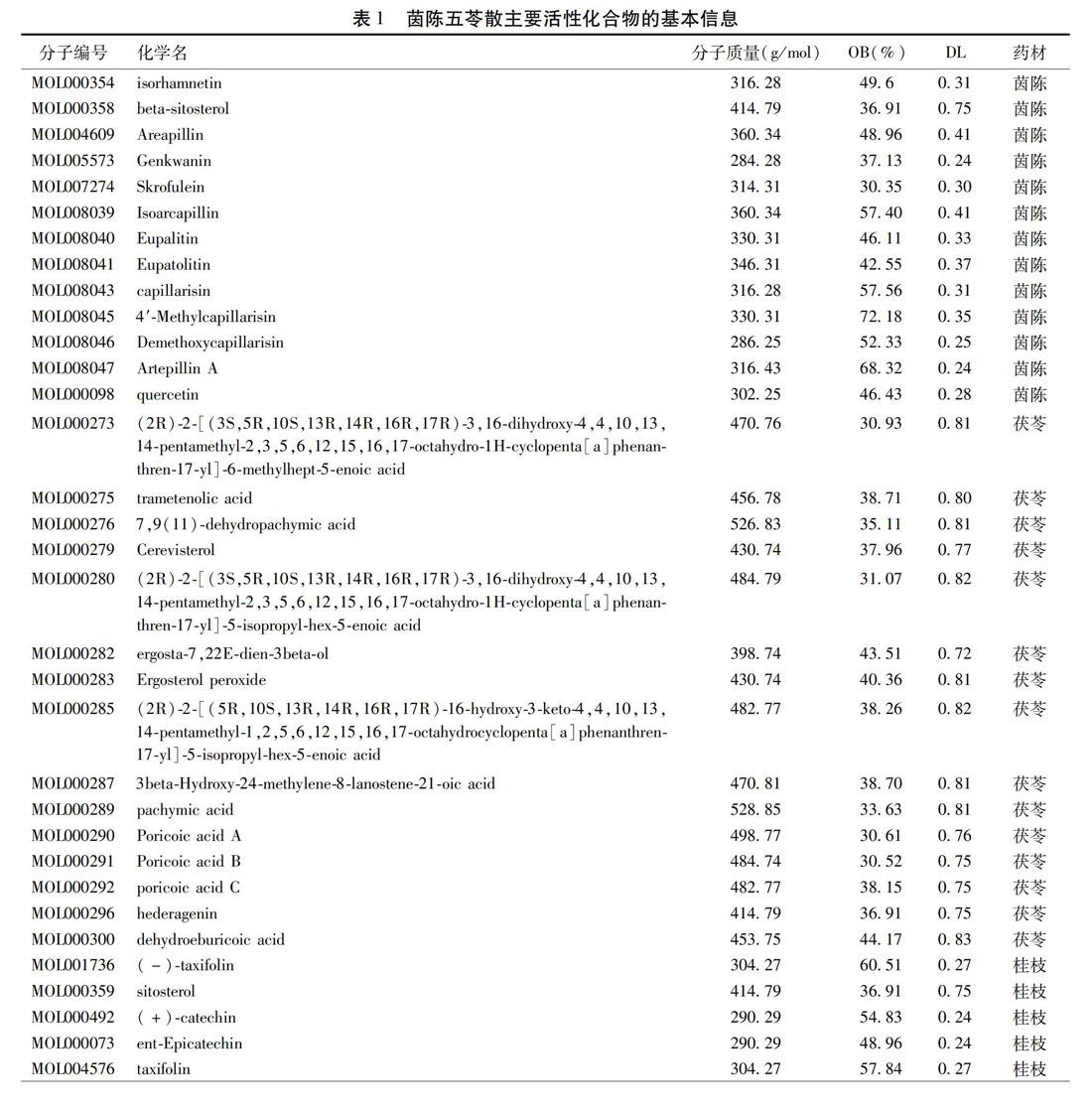
2.1 茵陈五苓散活性化合物及靶点筛选 运用TCMSP数据库检索后,得到符合条件的活性化合物去除重复成分后共有58个,其中茵陈13个,茯苓15个,桂枝6个,白术7个,猪苓8个,泽泻9个。见表1。茵陈有效成分的靶点有368个,茯苓30个,桂枝36个,白术23个,猪苓8个,泽泻6个。去除重复靶点后共169个。
2.2 活性化合物药理网络 检索得到PBC相关靶点2 881个。PBC与活性化合物靶点交集共125个。见图1。建立化合物-靶点网络(共166个节点,其中靶点节点125个,活性化合物节点39个;共430条边,菱形为疾病、方药,六边形为活性化合物,椭圆为靶点。见图2。药理网络拓扑分析,按节点度值、介值中心度值排名,排前10的活性化合物依次为MOL000098(槲皮素)、MOL000354(异鼠李素)、MOL000358(β-谷甾醇)、MOL008047(阿特匹林A)、MOL008040(猪毛蒿)、MOL005573(芫花黄素)、MOL004609(茵陈黄酮)、MOL000049(3β-乙酞氧基苍术酮)、MOL004576(二氢槲皮素)、MOL008046(去甲氧基茵陈色原酮)。
2.3 PPI网络分析结果 PBC与活性化合物靶点交集共40个,导入STRING数据库,得到PPI网络图。见图3。用R语言处理排名前30的靶点,得到barplot函数核心靶点图。见图4。可见,度值排名前10的靶点由高到低依次为AKT1、JUN、MAPK1、RELA、IL6、MAPK14、EGFR、ESR1、FOS、CCND1。
2.4 基因富集分析和通路分析 GO功能富集分析,得到GO(P<0.05)条目2 189条,其中生物过程(BP)2 008条,细胞组成(CC)46条,分子功能(MF)135条。将前20条进行可视化处理。见图5。KEGG通路分析,得到KEGG(P<0.05)条目155条,涉及白细胞介素-17(IL-17)信号通路、肿瘤坏死因子(TNF)信号通路、肝细胞癌相关通路等。见图6。IL-17信号通路涉及GSK3B、RELA、BAX、CASP9、CASP3等基因。TNF信号通路涉及PTGS2、MAPK14、RELA、JUN、CASP3等基因。肝细胞癌相关通路涉及GSK3B、BAX、PRKCA、EGFR、AKT1等基因。
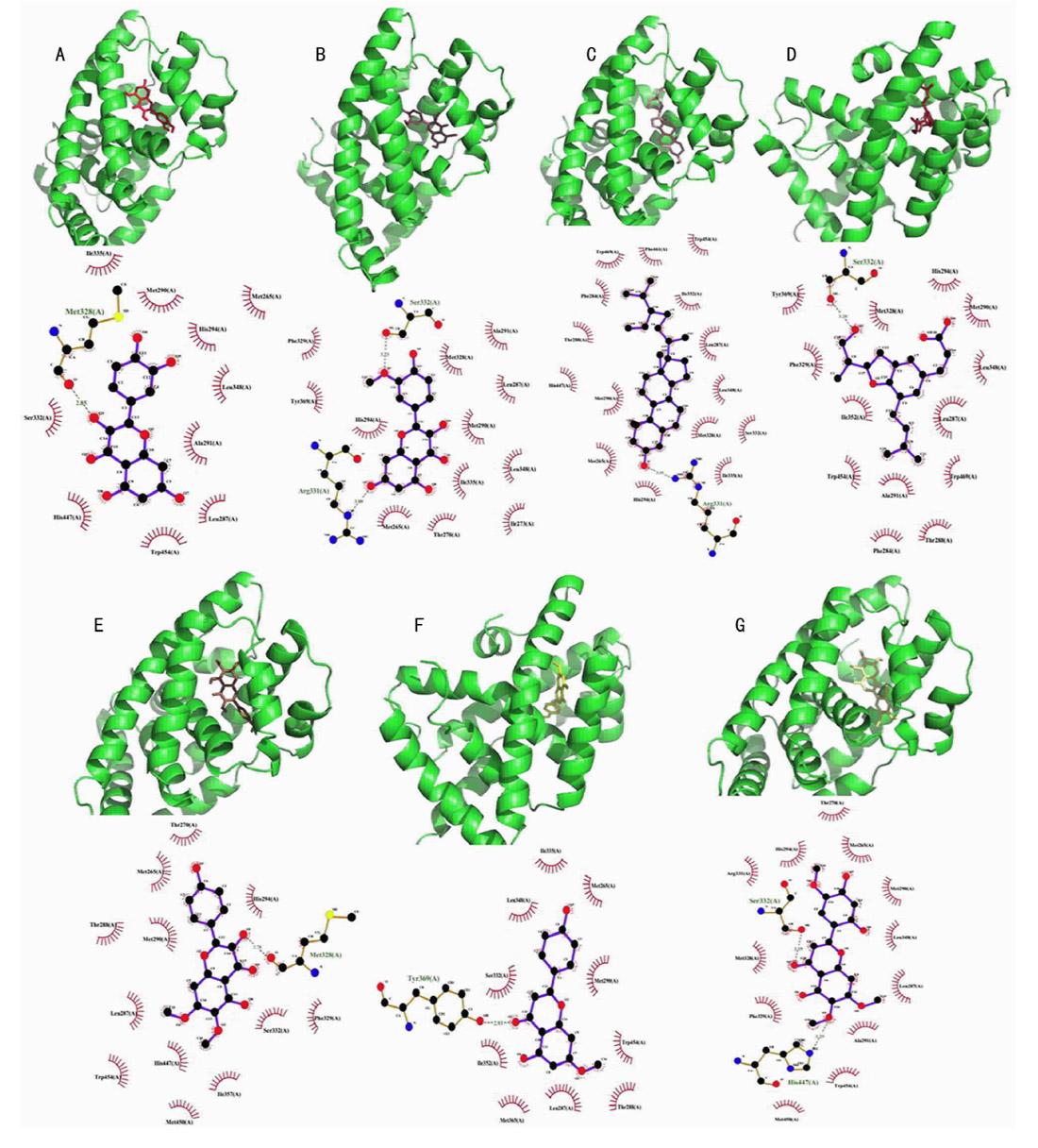
2.5 分子对接分析 一般认为,配体和受体结合能越低,对接活性越大,结构越稳定。取药理网络中的度值和介值中心度值排名前10的活性化合物分别与FXR对接,同时与PBC诊疗与治疗共识推荐使用的化学药UDCA、OCA比较,最低结合能相近。见表2。结合模式分析可见,槲皮素与FXR结合形成疏水作用、1个氢键,形成氢键的氨基酸残基为Met328;异鼠李素与FXR结合形成疏水作用、2个氢键,形成氢键的氨基酸残基为Ser332、Arg331;β-谷甾醇与FXR结合形成疏水作用、1个氢键,形成氢键的氨基酸残基为Arg331。阿特匹林A与FXR结合形成疏水作用、1个氢键,形成氢键的氨基酸残基为Ser332;猪毛蒿与FXR结合形成疏水作用,1个氢键形成,形成氢键的残基为Met328;芫花黄素与FXR结合形成疏水作用、1个氢键,形成氢键的氨基酸残基为Tyr369。茵陈黄酮与FXR形成疏水作用、2个氢键,形成氢键的氨基酸残基有Ser332、His447;3β-乙酞氧基苍术酮与FXR形成疏水作用、1個氢键,形成氢键的氨基酸残基有His447;二氢槲皮素与FXR形成疏水作用、3个氢键,形成氢键的氨基酸残基有Met290、Met328、Ser332。去甲氧基茵陈色原酮与FXR形成疏水作用、6个氢键,形成氢键的残基为Phe284、Thr288、His447、Met328、Ser332、Tyr369。见图7。
3 讨论
PBC是一种慢性肝内胆汁淤积性疾病,以进行性非化脓性中小胆管的破坏为病理特点[9]。临床以乏力、皮肤瘙痒、门静脉高压、黄疸等为主要症状。其发病过程包括胆道上皮细胞免疫耐受损伤,以及相互依赖的胆道损伤、胆汁淤积和进行性肝纤维化[10]。中医学将PBC归属于“黄疸”,中医多以清热解毒、利湿退黄为治疗原则。茵陈五苓散出自《金匮要略》,有利湿退黄之功,由茵陈、泽泻、猪苓、茯苓、白术、桂枝组成,“黄疸病,茵陈五苓散主之”。《温病条辨》云“诸黄疸小便短者,茵陈五苓散主之”。茵陈五苓散治疗黄疸病得到了历代医家的认同。《医宗金鉴》《湿热经纬》《温疫论》《丹溪心法》《景岳全书》《医方集解》《张氏医通》等均有茵陈五苓散治疗黄疸的记载。
本研究以PBC为疾病模型,构建药理网络。从中药材近千种已知化合物中筛选出茵陈五苓散核心化合物为槲皮素、异鼠李素、β-谷甾醇、阿特匹林A、猪毛蒿、芫花黄素、茵陈黄酮、3β-乙酞氧基苍术酮、二氢槲皮素、去甲氧基茵陈色原酮等。PPI网络分析数据显示茵陈五苓散治疗PBC的作用靶点主要为AKT1、JUN、MAPK1、RELA、IL6、MAPK14、EGFR、ESR1、FOS、CCND1等;通路富集分析提示茵陈五苓散治疗PBC的作用机制可能涉及IL-17信号通路、TNF信号通路、肝细胞癌相关通路等。IL-17信号通路、TNF信号通路是机体的炎性反应、免疫应答、细胞凋亡、肿瘤发生等生物学过程的重要通路。IL-17信号通路的激活分泌多种趋化因子和细胞因子,诱导炎性细胞向胆管周围迁移,导致胆管上皮细胞的损伤,最终发展为PBC[11]。TNF信号通路也是参与肝纤维化、肝癌的重要通路[12-13]。
FXR对胆汁酸代谢稳态的调控不仅是PBC发病的一个重要环节,同时也被认为是包括PBC在内的胆汁淤积性疾病治疗的重要靶标[14]。FXR作为胆汁酸的一个主要感应受体,已经成为很多实验性药物研究的重点,并且FXR激动剂OCA已被FDA批准用于治疗PBC[15]。
为了进一步验证茵陈五苓散对PBC治疗作用的药效物质基础,本研究对茵陈五苓散的核心化合物与FXR进行分子对接分析,可见核心活性化合物均能与FXR通过疏水作用、氢键等作用稳定结合。同时推荐使用的化学药物UDCA、OCA与FXR进行对接分析,数据显示茵陈五苓散核心化合物与FXR的结合活性同推荐药物相近。一般认为,结合能越低配体受体结合活性越大,活性化合物作用于该受体的可能性越大。值得一提的是,β-谷甾醇与FXR结合能为-11 kcal/mol,低于UDCA、OCA与FXR的结合自由能,考虑β-谷甾醇对FXR的作用活性不亚于UDCA、OCA。氢键是稳定对接体系的重要作用力。核心活性化合物与FXR结合均有氢键形成。
综上所述,本研究基于网络药理学和分子对接技术从分子水平预测了茵陈五苓散治疗PBC的药效物质基础和潜在作用机制,为后续实验研究提供指导意义,为临床应用本方治疗PBC提供了一定的应用依据。槲皮素、异鼠李素、β-谷甾醇、阿特匹林A、猪毛蒿、芫花黄素、茵陈黄酮、3β-乙酞氧基苍术酮、二氢槲皮素、去甲氧基茵陈色原酮等活性化合物的含量可能可以作为茵陈五苓散治疗PBC质量控制的参考。签于网络药理和分子对接技术的局限性,需设计严格的动物实验及临床试验进一步验证其作用机制。
参考文献
[1]Hirschfield GM,Dyson JK,Alexander G,et al.The British Society of Gastroenterology/UK-PBC primary biliary cholangitis treatment and management guidelines[J].Gut,2018,67(9):1568-1594.
[2]Purohit T,Cappell MS.Primary biliary cirrhosis:Pathophysiology,clinical presentation and therapy[J].World J Hepatol,2015,7(7):926-941.
[3]Goldstein J,Levy C.Novel and emerging therapies for cholestatic liver diseases[J].Liver Int,2018,38(9):1520-1535.
[4]中华医学会肝病学分会.原发性胆汁性肝硬化(又名原发性胆汁性胆管炎)诊断和治疗共识(2015)[J].中华传染病杂志,2016,34(7):385-394.
[5]Samur S,Klebanoff M,Banken R,et al.Long-term clinical impact and cost-effectiveness of obeticholic acid for the treatment of primary biliary cholangitis[J].Hepatology,2017,65(3):920-928.
[6]Corpechot C,Chazouilleres O,Rousseau A,et al.A Placebo-Controlled Trial of Bezafibrate in Primary Biliary Cholangitis[J].N Engl J Med,2018,378(23):2171-2181.
[7]王开霞,郑超,朱晓骏,等.茵陈五苓散治疗胆汁淤积研究进展[J].陕西中医,2019,40(12):1822-1824.
[8]Trott O,Olson AJ.AutoDock Vina:improving the speed and accuracy of docking with a new scoring function,efficient optimization,and multithreading[J].J Comput Chem,2010,31(2):455-461.
[9]Ronca V,Mancuso C,Milani C,et al.Immune system and cholangiocytes:A puzzling affair in primary biliary cholangitis[J/OL].J Leukoc Biol,2020.
[10]Gulamhusein AF,Hirschfield GM.Primary biliary cholangitis:pathogenesis and therapeutic opportunities[J].Nat Rev Gastroenterol Hepatol,2020,17(2):93-110.
[11]余盼攀,张胜初,张启瑜.IL-17及其受体与肝脏疾病的关系[J].肝胆胰外科杂志,2011,23(3):262-265.
[12]姚蓉蓉,王艳红.肝细胞肝癌免疫微环境的研究进展[J].中国临床医学,2014,21(4):487-496.
[13]黃萃园,张洪,白瑞丹.细胞因子基因多态性与肝纤维化发展关系的研究进展[J].中国医院药学杂志,2016,36(16):1425-1430.
[14]Santiago P,Scheinberg AR,Levy C.Cholestatic liver diseases:new targets,new therapies[J].Therap Adv Gastroenterol,2018,11:1-15.
[15]Floreani A,Mangini C.Primary biliary cholangitis:Old and novel therapy[J].Eur J Intern Med,2018,47:1-5.
(2020-05-06收稿 责任编辑:芮莉莉)
基金项目:国家中医药管理局资助项目(JDZX2015179)
作者简介:戚璐(1986.03—),女,博士研究生,主治医师,研究方向:中医药防治肝病的研究,Tel:(027)88739570,E-mail:550294523@qq.com
通信作者:程良斌(1966.04—),男,博士,主任医师,博士研究生导师,研究方向:中医药防治肝病的研究,Tel:(027)88739570,E-mail:18971241243@163.com

