臭氧氧化有机小分子反应研究进展
徐仁杰,寿成伟,夏颖帆,蒋成君
(1.浙江科技学院生物与化学工程学院,杭州 310029;2.内蒙古恒业成有机硅有限公司,内蒙古 乌海 016000)
氧化反应是合成化学的基本反应之一,广泛地应用于医药、农药等精细化工产品的生产[1]。常用的氧化剂有高氯酸、高锰酸、重铬酸及其盐类化合物,还包括双氧水、过氧化钠等,这些氧化剂大多都会产生大量有毒废物,带来严重的环境污染。臭氧氧化技术采用臭氧作为氧化剂,具有高效、环保、清洁的特点,在反应结束后可以自行分解不产生残留和严重的三废污染问题,符合当今绿色化学、清洁生产的发展要求[2]。
臭氧在常温下是一种有特殊臭味的淡蓝色气体,可自行分解为氧气。其热分解为双原子氧,释放出143 kJ/mol的能量。O3分子中1个中心氧原子以sp2杂化与其他2个氧原子相结合形成三角形分子,键角为116.8°,分子中还存在三原子四电子非定域π键垂直于分子平面,O-O键距离为0.127 8 nm,表现出了相当大的双键特征[3]。臭氧的体积很小,但它却是一种难以用量子化学研究的分子,主要是由于臭氧价电子的广泛离域性。
本文叙述臭氧氧化有机小分子方面的研究进展,并对其进行总结和展望,以期对臭氧氧化有机小分子有更深入的了解,为臭氧氧化技术在有机合成领域的应用拓展提供理论基础。
1 臭氧与碳氢化合物反应
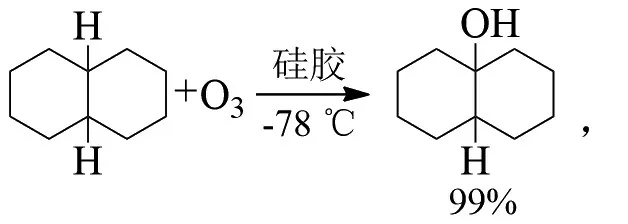
用臭氧氧化顺式和反式十氢萘可以生成双环[4,4,0]癸烷-9-醇。PRYOR等发现,臭氧对甲基和亚甲基具有一定的进攻作用,特别是对苯基位置的甲基和亚甲基[4]。在异丙苯的臭氧化反应中,当温度加热到室温时,异丙苯会生成三氧化异丙苯,进一步生成二甲基苯甲醇:
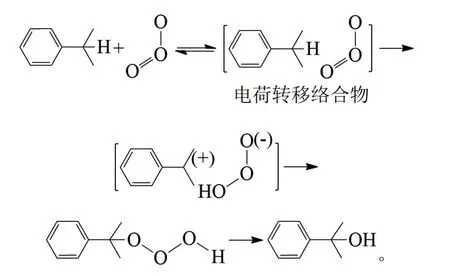
CERKOVNIK等对异丙苯的臭氧化进行了更深入的研究,通过核磁共振证明了异丙苯臭氧化的产物中有三氧化二氢(HOOOH)和异丙苯臭氧化物的存在,认为异丙苯臭氧化物的形成与自由基机理有关,自由基(HOOO·)从异丙苯基自由基中得到氢原子形成HOOOH[5]:
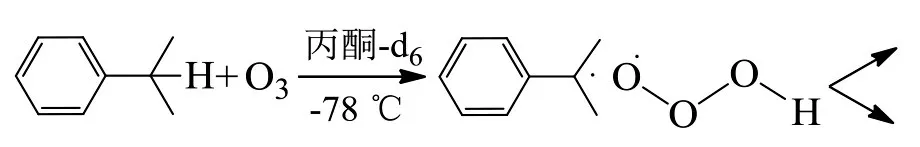
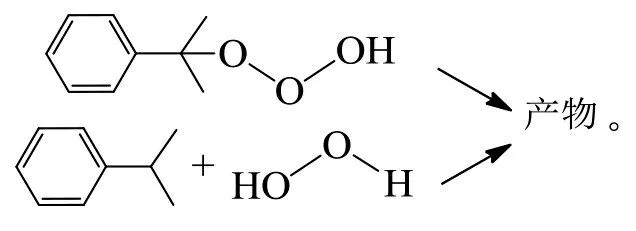
OLAH等认为在强酸性介质中进行碳氢化合物的臭氧化时,质子化的臭氧会触发亲电取代[6-7]:
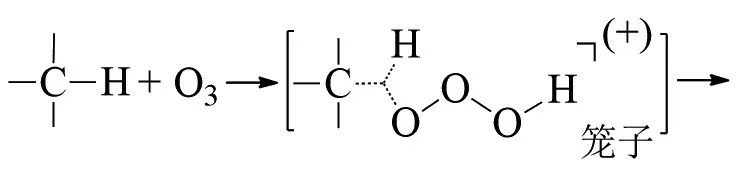
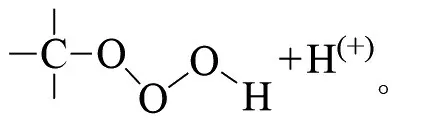
MAZUR等在-78℃,用质量分数4.5%的臭氧氧化具有叔碳原子的衍生物,发现产物中叔醇的收率很高[8]。这种方法通常适用于环状饱和烃:
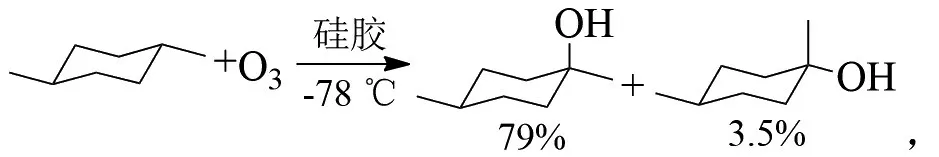


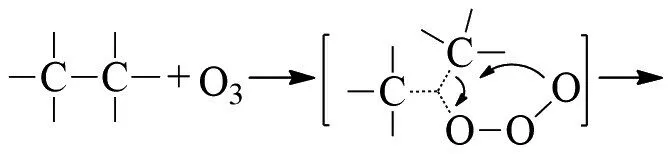
C-C键在-45℃硅胶上发生臭氧化,则裂解成酮:
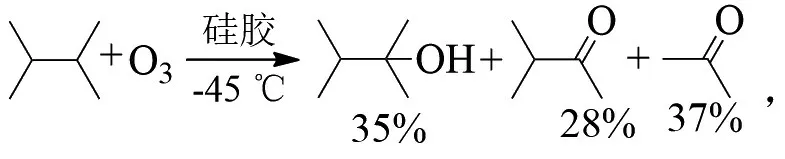
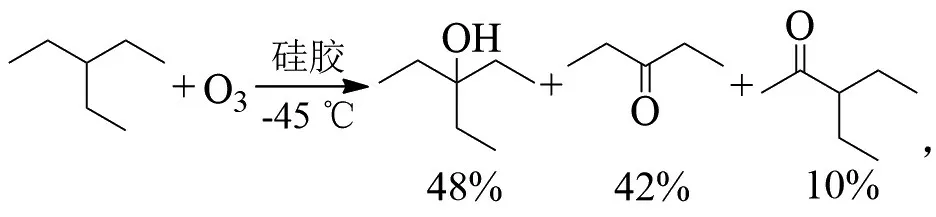
温度对产物比例有影响,在3-甲基戊烷的臭氧化反应中,随着温度升高,酮的比例逐渐增加:

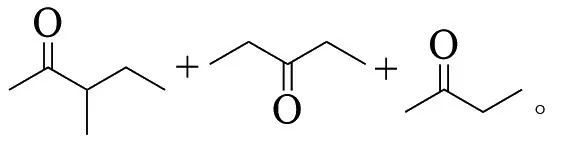
新戊烷在这些条件下不被氧化,MAZUR解释C-C键的断裂是臭氧的亲电攻击,然后是碳的分子内移动[9]:
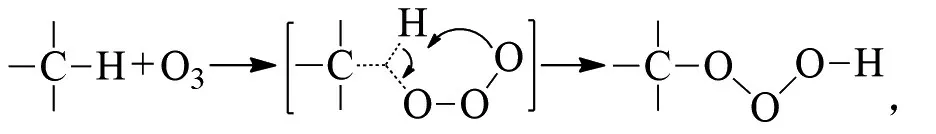
RINDONE等报道了环癸烷和环十二烷的臭氧化反应得到59%环烷酮和6%的环烷醇(转化率96%)[10]:

MEIJÈRE等提出,臭氧化也适用于α-位环丙基烃的官能化,生成环丙基烷基酮。此外,α位氧化成环丙基优于叔位的羟基化[11]:
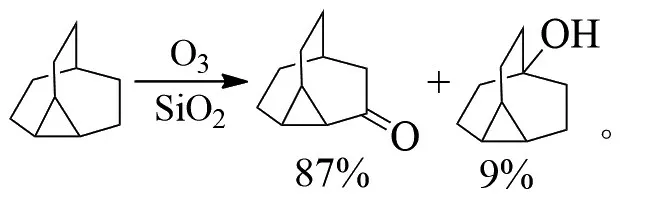
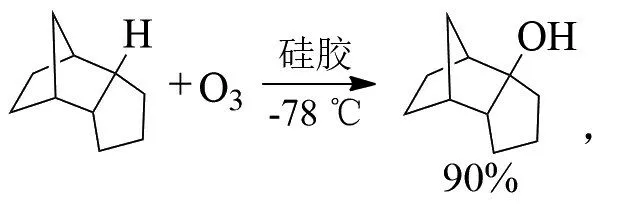
AVZYANOVA等在-90℃下臭氧氧化金刚烷,得到了非常有选择性的金刚烷-1-醇[12]:


MAZUR等通过C25-H前体的区域选择性羟基化实现了在1-α,25-二羟基维生素D3合成的过程中合成C25-OH中间体(收率51%,转化率11%)[13]:

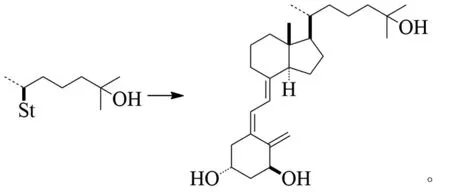
这对于失活C-H键的羟基化很有指导意义。不饱和化合物的双键在溴化的保护下,也可使用该方法。
夏士朋等提出了臭氧氧化对硝基甲苯制备对硝基苯甲酸的新工艺,收率高达93%[14]:

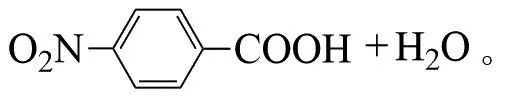
通过臭氧与碳氢化合物的反应可以得到一些相应的醇,酮等化合物,这些化合物通过常规的方法很难合成。
2 臭氧与烯烃反应
德国化学家SCHÖNBOIN首次对臭氧与烯烃等有机物的反应进行了研究。在此基础上HARRIES等进行了更为广泛深入的研究,发现了著名的HARRIES臭氧化反应。该反应是将臭氧气流通入含烯烃的溶液中,烯烃在臭氧的作用下,其双键从中间断裂,同时生成2个羰基化合物。随后在硫化合物等还原剂的作用下可以得到羰基化合物(Me为甲基):
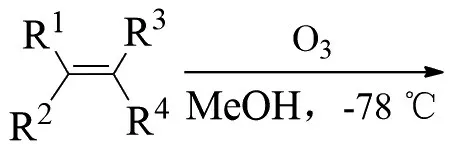
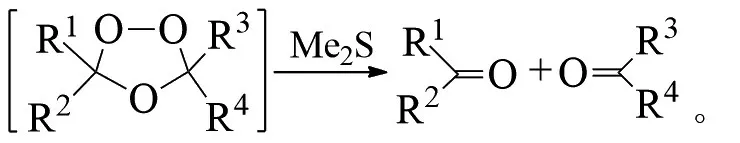
德国化学家CRIEGEE提出了3步反应机理:1)臭氧先对烯烃进行1,3-偶极环加成得到一级臭氧化物;2)重排得到两性离子过氧化物;3)再一次1,3-偶极环加成生成最终的臭氧化物。反应式为:

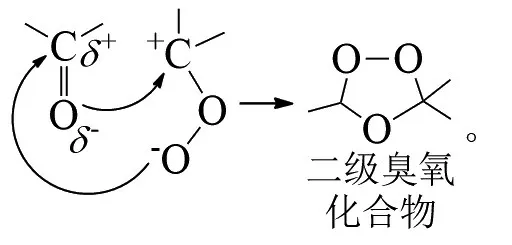
臭氧的高活性导致各种不同的反应路径相互竞争,其分解机理的仍然不明确[15]。BAILEY等根据大量的实验结果提出,初始协同的1,3-偶极环加成步骤决定了一级臭氧化合物的立体化学特性;E-烯烃形成具有双轴向或双横向取代基的反式-一级臭氧化合物,而Z-烯烃形成具有轴向和横向取代基的顺式-一级臭氧化合物[16]。CREMER采用从头算理论计算了烯烃臭氧化反应的整个历程,提出反应的立体选择性主要是由环上的取代基与取代基之间、偶极与偶极之间、取代基与环之间的相互作用来决定的[17]。
STORY提出了其他机理,作为烯烃臭氧化反应的重要中间体,羰基氧化物在羰基的加成反应中一般会发生不同程度的二聚和多聚。随着亲偶极体(如酮)的活性逐渐降低,羰基氧化物可直接被亲核试剂捕获,反应不产生二级臭氧化物和其他过氧化物[18-20]。例如通过内部捕获臭氧分解桦树还原芳香族化合物而产生的羰基氧化物,合成了三环双螺氧基缩酮(X为OH或OOH、OMe):
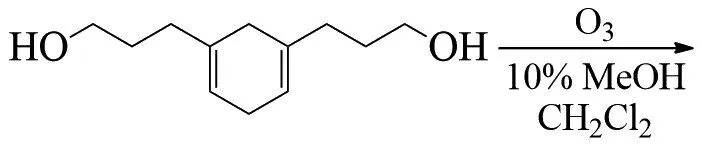
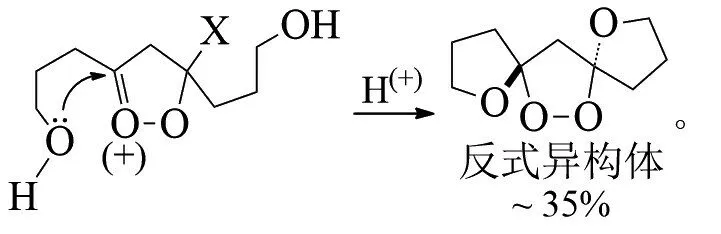
RIVA等在合成香豆素-8-卡巴醛的过程的最后一步使用了臭氧氧化体系,在含有过量聚合物负载的硫脲卧式填充床上进行臭氧化合物的还原,得到醛类化合物收率达92%[21-22]:

艾买提江·萨伍提等以油酸甲酯为原料,用臭氧氧化法制备壬二酸单甲酯(产物收率达78%以上,纯度高达96%)[23]:

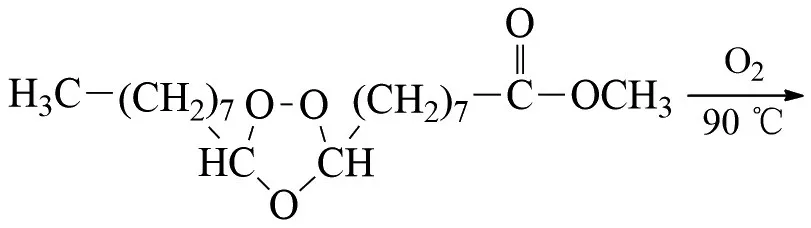
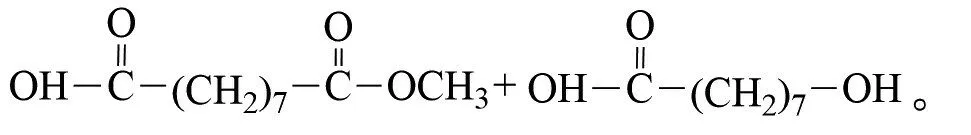
臭氧氧化烯烃是一种非常好的酮类化合物的合成方法,在工业上是有较大的应用价值。
3 臭氧与醇反应
PLESNIČAR等在低温下用臭氧氧化仲醇(如异丙醇),得到了相应的臭氧化物。温度升高,三氧化二氢(HOOOH)会分解为其他多种产物(t-BuOMe为甲基叔丁基醚)[24]:
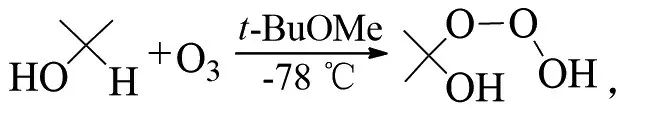
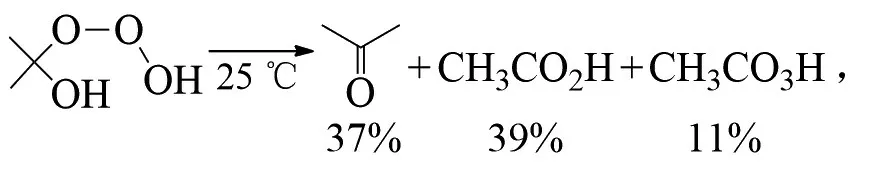
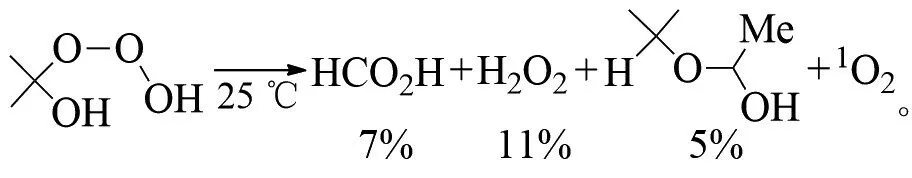
ABDRAKHMANOVA等在-70℃下,以CFCl3为溶剂,用臭氧氧化外-双环[2,2,1]庚烷-2-醇,得到了相应的臭氧化物。当温度升至室温后,分解为双环[2,2,1]庚烷-2-酮和氧气[25]:

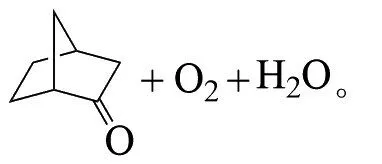
臭氧氧化醇可以得到相应的酮,醛或酸,避免了重铬酸钾等氧化所带来的污染问题。
4 臭氧与醚反应
PRICE等用臭氧氧化仲醚,生成相应的臭氧化物。臭氧氧化仲醚的第一步是将臭氧插入氧原子旁边的C-H键[26]:

ERICKSON等在-78℃下臭氧化纯二异丙醚,随后将所得混合物加热到室温,得到3种产物,丙酮、异丙醇和乙酸异丙酯(摩尔比1:1.3:2.7)[27]:
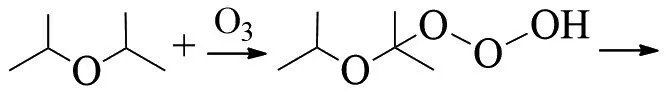

结果可以通过臭氧化物的周环分解机理来解释:
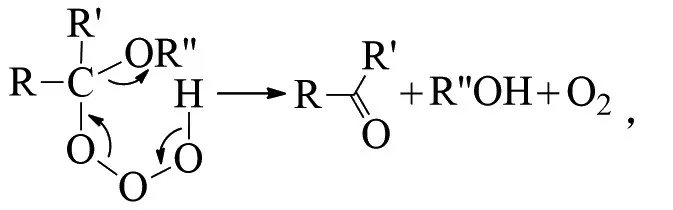

PLESNIČAR等提出从甲基α-甲基苄醚或α-甲基苄醇中提取的臭氧化物,是通过氢键自身缔合产生的(R为H或Me,Ph为苯基):



随后,PLESNIČAR等又对这一观点进行了修正。即便不能完全排除臭氧化物的非自由基(“周环”)分解路径,但有证据支持RO-OOH键断裂和随后的笼型自由基对歧化。
臭氧氧化醚可以得到相应的醇或酮,常规的氧化反应难以实现这一过程。
5 臭氧与醛反应
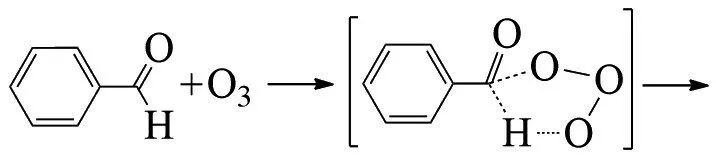
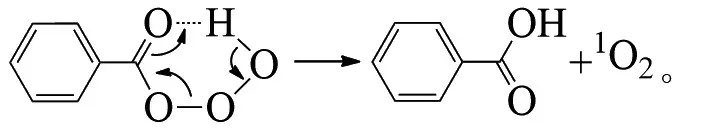
PLESNIČAR等在低温下臭氧氧化苯甲醛,首先臭氧1,3偶极体插入到醛的C-H键中,然后所产生的臭氧化物发生分子内氢转移迅速分解,生成苯甲酸和单线态氧[28]:
HOCKING等认为在DAKIN反应中应该加入一种臭氧化物中间体。他们发现过氧化氢的反应为1、4级,而酮的反应为1级。在非常温和的条件下,即可实现臭氧氧化醛得到酸[29]。
6 总结与展望
目前,臭氧在化工氧化方面存在如下问题:1)臭氧含量过低,传统电解技术制备的臭氧的质量分数只能达到20%;2)反应产物中如何将未反应的臭氧/氧气与液相物料分开;3)臭氧的在线检测设备等有待于进一步研究;4)臭氧化合物的不稳定导致很难用仪器检测其结构,一些反应的机理尚不明确。
臭氧的强氧化能力很容易打断烯烃等有机物的碳键结合键,使其部分氧化后再组成新的化合物。目前,作为一种绿色清洁的氧化技术,臭氧氧化并不仅仅局限于处理有机废水,在有机合成过程中也逐渐趋于成熟,并且在香料、香精、制药等行业上得到很大规模应用。如在生产培南类抗生素中间体4-乙酰氧基氮杂环丁酮的过程中就大规模的使用了臭氧氧化技术。臭氧氧化处理废水所使用的是含低含量臭氧的空气或氧气,臭氧生产的效率的不足是制约其在有机合成中应用的原因之一。臭氧氧化以产生自由基等活性中间体来强化臭氧化,自由基很难通过常规的方法检测,基础研究薄弱。对臭氧基础理论进行研究是解决其大规模应用的途径之一。

