谷子MYB-CC基因家族的鉴定与表达分析
李明明,晋敏姗,胡海斌,王 浩,于港华,邢国芳
(山西农业大学农学院,太谷 030801)
植物转录因子MYB(v-myb avian myeloblastosis viral oncogene homolog)是近年来发现的一类与调控植物生长发育、生理代谢、细胞的形态和模式建成等生理过程有关的一类转录因子,在植物中普遍存在,同时也是植物中最大的转录因子家族之一。MYB转录因子在植物的代谢和调控中发挥重要作用。磷饥饿响应蛋白1(phosphate starvation response1,PHR1)具有MYB和CC(coiled-coil)结构域,被定义为MYB-CC家族。据报道,这个家族的另外两个成员也与磷胁迫有关[1-2]。拟南芥(Arabidopsis thaliana)中的AtPHR1是第一个在维管植物中分离的参与低磷胁迫转录调控的MYB超级家族转录因子,其本身不受外界磷水平的调控。MYB62是另外一个MYB超家族转录因子,参与低磷胁迫转录调控。MYB62与PHR1都是具有R2R3结构域的MYB转录因子,在低磷胁迫下都能被诱导。与PHR1不同的是,MYB62在低磷胁迫下的诱导具有特异性,AtMYB62在根中的表达量很低,但在苗期叶片中的表达受缺磷诱导[3-4]。当植株恢复供磷时,AtMYB62的表达量迅速下降,过表达 AtMYB62植株会表现出与缺磷条件下相似的反应,如主根生长受到抑制,花青素大量积累,根系酸性磷酸酶活性增加等。研究表明,AtMYB62可能通过调控赤霉素生物合成途径中的基因表达来影响植物体内赤霉素的浓度,进而调节植物对低磷的响应[4]。Ren等[5]和Zhang等[6]在甘蓝型油菜(Brassica napusL.)中克隆了拟南芥的AtPHR1同源基因,并将其命名为BnPHR1。他们的分析表明:BnPHR1主要在根系中表达,其表达水平受外界磷水平的调控;在拟南芥和油菜中过表达BnPHR1显著提高了高亲和磷转运蛋白AtPT2及BnPT2 的表达水平。MYB-CC基因家族的鉴定与分析是进一步研究MYB-CC基因功能和明确其在植物生长发育过程中作用的重要基础。谷子(Setaria italica)作为禾本科狗尾草属的主要物种,其基础和相关应用研究已经引起广泛重视,但是截至目前,谷子MYB-CC转录因子家族成员仍未进行系统的鉴定。
谷子属于禾本科狗尾草属二倍体(2n=2x=18)自花授粉一年生草本植物,起源于我国的传统优势作物,也是粮饲兼用作物。谷子去壳后的小米是我国北方的重要粮食作物,学名为粟,小米营养丰富且各种成分均衡,具有很高的营养保健价值,在我们国家被列为“五谷”之首[7-8]。谷子基因组测序计划已经完成,其具有较小的二倍体基因组(500 Mb),具C4光合作用,且能够在旱地栽培[9-10]。这使得谷子迅速发展成为C4光合作用和植物耐旱抗逆分子机理研究的模式植物[11-12]。
本研究利用生物信息学数据库和分析软件对谷子的MYB-CC基因家族的组成进行了预测,并对谷子MYB-CC基因家族成员的蛋白理化性质、染色体分布、基因结构、保守基序、启动子和基因表达等进行分析,旨在为进一步鉴定和克隆谷子耐低磷基因、挖掘相关耐低磷基因资源奠定理论基础。
1 材料与方法
1.1 试验材料
谷子的全基因组数据、蛋白质序列均来自于Phytozome数据库(https://phytozome.jgi.doe.gov/pz/portal.html),拟南芥MYB-CC基因的蛋白序列来自TAIR数据库(https://www.arabidopsis.org/)。
1.2 谷子MYB-CC基因家族的鉴定及蛋白质基本理化性质分析
从Phytozome数据库中获取已报道的玉米MYB-CC基因的蛋白序列[13],登陆Pfam数据库(http://pfam.sanger.ac.uk)下载该基因隐马尔科夫模型文件MYB-CC_LHEQLE结构域(PF14379),把该文件提交至TBtools软件的Simple HMM Search,将得到的所有谷子、拟南芥和水稻基因的蛋白序列提交到NCBI(https://www.ncbi.nlm.nih.gov/Structure/bwrpsb/bwrpsb.cgi)和HMMER(https://www.ebi.ac.uk/Tools/hmmer/)进行结构域验证,除去无MYBCC典型结构域、结构域不完整和冗余序列后,最终获取到谷子的18个MYB-CC基因、拟南芥的12个MYB-CC基因和水稻的16个MYB-CC基因。利用ExPASY-ComputepI/Mw 在线软件(https://web.expasy.org/compute_pi/)和 ExPASY-ProtParam (https://web.expasy.org/protparam/)分析谷子MYB-CC基因的蛋白质序列的等电点、相对分子质量、不稳定系数、脂肪系数。利用在线软件SOPMA对MYB-CC基因单条序列α-螺旋、β-折叠、延伸链等二级结构进行预测。通过在线软件ProtComp 9.0(http://linux1.softberry.com/berry.phtml?group=programs&subgroup=proloc&to pic=protcomppl)和SignalIP5.0(http://www.cbs.dtu.dk/services/SignalP/)对谷子的MYB-CC的蛋白质序列进行亚细胞定位及信号肽预测。
1.3 谷子MYB-CC基因家族染色体定位和系统进化树的构建
从谷子基因组数据库(V12.1,https://phytozome.jgi.doe.gov/pz/portal.html)中获取谷子MYB-CC基因的染色体位置信息,利用TBtools工具对谷子MYBCC基因的染色体定位进行可视化分析,绘制染色体分布图。以Cluatal X2软件[14]对谷子、拟南芥、水稻MYB-CC基因的蛋白质序列进行多重序列比对,并在MEGA 5.0软件[15]中以Neighbor-Joining方法构建系统发育树(Bootstrap replications数目设置为1 000)。
1.4 谷子MYB-CC基因家族基因结构和保守基序分析
通过在线软件MEME(http://meme-suite.org/tools/meme)[16]分析谷子MYB-CC蛋白的motif组成,最大保守序列鉴定数目设置为6。利用TBtools工具绘制谷子MYB-CC基因家族的进化树、基因结构和保守基序联合分析图。
1.5 谷子MYB-CC基因家族顺式作用调控元件分析
以谷子全基因组数据库为基础,利用TBtools工具获取谷子MYB-CC基因上游2 000 bp的启动子序列,然后提交至PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)[17],进行顺式作用调控元件统计分析。
1.6 谷子MYB-CC基因家族基因表达分析
为了分析谷子MYB-CC基因的组织表达特异性,本研究从本实验室小米基因组网站(http://foxtail-millet.biocloud.net/home)获得不同组织的基因表达量值并进行汇总,最后利用TBtools工具绘制基因表达热图。
1.7 基因的荧光定量表达分析
使用RNAiso Plus提取RNA,用 Takara 的反转录试剂盒合成 cDNA第1条链, 以各样品的cDNA为模板,浓度统一稀释为200 ng/µL, 进行实时荧光定量PCR(quantitative real-time polymerase chain reaction,qRT-PCR)扩增,EF1a为内参基因[18],利用Primer Premier 5.0软件设计荧光定量PCR引物(表1)。反应体系为10.0 µL,包含5.0 µL TB Green Premix Ex Taq II、3.6 µL ddH2O、正反向引物各0.2 µL、1.0 µL cDNA。反应条件为:95℃预变性2 min,95℃变性10 s,60℃退火20 s,72℃延伸20 s,40个循环。采用2–ΔΔCt法计算基因的相对表达量[19]。
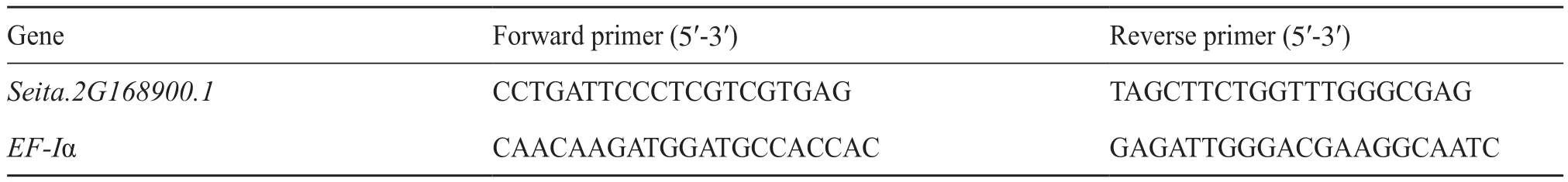
表1 定量PCR引物Tab.1 The primer sequences for qRT PCR
1.8 谷子MYB-CC基因的共线性及选择压力分析
使用TBtools工具的多个子程序,采用默认参数来分析3个物种MYB-CC基因之间的共线性关系。获得谷子、水稻和玉米MYB-CC基因的共线性对基因,使用TBtools软件的ka/ks Calculator程序对共线性基因进行非同义替换(non-synonymous substitution,ka)和同义替换(synonymous substitution,ks)分析[20]。
2 结果与分析
2.1 谷子MYB-CC基因家族的序列鉴定及理化性质分析
根据基因在谷子染色体上的定位情况,将其分别依次命名为SiMYB-CC1~SiMYB-CC18(图1)。这些基因分布在7条不同染色体上,其中2号染色体上最多(4个),7号染色体上最少(1个)。
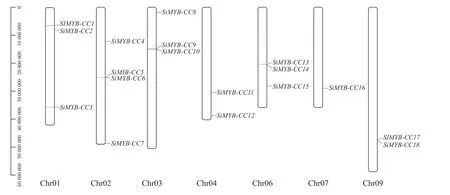
图1 MYB-CC基因的染色体定位Fig.1 Chromosome location of MYB-CC genes in foxtail millet
将这18个MYB-CC基因的染色体位置、基因组位置、氨基酸数目、等电点和相对分子质量等信息进行整理(表2)。由表2可知,谷子的MYBCC基因分布于7条染色体上,它们的编码长度为227~473个氨基酸,等电点(pI)为5.08~9.49,蛋白质相对分子质量为24 977.41~51 795.39 Da。不稳定系数分析表明,SiMYB-CC3、SiMYB-CC11、Si-MYB-CC10、SiMYB-CC16、SiMYB-CC13的不稳定系数均小于40,为稳定性蛋白,其他13个基因蛋白的不稳定系数均大于40,为不稳定性蛋白。
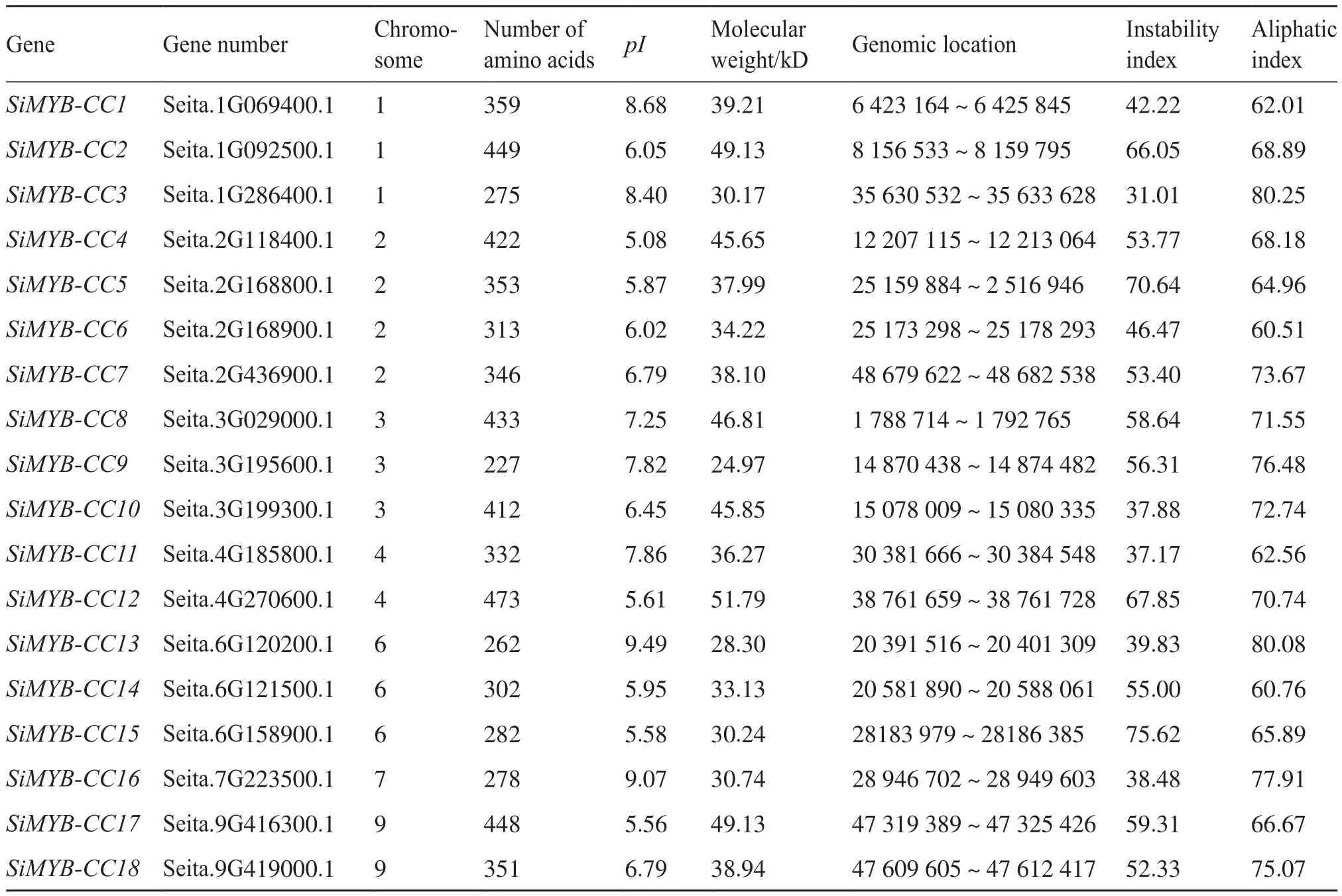
表2 谷子MYB-CC基因家族成员基本信息及蛋白质理化性质Tab.2 Basic information and protein physicochemical properties of MYB-CC gene family members of foxtail millet
对谷子的18个MYB-CC家族成员蛋白的二级结构进行预测,结果表明,各成员的二级结构中均含有α-螺旋、β-折叠、直链延伸和无规则卷曲。其中,α-螺旋和无规则卷曲作为谷子MYB-CC蛋白家族成员二级结构的主要构成元件,占二级结构总量的25%~70%,有利于蛋白质特殊结构构象的形成;β-折叠、直链延伸的占比则相对较少(表3)。
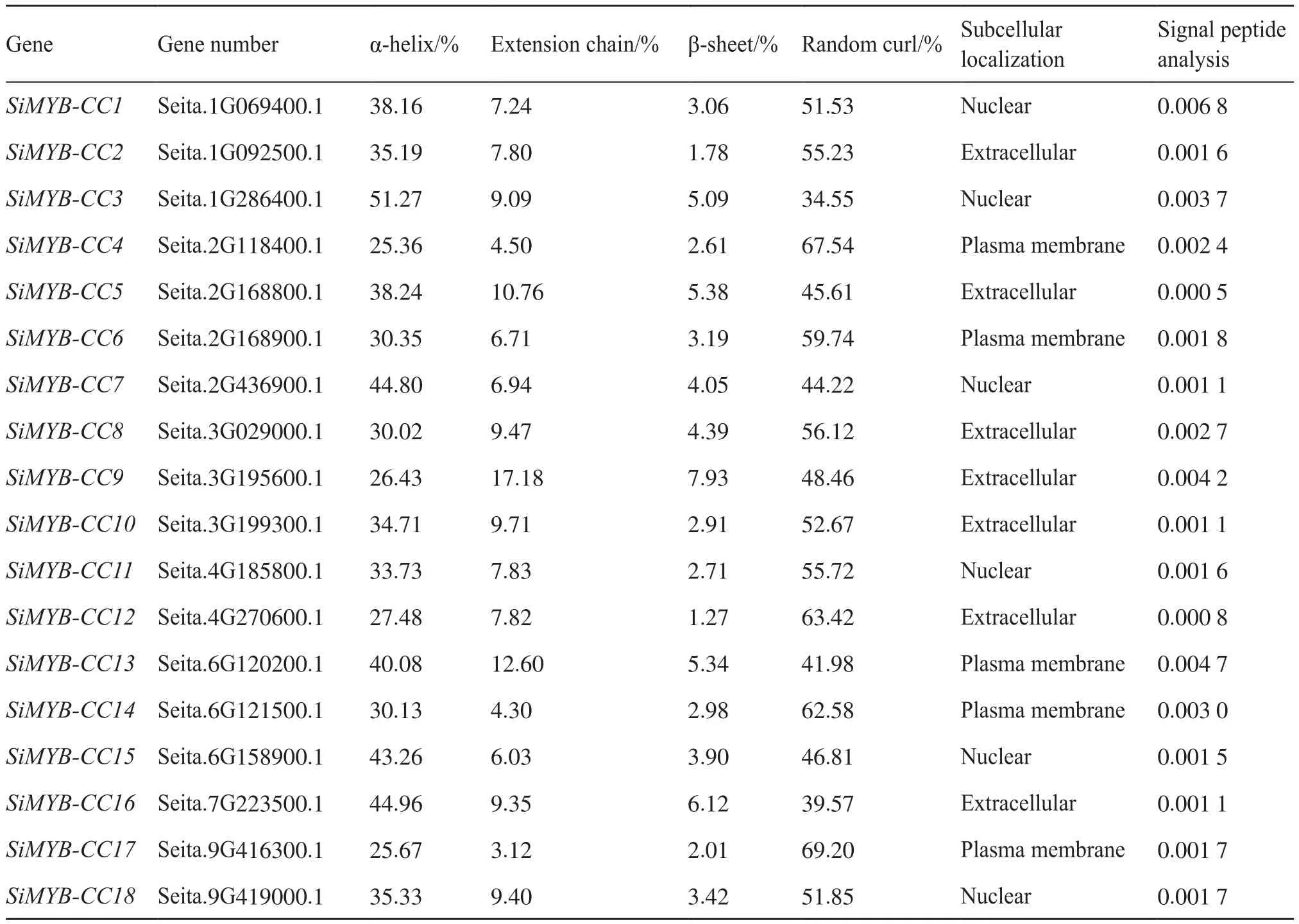
表3 谷子MYB-CC基因家族成员二级结构占比Tab.3 Proportion of secondary structure of MYB-CC genes in foxtail millet
2.2 谷子、拟南芥、水稻MYB-CC基因家族的进化分析
为阐明谷子MYB-CC基因家族的进化关系,将拟南芥(12个)、水稻(16个)和谷子(18个)共46个MYB-CC基因,在MEGA 5.0软件中构建系统发育树。结果显示,谷子中的MYB-CC基因家族被分为两大亚类(图2)。其中,第 I 类亚家族中有10个谷子MYB-CC家族成员与 6个拟南芥及7个水稻MYBCC家族成员;第II 类亚家族中谷子的SiMYB-CC6和水稻的LOC-Os09g12770.1、SiMYB-CC14、LOCOs08g25820.1、SiMYB-CC9、LOC-Os05g41240.1有直系同源的关系。由此可以看出,谷子与水稻亲缘关系较近,与拟南芥亲缘关系较远。
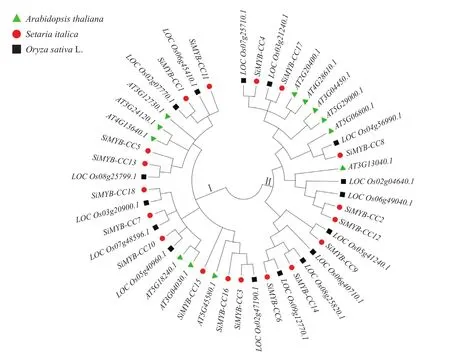
图2 谷子、拟南芥、水稻MYB-CC基因家族的系统进化树Fig.2 Phylogenetic tree of MYB-CC gene family in S.italica, A.thaliana, O.sativa L.
2.3 谷子MYB-CC基因家族的基因结构和保守基序分析
为了进一步了解谷子MYB-CC基因家族成员的功能,本文对谷子MYB-CC基因家族成员进行了基因结构分析,分析结果如图3所示。在谷子MYBCC基因家族成员的基因结构中,除SiMYB-CC5和SiMYB-CC9这2个成员均不含有非翻译区 (untranslated region,UTR)外,其余16个成员均同时具有5'端和3'端非翻译区。
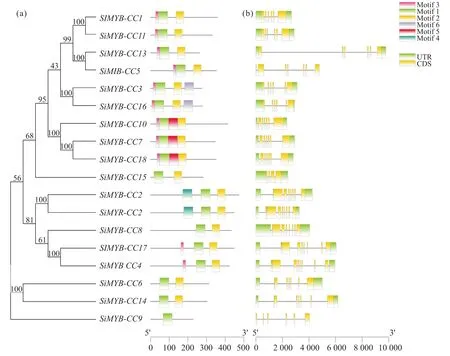
图3 MYB-CC基因进化及结构、基序分析Fig.3 MYB-CC gene evolution, structure and motif analysis
对MYB-CC基因氨基酸序列进行保守基序分析,分别命名为motif 1~6。结果显示:绝大多数谷子MYB-CC家族基因中仅存在1个相对保守的基序motif 1以及2个潜在的保守基序motif 2和 motif 3;除了SiMYB-CC9基因没有motif 2以外,其余17个基因均含有motif 2;值得一提的是,18个SiMYBCC基因中,8个谷子基因的保守基序排布顺序均为motif 3、motif 1、motif 2。这表明谷子MYB-CC基因中的保守基序保守性较强。
2.4 谷子MYB-CC基因顺式作用调控元件
为了更深入地了解谷子MYB-CC基因家族可能潜在的功能,本研究对其启动子区的顺式作用元件进行了分析。18个谷子MYB-CC基因家族启动子区所含顺式作用元件主要为两类:一类是与植物生长发育有关的元件,另一类是与逆境响应相关的元件。除了SiMYB-CC2、SiMYB-CC13基因以外,其余16个谷子MYB-CC基因启动子区域都含有脱落酸响应元件(abscisic acid response element,ABRE),其中SiMYB-CC3基因含有ABRE的数目最多,达到10个。在18个谷子MYB-CC基因中,都主要存在光响应元件(Sp1);SiMYB-CC3、SiMYB-CC9基因启动子区存在生长素响应元件(TGA-element);SiMYBCC2、SiMYB-CC12、SiMYB-CC15基因启动子区存在水杨酸响应元件(TCA-element)、生长素响应元件;SiMYB-CC12、SiMYB-CC15基因启动子区存在赤霉素(P-box)、水杨酸、生长素响应元件;值得注意的是,SiMYB-CC15基因启动子区存在脱落酸、赤霉素、水杨酸、低温(LTR)、干旱诱导相关MYB结合位点(TGACG-motif)、生长素响应元件(表4、5)。结合基因结构的分析,初步推测SiMYB-CC15基因启动子可能会更快地响应一些逆境胁迫,极有可能在低磷条件下快速表达,其具体功能有待后续进一步验证。

表4 谷子MYB-CC基因启动子顺式作用调控元件Tab.4 The cis-acting regulatory elements of foxtail millet MYB-CC gene promoter

表5 谷子MYB-CC基因启动子顺式作用调控元件核心序列及功能Tab.5 Core sequences and function of the cis-acting regulatory elements of the MYB-CC gene promoters in foxtail millet
2.5 谷子MYB-CC基因组织特异性和环境诱导表达分析
为了分析MYB-CC基因家族成员在不同组织中的表达特异性,本试验利用谷子在不同时期和不同组织中的转录组数据对MYB-CC基因家族的表达结果进行分析。从图4中可以看出:除SiMYBCC8、SiMYB-CC3、SiMYB-CC16、SiMYB-CC10、Si-MYB-CC11在各组织中的表达较弱外,其余基因的表达均较强;值得注意的是,SiMYB-CC6和SiMYBCC15在植株整个苗期的过程和灌浆期的根、茎中的表达量都比较高。

图4 谷子MYB-CC基因表达可视化Fig.4 Visualization of MYB-CC gene expression in foxtail millet
2.6 谷子MYB-CC基因在不同谷子品种中各组织的表达量分析
磷酸盐转运蛋白AtPht1;1和AtPht1;2在植物正常条件下和低磷条件下的磷吸收过程中发挥重要作用[21]。采用qRT-PCR进一步确定从表达图谱中筛选出来的组织表达特异性较为明显的1个MYB-CC基因的表达模式,所取样品为实验室前期鉴定出的磷耐受和磷敏感材料。设两个磷浓度处理:正常供磷(0.250 mmol/L,NP)与低磷处理(0.005 mmol/L,LP)。不同磷耐受型谷子的基因表达量因处理时间不同而不同,MYB-CC转录因子基因SiMYB-CC6(Seita.2G168900.1)在磷胁迫处理后6 h时,地上部表达量达到最大值,且其表达量在品种间和处理间的差异最大。磷耐受和磷敏感型谷子根系的基因表达量存在差异,低磷条件下,磷耐受品种的转录因子基因SiMYB-CC6(Seita.2G168900.1)在6 h通过上调表达从而调控下游基因,促进植株对磷的吸收,增强其对磷胁迫的耐受性(图5)。
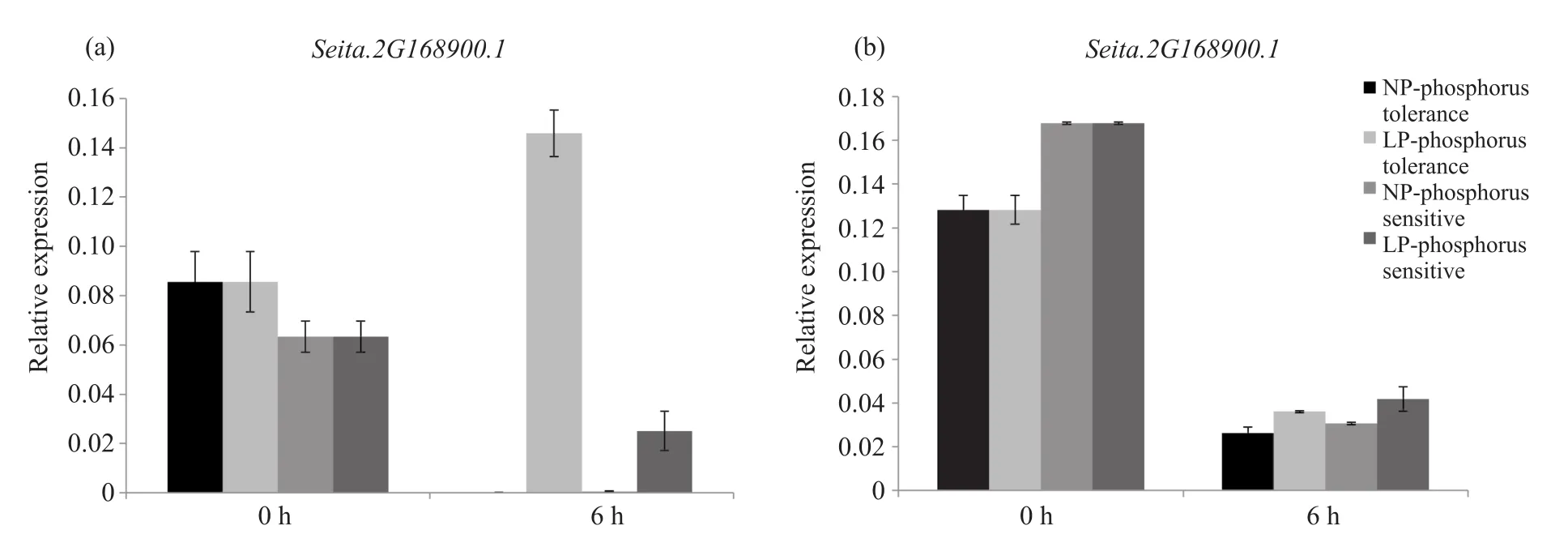
图5 不同基因型谷子在不同磷处理下的基因表达分析Fig.5 Gene expression analysis of different genotypes of foxtail millet under different phosphorus treatments
2.7 谷子MYB-CC基因共线性及进化选择分析
通过共线性分析可以得知不同物种基因间的共线性关系(图6),使用TBTools工具将谷子MYBCC基因家族基因与水稻、玉米的共线性结果进行可视化,并对共线性基因进行进化选择压力分析,获得ka、ks和ka/ks结果。在进化选择压力分析中,ka表示非同义替换,ks表示同义替换,ka/ks的比值可以反映基因在生物进化过程中所受到的选择压力。如果ka/ks>1,可认为有正选择作用;ka/ks=1,认为存在中性选择;如果ka/ks<1,可认为受到纯化选择。从图6中可以看出,共存在34对共线性基因,对这34对共线性基因进行进化选择分析,结果表明,这些基因的ka/ks值均小于1,这表明MYBCC基因家族在进化过程中可能受到了强烈的纯化选择压力(表6)。
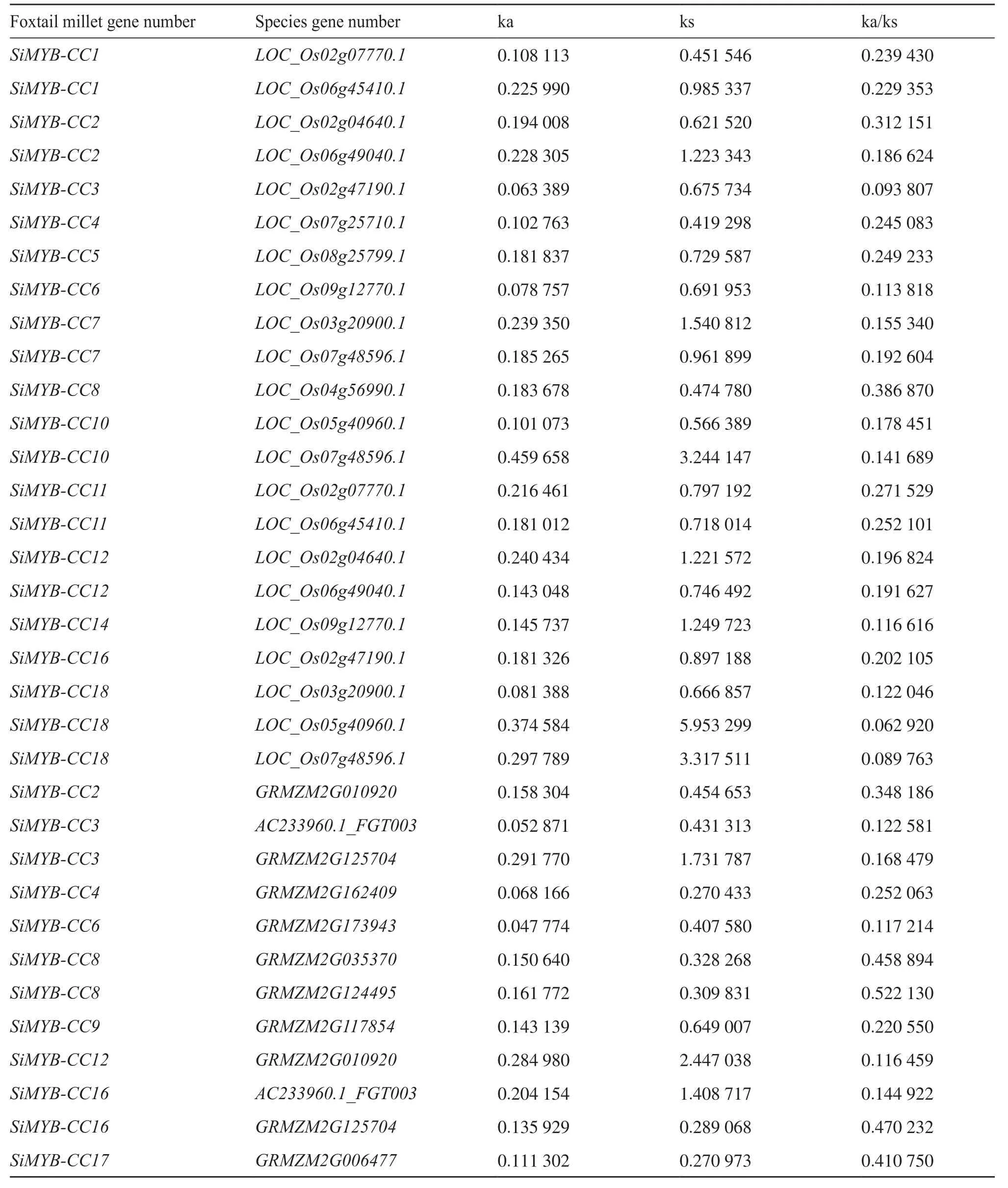
表6 MYB-CC基因进化选择压力分析Tab.6 Analysis of selection pressure in MYB-CC gene evolution
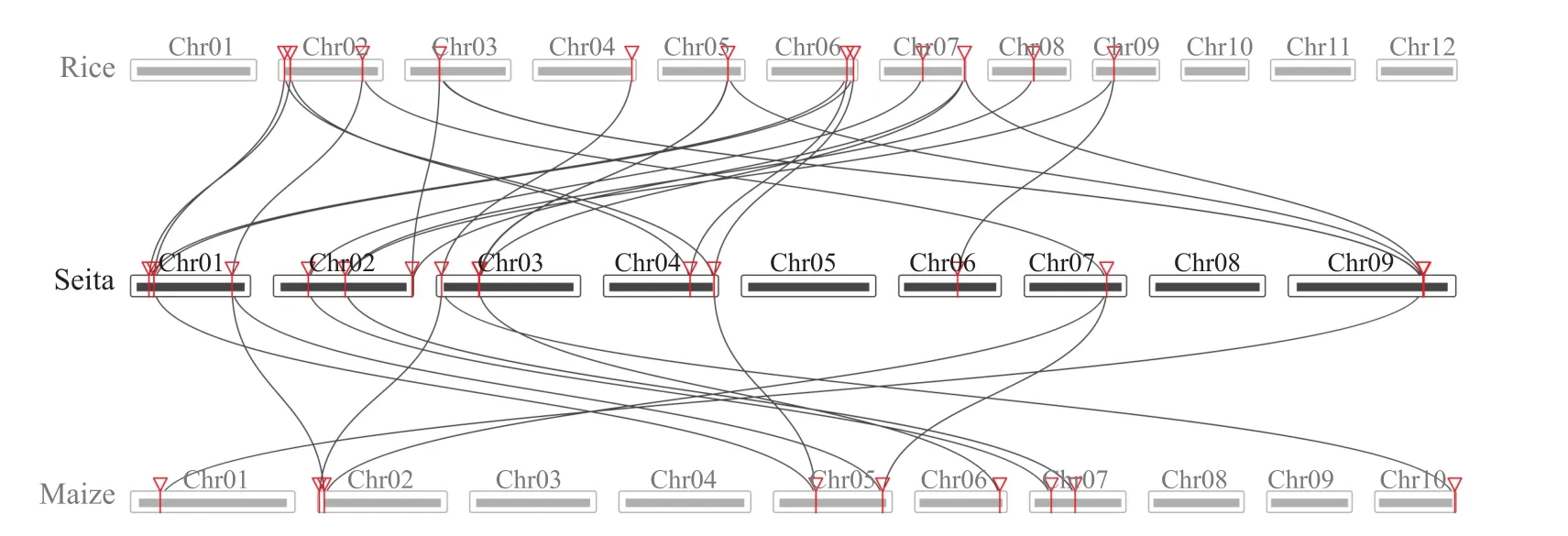
图6 谷子与水稻、玉米MYB-CC基因共线性分析Fig.6 Collinearity analysis of MYB-CC gene in foxtail millet, rice and maize
3 讨论
谷子属于禾本科狗尾草属二倍体作物,且为典型的C4作物。已有研究表明,在拟南芥和水稻中大多数磷饥饿基因都是在AtPHR1和OsPHR2以及其同源基因AtPHL1、AtPHL2、OsPHR1和OsPHR3控制下被诱导激活的[22-23]。
本研究鉴定筛选得到了 18个谷子MYB-CC家族基因,并对其基因结构、表达模式等进行了生物信息学分析,发现在谷子MYB-CC基因家族成员的基因结构中,除SiMYB-CC5和SiMYB-CC9这2个成员均不含有非翻译区外,其余16个成员均同时具有5'端和3'端非翻译区。18个SiMYB-CC基因中,8个谷子基因的保守基序排布顺序均为 motif 3、motif 1、motif 2。这表明谷子MYB-CC基因中的保守基序具有较强的保守性。MYB-CC家族基因启动子顺式作用元件预测到光响应、脱落酸、赤霉素、水杨酸、低温、干旱诱导相关MYB结合位点、生长素响应元件。其中,SiMYB-CC15这个基因的启动子顺式作用元件预测到与植物激素、逆境胁迫诱导相关,表明谷子MYB-CC家族基因可能会更快地响应逆境胁迫。Zhou等[24]研究发现phR2突变体中无机磷大量积累是由高亲和力磷转运蛋白PHT1;8的上调表达所致。植物在长期的进化过程中形成了复杂的低磷响应机制,以适应低磷生存环境。谷子与水稻共线性的基因数目较多,表明谷子MYB-CC家族基因与水稻中的基因存在较近的亲缘性。对共线性基因进行选择压力分析表明,谷子MYB-CC家族基因与水稻和玉米的 ka/ks 值均小于1,表明谷子MYB-CC家族基因在与水稻、玉米基因的进化中可能受到了纯化选择作用。
据报道,玉米中大多数MYB-CC基因在所有组织中均有连续表达,表明它们可能在调节磷摄取和易位方面起着重要作用[25]。本研究对谷子MYB-CC家族基因在叶、茎、穗和根中的组织表达进行了分析,发现谷子MYB-CC家族基因存在组织特异性表达,这与其他禾本科作物MYB-CC基因的表达情况相似。此外,SiMYB-CC6在低磷胁迫后6 h时,表达量远超过了胁迫前的表达水平,故可以推测SiMYB-CC6可能与非生物逆境下促进植株对磷的吸收,增强其对磷胁迫的耐受性有关。
本研究利用生物信息学方法鉴定,初步对谷子MYB-CC家族基因进行了分析,为后续狗尾草属植物生长发育相关MYB-CC基因的克隆和功能研究奠定了理论基础,并初步发现该基因家族成员参与谷子低磷胁迫响应,为植物耐低磷分子研究提供了研究基础。
——以多重共线性内容为例

