斑马鱼myo7ab基因敲除品系的构建
谢缤灵,邓慧玲,付贵芳,王金福,谢鼎华,谢华平,3*
(1.湖南师范大学动物肠道功能调控湖南省重点实验室,长沙 410081;2.湖南师范大学动物营养与人体健康实验室,长沙 410081;3.湖南师范大学淡水鱼类发育生物学国家重点实验室,长沙 410081;4.中南大学湘雅二医院耳鼻咽喉科,长沙 410011;5.浙江大学生命科学学院细胞与发育生物学研究所,杭州 310058)
MYO7A是人类Usher综合征1B型(Usher syndrome type 1B,USH1B)的致病基因。由人类MYO7A突变导致的Usher综合征病例占Usher综合征1型(Usher syndrome type 1,USH1)病例的29%~55%[1-2]。MYO7A基因编码一种非传统的肌球蛋白——MYOⅦA。该蛋白由2 215个氨基酸组成,包含1个N端运动结构域,1个含有几个IQ基序的颈部区域,1个短的预测线圈结构域,1个MyTH4结构域,1个FERM_M结构域,1个SH3结构域,以及2个C端MyTH4-FERM串联结构域[3-4]。MYOⅦA是一种Mg2+介导的ATP酶运动蛋白,它沿肌动蛋白丝运动,以Ca2+敏感的方式结合钙调蛋白,在多种感觉毛细胞中都有表达,并参与多种细胞活动过程[5]。MYOⅦA在视网膜光感受器、视网膜色素上皮细胞(retinal pigment epithelial cells,RPE)及内耳毛细胞中都有表达,主要参与光感受器中视蛋白转运、RPE中黑色素小体运动,以及毛细胞中膜结合元件的锚定和保持,在胚胎早期内耳及视网膜的发育以及胚胎后期的整体发育中都至关重要[6-8]。人类MYO7A基因突变可导致常染色体隐性遗传的USH1B,其特征是先天性感音神经性耳聋、前庭功能障碍及进行性视力丧失[9]。
内耳是人体重要的感觉器官,且听觉感受器和位觉感受器都位于内耳。斑马鱼的听觉器官包括内耳、韦伯氏器及侧线系统。斑马鱼内耳主要由半规管和耳石器官构成,耳石器官中存在大量内耳毛细胞。内耳毛细胞是一种特化的上皮细胞,顶端具有纤毛束,可感受声波刺激。当纤毛束结构遭到破坏时,听力将受到影响[10]。Myo7a基因敲除小鼠品系的纤毛束发育异常,野生型纤毛束呈有序V型排列,而Myo7a–/–小鼠纤毛束分布杂乱无章[11]。斑马鱼作为模式生物,其内耳结构与人体存在一定差异,但由于其胚胎在体外发育,有利于观察内耳发育过程,被广泛应用于内耳发育和疾病模型的研究[12]。
斑马鱼的视网膜结构复杂精密,有多种神经元分层排布。其中感光细胞层由感光细胞——视杆细胞及视锥细胞构成。视杆细胞主要感受弱光刺激,含有视紫红质;视锥细胞主要感受强光刺激。根据视蛋白的差别,斑马鱼视锥细胞可分为红、绿、蓝及紫外敏感型4种类型。感光细胞可将光信号转变为电信号,该过程依赖于膜内外Ca2+浓度变化。斑马鱼与人均为昼行性动物,其视网膜结构非常相似,但斑马鱼视网膜层次结构更为简单,虽然视锥细胞多一种紫外敏感型类型,但对视网膜表型分析及研究并无影响[10,13]。
在斑马鱼中,myo7a基因具有两个不同拷贝——myo7aa和myo7ab。目前关于斑马鱼myo7aa基因的功能已有文献报导,但对于myo7ab并无关注。为了研究myo7ab基因在斑马鱼内耳发育过程中的作用,本研究利用CRISPR/Cas9基因编辑技术构建斑马鱼myo7ab基因敲除品系[14],这对于Usher综合症的病理机制的理解和新的防治方案的研发具有十分重要的意义。
1 材料与方法
1.1 试验材料
1.1.1 试验动物
TU斑马鱼品系来自国家斑马鱼资源中心,并由本实验室养殖。水温28.0℃,pH值6.5~7.5,14 h光照/10 h黑暗交替循环。1对斑马鱼1周产1次卵,胚胎在恒温28.5℃的E3水(5.00 mmol/L NaCl,0.17 mmol/L KCl,0.33 mmol/L CaCl2,0.33 mmol/L MgSO4,0.10%甲基蓝)[10]中培养,第5天开始喂食草履虫至2周左右,之后转移至养殖系统架上喂食丰年虫。
1.1.2 主要试剂
引物由擎科生物技术有限公司合成;PCR高保真酶购自擎科生物技术有限公司(Cat#:TSE005);DNA marker购自擎科生物技术有限公司(Cat#:TSJ012);琼脂糖购自擎科生物技术有限公司(Cat#:TSJ001);PCR产物纯化试剂盒购自生工生物工程股份有限公司(Cat#:B518131);T7体外转录试剂盒购自invitrogen公司(Cat#:Am1314);RNA纯化试剂盒购自Qiagen公司(Cat#:74104);Cas9蛋白购自invitrogen公司(Cat#:A36498)。
1.2 试验方法
1.2.1 向导RNA(gRNA)靶位点设计
首先,在Ensembl网站(http://www.ensembl.org/index.html)上获取目标基因的完整基因组序列(ENSDARG00000044632)、各个转录本以及内外显子等信息;找出所有紧邻5'-NGG-3'(protospacer adjacent motif,PAM)的候选靶序列,靶序列一般大小为18~20 bp。gRNA引物序列F基本结构:靶序列前加保护碱基(gcg)和T7启动子(TAATACGACTCACTATA),靶序列后加gRNA骨架序列上游序列(GTTTTAGAGGCTAGAAATAGG)。gRNA-R序列:AAGCACCGACTCGGTGCCACT[14]。根据myo7ab基因靶位点,通过Primer3.0设计基因组正反检测引物Gmyo7ab-F和Gmyo7ab-R(表1)。

表1 本文涉及到的引物和模板序列Tab.1 Primers and template sequences involved in this study
1.2.2 gRNA的合成
以Template DNA为模板(表1),gRNA1-F/gRNA-R或gRNA2-F/gRNA-R为正反引物,退火温度为61℃,延伸时间为10 s,用高保真酶进行PCR扩增,获得携带T7启动子的myo7ab基因靶位点序列1及序列2的gRNA模板序列;PCR产物进行琼脂糖凝胶电泳并切胶回收,以回收的PCR产物作为模板,用T7体外转录试剂盒合成gRNA,转录产物用RNA纯化试剂盒进行纯化回收,–80℃保存。
1.2.3 显微注射以及靶位点有效性检测
收集15 min内产的斑马鱼受精卵,待发育至1细胞期,将myo7ab基因靶位点的gRNA1、gRNA2和Cas9蛋白混匀(终质量浓度分别为25.00、25.00、2.33 μg/μL)注射到斑马鱼受精卵中,每颗胚胎的注射体积控制为1 nL,随后置于28.5℃的恒温箱中培养;受精卵发育至36 h后挑选部分胚胎进行基因敲除的有效性鉴定,剩余胚胎继续培养至成鱼。
1.2.4 可稳定遗传突变体的筛选
将注射后的胚胎培养2个月至发育为幼鱼,对幼鱼逐条剪尾并进行基因型鉴定。由于两个靶位点之间相距96 bp,如果两个靶位点都有效,就会造成较大片段的缺失。用检测引物对基因组进行PCR扩增,随后进行琼脂糖凝胶电泳。根据真核生物的DNA损伤修复机制,由于目标敲除条带大小未知,若PCR产物同时出现465 bp的野生型目的条带,以及比野生型目的条带小的条带,则这些幼鱼为携带突变的F0代鱼;将F0代幼鱼继续饲养1个月左右至成鱼,与野生型进行杂交,用同样的基因型鉴定方法筛选出可稳定遗传的鱼,这些鱼为F1代突变体。基因型鉴定后,将F1代突变体中比野生型目的条带小的条带进行切胶回收,并送公司测序,分析突变位点和碱基数目。
2 结果与分析
2.1 myo7ab基因结构域分析
首先在NCBI网站(https://www.ncbi.nlm.nih.gov)上查找斑马鱼myo7ab基因的序列并将其下载,利用SMART网站(http://smart.embl-heidelberg.de)查找其蛋白结构域(图1)。

图1 MYO7AB蛋白结构域分析Fig.1 Analysis of MYO7AB protein domain
2.2 myo7ab基因靶位点确定
按1.2.1所述的方法在myo7ab基因编码MYSc蛋白结构域的序列区域选择基因敲除位点(图2)。靶位点序列前加保护碱基和启动子序列,靶位点序列后加gRNA骨架上游序列,将此作为正向引物gRNA1-F和gRNA2-F。gRNA骨架下游序列作为反向引物gRNA-R。

图2 myo7ab基因靶位点示意图Fig.2 The diagram of myo7ab gene targeting site
2.3 myo7ab基因注射有效性检测与分析
为了检验靶位点是否有效,本文按1.2.3中所述方法将注射后胚胎进行基因型鉴定,结果显示,1、2、4和5号泳道除了野生型条带外,下方有一条较弱的小带,证明选择的两个靶位点都有效(图3)。

图3 gRNA有效性分析Fig.3 Effectiveness analysis of gRNA
2.4 F0代突变体筛选
将注射有效的剩余胚胎养至成鱼,对成鱼剪尾进行基因型鉴定(图4)。结果显示,1、2、3号成鱼携带突变基因。

图4 F0代两个月幼鱼筛选Fig.4 Two months F0 juvenile screening
2.5 稳定遗传突变体的筛选
本试验将筛选到的F0代突变体与野生型斑马鱼杂交,得到F1代,收集F1代斑马鱼胚胎,进行DNA鉴定,结果显示F0代突变体可稳定遗传(图5a)。随后将较小的条带进行切胶回收并送公司测序,峰图显示两个靶位点都出现碱基缺失(图5b)。将测序序列在NCBI blast数据库中进行比对,发现突变体的两个靶位点之间都有碱基缺失,其中第一号靶位点与第二号靶位点间缺失58 bp,第二号靶位点3'端缺失30 bp,这证明两个靶位点都有效并造成大片段的缺失(图5c)。将剩余的F1代胚胎养至2个月的幼鱼,再逐条剪尾进行基因型鉴定(图5d),获得可稳定遗传的F1代鱼,说明敲除品系构建成功。

图5 F1代突变体筛选Fig.5 F1 generation mutant screening
3 讨论
本文通过CRISPR/Cas9技术对斑马鱼进行了myo7ab基因的基因敲除试验,成功构建了能够稳定遗传的myo7ab基因突变品系。将F1代myo7ab基因杂合突变体成鱼自交,观察F2代myo7ab基因纯合突变胚胎,其外表未出现明显缺陷(图6),这说明基因敲除后不影响整体胚胎发育,但是该基因是否引起细微结构、离子通道功能的改变目前尚不清楚。
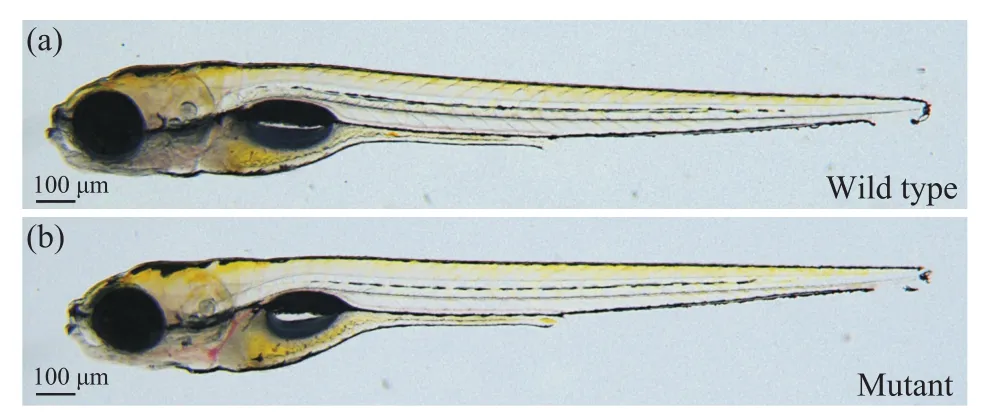
图6 myo7ab基因纯合突变胚胎整体发育正常(50×)Fig.6 myo7ab null mutant has no obvious defect (50×)
MYO7A基因突变导致人类Usher1B型综合症,患者在出生后即表现为重度耳聋,随后在10岁左右出现视网膜色素变性症状。Usher1B型综合征的症状表现使基因治疗成为可行方案。目前已有研究利用插入小鼠Myo7a基因的腺相关病毒(adenoassociated viruses,AAV)对Myo7a基因突变小鼠进行基因治疗[15]。尽管对小鼠Myo7a突变品系已进行了诸多研究,但在大多数小鼠模型中没有出现视网膜色素变性表型,因此,很多关于视网膜色素变性的病理机制的假说难以在小鼠模型中得到证实[16-18]。斑马鱼作为模式动物,具有试验周期短,通体透明易观察等特点,被广泛应用于发育生物学研究[19-20]。利用CRISPR/Cas9技术构建斑马鱼myo7a基因突变模型,或能弥补小鼠Myo7a突变模型无视网膜异常表型的缺陷。
斑马鱼中存在myo7aa和myo7ab两个拷贝,后续将通过建立myo7aa基因敲除品系,以及myo7aa/myo7ab双基因敲除品系,探究两个拷贝之间的相互关系,并观察其表型,进行基因功能研究。

