达雷妥尤单抗治疗复发难治性系统性轻链型淀粉样变性
郭锦洲 任贵生 梁丹丹 黄湘华
现病史48岁女性,因“确诊肾淀粉样变性近2年,干细胞移植后9个月”于2020-08-19入院。患者2018年10月初无明显诱因出现双下肢水肿,无腰痛、肉眼血尿,无皮疹、关节痛,于国家肾脏疾病临床医学研究中心查尿蛋白定量7.18g/24h,血白蛋白22.8 g/L,血清肌酐(SCr)48.62 μmol/L,碱性磷酸酶53 U/L,血红蛋白120 g/L,血游离轻链κ 807 mg/L(参考值3.3~19.4 mg/L),λ 11.5 mg/L(参考值5.71~26.3 mg/L),κ/λ 70.17(参考值0.26~1.65),血清免疫固定电泳(sIFE):κ轻链型单克隆免疫球蛋白条带。心肌标志物:N端脑钠肽前体(NT-proBNP)712.0 ng/L,肌钙蛋白T(TnT)0.021 ng/ml。心脏超声:室间隔厚度9 mm,左室后壁厚度9 mm,左室射血分数(LVEF)56%。心脏MRI:左心室基底段、中段、室间隔延迟强化,细胞外容积高于0.4。上腹部CT未见肝脏体积增大。骨髓形态:成熟浆细胞2.5%,荧光原位杂交(FISH):1q21扩增20%,第11和14对染色体易位[t(11;14)]23%,免疫分型:浆细胞占有核细胞的1.58%,表型为CD38+、CD138+、CD19-、CD56+、CD45±、cκ+、cλ-,为单克隆性浆细胞。肾穿刺活检病理:光镜:肾小球系膜区和血管袢、动脉壁见PAS弱阳性物质分布(图1A);PASM-Masson:肾小球节段袢见毛刺样嗜银物(图1B);刚果红染色阳性,偏振光下见苹果绿双折光(图1C);轻链染色κ阳性,λ阴性(图1D)。皮肤脂肪组织刚果红染色阳性,偏振光下见苹果绿双折光(图1E);轻链染色κ阳性、λ阴性(图1F)。诊断为系统性轻链(AL)型淀粉样变性(累及肾脏、心脏、皮肤,Mayo 2012年修订版分期 Ⅱ期)。
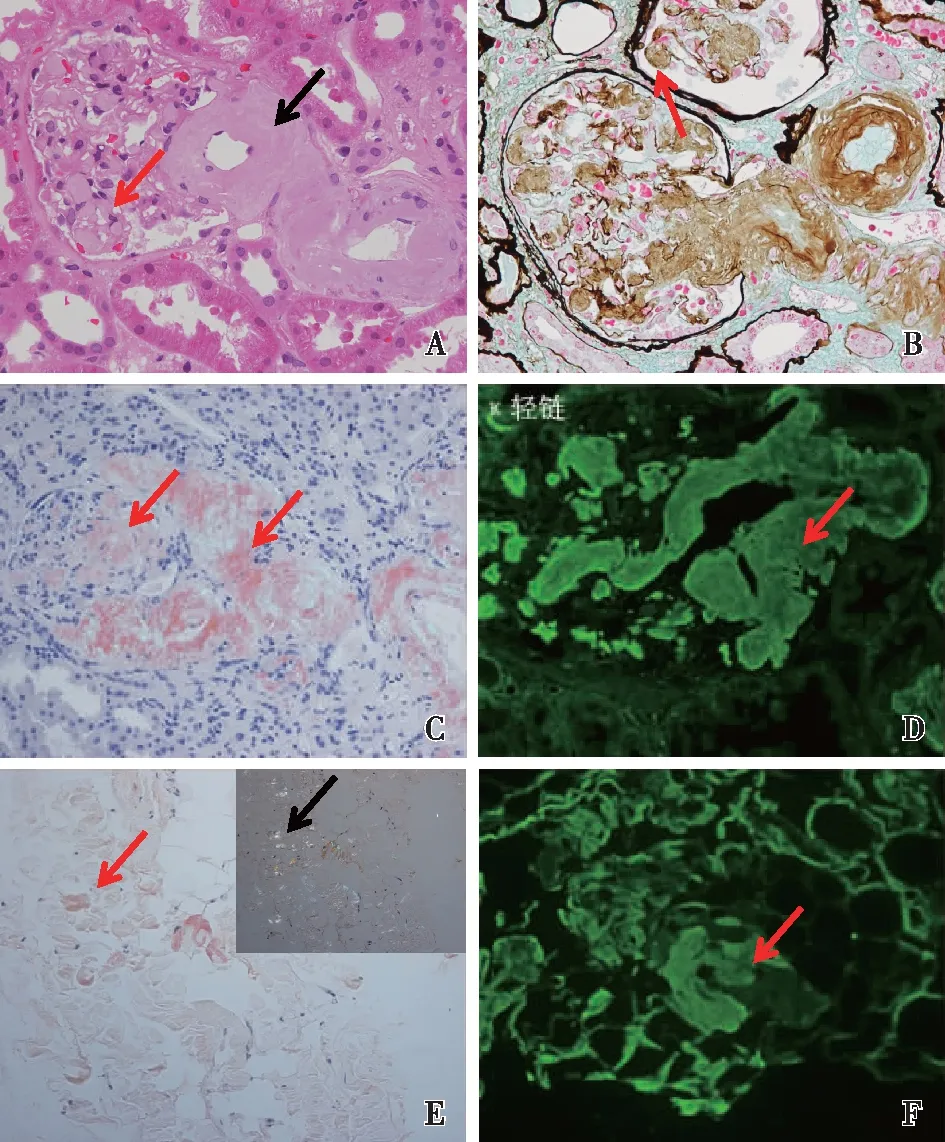
图1 肾组织和皮肤脂肪组织病理A:肾小球系膜区和毛细血管袢(↑)、动脉壁(↑)大量PAS弱阳性物质分布(PAS,×400);B:肾小球节段袢见毛刺样嗜银物(↑)(PAS-Masson,×400);C:肾组织刚果红染色阳性(↑)(刚果红,×200);D:κ轻链染色阳性(↑)(IF,×400);E:皮肤脂肪组织刚果红染色阳性(↑)(刚果红,×200),偏振光下见苹果绿双折光(↑);F:皮肤脂肪组织κ轻链染色阳性(↑)(IF,×400)
患者自2018年11月至2019年5月在当地医院接受硼替佐米+地塞米松(BD)方案化疗(硼替佐米1.3 mg/m2+地塞米松40 mg,第1、4、8、11天给药,28d为1个疗程),共计7个疗程,血液学获得部分缓解(PR),尿蛋白波动在5.72~7.42 g/24h,评估肾脏无反应(图2)。第7疗程后复查dFLC 501.4 mg/L,评估血液学进展(PD),于2019-07-15至国家肾脏疾病临床医学研究中心住院行自体干细胞移植(ASCT)治疗。入院后查尿蛋白定量8.15g/24h,血清白蛋白24.10 g/L,血游离轻链κ 342.5 mg/L,λ 5.0 mg/L,κ/λ 68.50。7月21日开始行粒细胞刺激因子动员,两次行自体外周血干细胞采集,共采集CD34+细胞11×106/kg。11月15日、16日予美法仑预处理(剂量200 mg/m2),11月18日、19日行干细胞回输,过程顺利。干细胞回输后第9天粒细胞植入、第10天血小板植入。ASCT后1个月(2019-12-18)复查血游离轻链κ 17.5 mg/L,λ 16.6 mg/L,κ/λ 1.05,sIFE仍见κ链免疫球蛋白条带,评估血液学非常好的部分缓解(VGPR),但肾脏和心脏无反应。2020-03-18复查dFLC升至429.2 mg/L,评估PD,再次给予BD方案化疗2个疗程,评估血液学获得PR,心脏缓解,肾脏仍无反应。为进一步治疗,2020-08-19因“肾脏淀粉样变性”第3次入院。病程中患者精神、食欲、睡眠尚可,大便正常,尿量正常,体重、体力无明显变化。
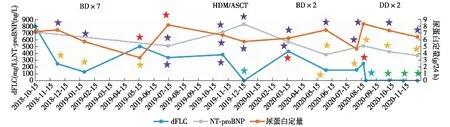
图2 不同阶段治疗方案的血液学、心脏和肾脏疗效评估BD:硼替佐米+地塞米松;HDM/ASCT:大剂量美法仑+自体造血干细胞移植;DD:达雷妥尤单抗+地塞米松;dFLC:血清受累和非受累轻链差值;NT-proBNP:N端脑钠肽前体;:部分缓解;:非常好的部分缓解;:完全缓解;:疾病进展;:疾病稳定
既往史2019年11月发现右侧乳腺实性肿块伴钙化,BI-RADS超声分级4A级,左侧乳腺3点钟实性肿块,BI-RADS超声分级4A级,随访稳定。2019年11月行干细胞回输期间输注血小板20U及血浆300 ml。个人史及家族史无特殊。
体格检查体温36.7℃,脉搏87次/min,呼吸16次/min,血压110/75 mmHg,身高168 cm,体重55 kg,体质量指数19.5 kg/m2。慢性病容,营养良好。舌体无肥大。心肺查体未及明显异常。腹软,无压痛、反跳痛。双下肢不肿。
实验室检查
尿检检查 尿蛋白定量8.32g/24h。NAG酶18.7 U/(g·Cr),RB蛋白1.76 mg/L。
血液检查
血常规 白细胞3.99×109/L,血红蛋白120 g/L,血小板232×109/L,C反应蛋白1.0 mg/L。
血生化 钙1.97 mmol/L,余电解质正常,SCr 66.3 μmol/L,尿素氮4.92 mmol/L,尿酸267 μmol/L,白蛋白21.40 g/L,球蛋白13.5 g/L,转氨酶正常,总胆固醇10.78 mmol/L,三酰甘油5.53 mmol/L,碱性磷酸酶71.00 U/L。D二聚体0.10 mg/L。
心肌指标 TnT 0.022 ng/ml,NT-proBNP 520.4 ng/L。
血游离轻链 κ 260.0 mg/L,λ 9.4 mg/L,κ/λ 27.66。免疫固定电泳见κ轻链单克隆免疫球蛋白条带。
体液免疫 IgG 1.71 g/L,IgA 0.36 g/L,IgM 0.321 g/L。
影像学检查胸部CT未见明显异常。心脏超声:超声心动图所见考虑淀粉样变累及心脏。(1)左室舒张功能轻度减低。(2)右心纵向收缩功能减低。(3)房间隔中部考虑房间隔瘤。(4)少量心包积液。声学造影:左室基底段心内膜下心肌灌注略减。消化系统超声:(1)胆囊继发性改变。(2)肝胰脾声像图未见占位。
诊疗分析病史特点:(1)中年女性;(2)临床表现为肾病综合征;(3)血游离轻链比值异常,伴血M蛋白阳性(κ轻链型);(4)肾组织及皮肤脂肪组织刚果红阳性,轻链染色κ阳性,λ阴性;(5)心脏超声示室间隔、左室后壁厚度正常,NT-proBNP>332 pg/ml;(6)骨髓流式提示存在κ轻链限制性表达的克隆性浆细胞,与血M蛋白及组织病理轻链染色一致;(7)骨髓细胞学示浆细胞比例2.5%(<10%),同时无高钙血症、肾功能损伤、贫血、骨质破坏(CRAB)表现,可排除多发性骨髓瘤(MM)。综上,AL型淀粉样变性(累及肾脏、心脏、皮肤)诊断明确。本次入院后查dFLC<180 mg/L,TnT<0.025 ng/ml,NT-proBNP<1 800 ng/L,因此Mayo 2012年修订版分期为Ⅱ期。
最后诊断(1)系统性κ轻链型淀粉样变性(累及肾脏、心脏、皮肤,Mayo 2012年修订版分期 Ⅱ期);(2)自体造血干细胞移植术后;(3)双侧乳腺肿瘤。
治疗及随访本例患者接受硼替佐米、大剂量美法仑+自体造血干细胞移植(HDM/ASCT)方案后反复复发,且均未获得持续VGPR及以上血液学缓解,而t(11;14)是蛋白酶体抑制剂(PIs)、免疫调节剂(IMIDs)治疗AL的预后不良因素[1-2],因此继续给予以PIs、IMIDs或美法仑为基础的化疗预期疗效不佳。
患者于2020-08-20接受达雷妥尤单抗(DARA)+地塞米松(DD方案)治疗。DARA单次剂量900 mg(16 mg/kg),首次用药分2d使用(400 mg d1、500 mg d2),DARA用药前1h给予对乙酰氨基酚缓释片、氯雷他定胶囊、异丙嗪注射剂、甲泼尼龙注射剂,用药期间给予地塞米松20 mg维持静脉滴注预防过敏反应。治疗过程顺利,无不适。8月24日复查dFCL由250.6 mg/L降至4 mg/L,κ/λ比值由27.66降至1.8,评估血液学VGPR。第1疗程每周给药1次,4针后评估血液学达CR。1个月后开始第2疗程,每2周给药一次。末次随访时间2020-12-08(第8针DARA后2周),血液学持续CR,肾脏无反应(图2)。
讨 论
AL型淀粉样变性是一种罕见的浆细胞疾病,异常浆细胞分泌的淀粉样纤维丝沉积于组织和器官,导致器官功能受损,主要累及心脏、肾脏和肝脏。环磷酰胺/硼替佐米/地塞米松方案被认为是新诊断AL型淀粉样变性的标准疗法,血液学CR率为23%~47%[3-4]。也有研究认为BD基础上加用环磷酰胺并不能提高缓解率和改善预后[5],而BD诱导续贯HDM/ASCT方案1年和2年CR率分别达到67.9%和70.0%[6]。即便如此,新诊断AL型淀粉样变性患者2年死亡率仍达到40%[7]。对于IMIDs和PIs治疗无反应或者PD的患者,需要更好的治疗方案。
DARA是全人源IgG1κ型单抗,特异性靶向Ⅱ型跨膜糖蛋白CD38分子,通过直接作用、Fc依赖机制和免疫调节机制发挥抗浆细胞作用[8-9]。在新诊断和难治复发性MM患者,DARA单药或联合治疗显示出良好抗肿瘤效果,且无严重心脏和肾脏毒性,其静脉制剂于2015年11月获批上市。AL型淀粉样变性患者骨髓中克隆性浆细胞同样表达CD38,为DARA治疗复发难治性AL型淀粉样变性提供理论依据。2016年Mayo医学中心首次报道DARA治疗2例复发难治性AL型淀粉样变性患者,均获得血液学CR且仅有轻微输注相关反应(IRR)[10]。同年9月启动的一项2期临床研究纳入40例复发难治性AL型淀粉样变性患者,给予6个疗程DARA联合小剂量糖皮质激素,47.5%患者获得VGPR及以上疗效,其中VGPR为40%,2年总体生存率(OS)达到74%[11]。2017年4月启动的另一项2期临床研究采用DARA单药治疗直至PD或出现不能耐受毒副作用,最长给药24个月,86%患者达到VGPR及以上疗效,其中CR率33%,中位无进展生存(PFS)达到28个月[12]。多项回顾性研究同样显示良好疗效,ORR达到64%~86%,其中CR达到8%~40%,VGPR达到23%~53%[13-15]。DARA治疗的不良反应较少,1~2级IRR发生率为5%~47%,3级IRR发生率0~10%[11-15]。常见的IRR包括胸闷/呼吸困难(49%)、咳嗽(30%)、鼻塞/流涕(24%)、眼部不适(18%)和恶心/呕吐(18%)[14]。本例患者未出现IRR。
本例患者接受第1针DARA治疗后评估血液学VGPR,4针后评估CR,与文献报道一致。研究显示47.5%患者在第1针用药后获得PR及以上疗效,其中32.5%达到VGPR。第1针用药后的dFLC水平和dFLC下降幅度可用于预测血液学反应[11]。如4针用药后未获得血液学缓解,继续用药仍难以获得缓解[11,14]。3个月时获得深度缓解(dFLC<10mg/L)的患者3年未切换治疗方案生存率为82%,而未达到深度缓解组仅25%[14]。
器官功能缓解依赖于循环中受累轻链的清除,获得VGPR及以上血液学缓解的患者更易获得器官缓解[11-12]。本例患者血液学快速缓解,但随访16周仍未观察到肾脏反应。研究显示,DARA治疗复发难治性AL型淀粉样变性患者心脏获得首次反应和最佳反应的中位时间为12.8~20周和44~67.2周,肾脏获得首次反应和最佳反应的中位时间为18~24周和51.6~54周[12,14]。只要血液学仍处于缓解状态,即使在治疗6~12个月后仍未出现器官反应也不建议增加药物或者调整治疗方案。截至末次评估本例患者仍处于肾病综合征状态,我们相信随着治疗继续,只要血液学持续缓解状态,最终能达到肾脏缓解。
本例患者骨髓浆细胞存在1q21扩增和t(11;14)。Mayo骨髓瘤分层及风险调整治疗(mSMART)分层系统将1q21扩增和t(11;14)分别归入MM的高危组和标危组[16]。在AL型淀粉样变性中t(11;14)是最常见的细胞遗传学异常,约50%~60%患者的骨髓FISH检测到t(11;14),约1/3患者检测到1q21扩增[17-18]。1q21扩增是MD方案(美法仑+地塞米松)治疗AL型淀粉样变性的预后不良因素[19],但不是BD方案的预后不良因素,而t(11;14)则明显影响BD方案在AL型淀粉样变性的疗效和预后[1]。此外,t(11;14)也是IMIDs治疗AL型淀粉样变性的预后不良因素[2]。DARA治疗复发难治性AL型淀粉样变性的研究则显示1q21扩增是影响OS和EFS的危险因素,而t(11;14)与更好的EFS相关[13]。本例患者接受BD、HDM/ASCT等方案疗效不佳、反复复发,考虑与浆细胞存在t(11;14)和1q21扩增相关,但在接受DARA治疗后获得血液学缓解。另有研究发现t(11;14)浆细胞BCL-2/MCL-1比值升高,存在t(11;14)的复发难治性AL型淀粉样变性患者接受BCL-2抑制剂Venatoclax治疗后80%获得VGPR及以上疗效[20]。Venatoclax在DARA治疗失败的存在t(11;14)的AL型淀粉样变性患者同样有效[21]。本例患者如在DARA维持治疗期间再次出现PD,可尝试Venatoclax治疗。
目前文献报道DARA治疗复发难治性AL型淀粉样变性的给药方案源自MM,采用4周1疗程,单次剂量16 mg/kg,前8周每周给药1次,第9~24周每2周给药1次,第25周开始每4周给药1次。然而DARA治疗复发难治性AL型淀粉样变性的疗程并不统一。临床研究显示DARA治疗6个疗程的2年PFS为51.2%、中位PFS 为24.8个月[11],维持治疗2年的中位PFS为28个月[12],而在真实世界中维持治疗的2年未切换治疗方案生存率为62%[14]。本例患者肿瘤负荷较低,且治疗反应好,考虑到治疗费用等因素,在第1疗程结束后4周才启动第2疗程,并将用药间隔延长至2周,仍能维持血液学CR,因此我们认为DARA治疗复发难治性AL型淀粉样变性无需照搬MM用药模式。
小结:本例复发难治性AL型淀粉样变性患者,在PIs、大剂量美法仑联合ASCT后复发,其骨髓FISH存在t(11;14),经DARA联合地塞米松治疗快速获得深度的血液学缓解,且安全性良好。其远期预后仍需进一步随访观察。

