外泌体在急性肾损伤发展为慢性肾脏病中的作用机制
周桃桃 综述 郭兆安 审校
尽管部分急性肾损伤(AKI)患者在治疗后肾脏功能可恢复正常,但肾组织中遗留的病理改变短期内不能完全恢复,有研究报道在十年的随访中,AKI向慢性肾脏病(CKD)发展的风险增加了25%,死亡率增加了50%[1]。最近的研究证实AKI和CKD存在内在联系,在AKI中存在的肾小管上皮细胞损伤、炎细胞浸润和血管功能障碍等病理改变,可激活肾脏的自我修复机制,如缺血再灌注、抑制内源性干细胞和祖细胞在肾脏的迁移、归巢和旁分泌,同时促进肾间质中的成纤维细胞和细胞外基质增殖、活化,进一步增加了向CKD发展的可能[2]。外泌体在肾脏生理病理过程中的细胞通讯、诊断和治疗作用已得到充分认可,并在AKI转为CKD过程中扮演者重要角色。因此,全面系统开展外泌体对AKI的作用研究,对未来解密其作用机制,改善AKI的预后尤为重要。
外泌体的特征与作用
细胞外囊泡(EVs)是细胞释放到外环境中的多样化膜性囊泡,包括外泌体、微囊泡(MVs)、凋亡小体。外泌体直径为40~120 nm,是细胞膜内陷以出芽方式形成的包含有miRNA 、DNA片段及功能性蛋白的分泌囊泡,并通过三种形式完成细胞通讯:一是外泌体膜蛋白与靶细胞膜蛋白结合,二是外泌体膜蛋白被蛋白酶剪切,剪切的碎片作为配体与细胞膜上的受体结合,三是外泌体膜与靶细胞膜直接融合。不同于其他EVs,外泌体具有转移RNA、蛋白质、酶和脂质的能力,可以调节血管生成、抗原呈递、细胞凋亡等生理病理过程[3]。外泌体如何在体内靶向受体细胞的机制仍然未知,目前发现,基因工程改造可使外泌体的跨膜蛋白表现出配体/同源肽,从而赋予外泌体靶向于带有同源受体细胞的能力。
肾脏外泌体主要起源于足细胞、近曲小管、尿血管袢粗大上升肢、远曲小管和集合管。这些外泌体富含来自肾单位的蛋白质和转运蛋白,能增加细胞间通讯以发挥生理作用,如近曲小管细胞外泌体可将3-磷酸甘油醛脱氢酶递送至远曲小管以修复损伤的肾小管上皮[4],加压素类似物处理的导管细胞外泌体表达的水通道蛋白(AQP)2能诱导邻近细胞上调AQP-2的表达以增强水的重吸收[5]。另外,外泌体中的蛋白质和miRNA可作为早期诊断和评估AKI进展的生物学标志物,已证实转录因子3、胎球蛋白A、中性粒细胞明胶酶相关的脂蛋白等可作为AKI诊断的潜在标志物,而miR-16,miR-24和miR-200c升高可反映出肾脏病变处于早期(或损伤阶段),miR-125和miR-351升高可反映出肾脏病变处于晚期(或纤维化阶段)[6]。
外泌体对AKI发展为CKD的调控机制
在AKI发展中,源自病变肾脏的细胞外泌体可诱导炎症反应和肾小管损伤、抑制血管生成和促进肾脏纤维化,而源自间充质干细胞(MSC)、人羊膜上皮细胞、尿液干细胞等外源性外泌体作用恰好相反。外泌体的作用机制见图1。
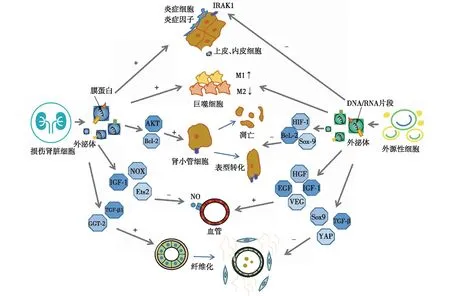
图1 外泌体在急性肾损伤发展为CKD 中的作用机制CKD:慢性肾脏病;IRAK1:白细胞介素-1受体相关激酶1抗体;AKT:蛋白酶B;Bcl-2:B淋巴细胞瘤-2;NOX:还原型烟酰胺腺嘌呤二核苷酸磷酸氧化酶的非吞噬细胞氧化酶;IGF-1:胰岛素样生长因子-1;Ets2:骨髓成红细胞增多症病毒E26癌基因同源物2;TGF-β:转化生长因子-β;GGT-2:γ-谷氨酰转肽酶2;HIF-1:缺氧诱导因子1;Sox-9:人性别决定区Y框蛋白9;Hgf:肝细胞生长因子;EGF:表皮细胞生长因子;VEG:血管内皮生长因子;YAP:Yes相关蛋白;NO:一氧化氮
炎症反应持续性缺血缺氧导致肾小球毛细血管内皮细胞损伤,诱导炎性细胞浸润和炎性介质释放。炎症反应贯穿于AKI的各个阶段,但具体作用机制尚未明确,而外泌体在其中扮演重要角色。
外泌体能够诱导炎症反应。在损伤肾脏中,肾小球内皮细胞外泌体暴露表面的激肽B1受体和白细胞介素8(IL-8),吸引中性粒细胞浸润[7],肾小管上皮细胞(TEC)分泌含有miR-19b-3p的外泌体,通过减弱核因子κB(NF-κB)信号传导抑制蛋白1的表达,促进M1巨噬细胞活化,致肾小管间质炎性细胞浸润[8],而暴露于白蛋白的TECs外泌体释放的能表达趋化因子配体2(CCL2)的mRNA靶向作用于巨噬细胞,诱导间质炎症发生[9]。
另一方面,外泌体具有抗炎作用。在脓毒症诱导的AKI小鼠中,脂肪MSC外泌体通过增加SIRT1的分泌抑制NF-κB的活性并减弱肿瘤坏死因子α(TNF-α)、IL-1、IL-6、单核细胞趋化蛋白1的转录、生成和释放[10]。人羊膜上皮细胞外泌体可保护人肾皮质近曲小管上皮(HK-2)细胞免受缺氧/复氧的损伤,并可促进巨噬细胞向M2表型极化,分泌抑制性细胞因子IL-10或转化生长因子β(TGF-β)以下调免疫应答[11]。在缺血-再灌注损伤(IRI)诱导的AKI中,人尿液干细胞外泌体分泌的miR-146a-5p通过参与TNF的负反馈调节,抑制IL-1受体相关激酶1(IRAK1)的表达,减少IRAK1介导的Toll样受体和细胞因子信号传导受体相关因子6的释放,从而减轻炎症反应并保护HK-2细胞[12]。
肾小管损伤近端肾小管细胞损伤是AKI的特征性病理改变。在严重缺血、缺氧、炎症等作用下TECs增殖周期异常,进一步增加TGF-β和结缔组织生长因子(CTGF)的基因表达及蛋白合成分泌,加重肾小管的损伤。另外,炎症细胞因子持续活化和局部蛋白酶对基膜的破坏可诱导TECs向间充质细胞转化。
外泌体可诱导肾小管损伤。在AKI时,TECs外泌体分泌的miR-21作用于邻近的受体小管,并通过抑制磷酸酶和张力蛋白同源物蛋白的活性增强蛋白激酶B(Akt)信号传导,促进肾小管表型转变[13]。损伤足细胞外泌体分泌的miR-424和miR-149促进HK2细胞凋亡和p38磷酸化,分泌的miR-200促进TGF-β1表达和诱导TECs向间充质细胞的转化[14]。肾小管间质成纤维细胞外泌体分泌的miR-153-3p抑制近端TECs的B淋巴细胞瘤-2基因表达,诱导细胞凋亡[15]。
另一方面,外泌体可保护或修复肾小管。MSC外泌体能上调肾小管细胞的Bcl-xL、Bcl2和BIRC8抗凋亡基因,下调胱天蛋白酶(Casp)1、Casp8和LTA凋亡基因,尿液干细胞外泌体能抑制TECs的凋亡基因caspase-3过表达[16]。骨髓MSC外泌体可减轻TECs的氧化应激和细胞凋亡,促进体内外细胞增殖,修复顺铂诱导的AKI大鼠损伤的TECs[17],脂肪MSC外泌体激活肾小管Sox9基因,增强近端肾小管细胞去分化和有效增殖,改善细胞周期阻滞和缺氧,促进肾小管修复和再生[1]。
微血管损伤周围毛细血管稀疏是AKI向慢性肾纤维化发展的典型特征。各种AKI的动物模型(叶酸、输尿管阻塞、缺血再灌注等)研究显示,肾脏损伤后毛细血管丛密度减少30%~50%,肾间质处于缺氧状态,能加重间质炎症和纤维化。
外泌体可抑制血管的生成。研究显示,血小板、内皮细胞等细胞外泌体依赖磷脂酰丝氨酸和CD36作用刺激肉瘤基因(Src)和NOX家族激酶信号通路,诱导活性氧产生,抑制内皮细胞迁移和管状结构形成,从而抑制血管生成[18]。内皮细胞外泌体分泌的miR-320可下调胰岛素样生长因子1(IGF-1)、重组人热激蛋白20(HSP20)、Ets2靶基因抑制血管生成[19]。另外,循环中的部分EVs可促进内皮细胞释放一氧化氮并损伤内皮依赖性血管的舒张功能,从而损伤血管内皮细胞[20]。
另一方面,外泌体可促进血管的新生。IRI诱导的AKI小鼠存在肾小管周围毛细血管的显著缺损,给予人羊膜上皮细胞外泌体治疗后,血管生成相关基因(Egf,Fgf,Hgf,Igf-1,Pdgf和Vegf)水平显著上调[11],给予褪黑激素联合MSC外泌体治疗后,血管内皮生长因子和胰岛素样生长因子1等促血管生成因子的表达明显增加,管周毛细血管的密度也随之增加[21]。在糖尿病肾病大鼠模型中,检测到尿液干细胞外泌体内富含生长因子、血管生成素和骨形态发生蛋白7等,这些物质均与血管再生密切相关[22]。
肾脏纤维化AKI肾脏中炎性细胞浸润、肾小管损伤和微血管损伤等病理改变均可增加促纤维因子释放,导致肾纤维化。TGF-β是与纤维化密切相关的因子,在纤维化发生中具有双重作用,正常表达可抑制炎症和细胞增生、调节细胞生长分化和免疫,而过度表达会引起组织纤维化。
外泌体促进肾脏纤维化。缺血缺氧刺激的TECs可释放富含miR-150、TGF-βmRNA的外泌体,进一步促进成纤维细胞增殖[11],而在单侧输尿管结扎的肾纤维化小鼠中,TGF-β1可反向刺激TECs分泌富含谷氨酰胺酶2的外泌体,从而改变细胞外稳态和促进肾纤维化[23]。研究发现,CKD患者尿液外泌体中miR-29c显著升高,且与肾小管间质纤维化程度呈正相关[24]。
另一方面,外泌体可抑制肾脏纤维化。骨髓MSC外泌体分泌的miR-let7c可下调单侧输尿管梗阻小鼠肾脏中的胶原IVα1、金属蛋白酶9、TGF-β1和TGF-β1型受体水平,并抑制大鼠肾小管导管上皮细胞中促纤维化基因的表达,从而减弱肾脏纤维化[25]。人脐带MSC外泌体通过CK1δ/β-TRCP信号传导途径增强yes相关蛋白(YAP)的泛素化和降解,以减轻胶原蛋白沉积和肾纤维化[26]。人脂肪MSC外泌体激活TECs上的管状Sox9,阻止TGF-β1诱导的TECs向促纤维化表型的转化,从而减缓肾纤维化的进程[1]。
EVs负载药物干预疾病进展
炎症是肾脏疾病进展的关键病理改变,然而免疫抑制剂具有靶向不准、毒副作用较多的缺点。EVs具有稳定的细胞间靶向通讯的作用,被视为天然的纳米级药物载体,其作为载体可改善药物药代动力学,减少毒副作用,相对于人工合成的纳米载体而言,具有足够时长的循环半衰期,并可穿透组织深处和逃避免疫系统的清除。在AKI中应用EVs负载药物能起到有效的抗炎作用。EVs负载姜黄素可瞬时增加促炎性细胞因子(IL-6、IL-1β、TNF-α)基因的表达,并抑制雌二醇的产生和CYP19A1基因的表达,减轻脂多糖介导的炎症,从基因层面抑制炎症[27]。IL-10是一种强大的免疫调节剂,负载IL-10的EVs表面富含整合素α1β1、L2和M2等黏附分子,可靶向作用于TECs并抑制雷帕霉素信号转导,促进线粒体适应性反应,也可靶向作用于肾小管间质中的巨噬细胞,驱动M2型巨噬细胞极化,从而显著改善肾小管萎缩、TECs变平和脱落、炎性细胞浸润和纤维化[28]。负载地塞米松的巨噬细胞MVs表面富含整合素αLβ2和α4β1,能靶向作用于肾脏炎症细胞,下调肾脏中TNF、IL-6、IL-β和CCL-2的mRNA表达以及NF-κBp65和p-p65蛋白的表达,从而减轻炎症,另外还可减轻蛋白尿、肾小球病变和肾小管间质损伤,且没有出现明显的糖皮质激素性副作用[29]。在治疗时,选择最佳的供体细胞是建立有效的药物运输系统的前体,目前尚缺乏统一标准,主要以MSC、树突细胞、肿瘤细胞为主,而MSC被认为是较理想的具有免疫调节和治疗的细胞来源[30]。另外,可通过人工修饰增加外泌体的靶向性,如在亲本细胞中导入表达靶向配体和跨膜蛋白域的融合质粒,或在外泌体表面涂覆靶向抗体。
小结与展望
在AKI中,不同来源的外泌体具有双重作用,既有促进疾病发展的外泌体,也有治疗疾病的外源性外泌体,其功能的体现取决于不同外界刺激和起源细胞种类的不同。临床研究已证实外泌体可通过靶向治疗延缓AKI向CKD转变。外泌体亦可作为非侵入性生物标志物用于诊断疾病和评估疾病预后。然而,目前外泌体负载药物治疗的临床研究较少,且外泌体分离技术还不能保证分离的纯度、速度,也不具备同时处理大量样品的能力。随着研究的深入,一种基于中空纤维生物反应器的3D外泌体培养系统已问世,可以连续高效地生产外泌体,大大提高了外泌体收集效率,并在治疗顺铂诱导的AKI中体现出了强大的肾脏保护能力[31]。外泌体的研究和应用为纳米医学的发展提供了机遇,我们相信功能型外泌体作为药物载体的局限性会被逐步攻克,将为临床诊疗疾病提供新思路和新方法。

