胆固醇结晶诱导的炎症及肾脏损害
李溪玥 吴 丹 综述 曾彩虹 审校
胆固醇结晶相关肾损害包括胆固醇结晶栓塞性肾病和肾小管间质胆固醇结晶相关损害。动脉粥样硬化病变早期,胆固醇在动脉内皮下的积聚导致泡沫细胞的形成,过量的胆固醇在细胞中积聚可形成胆固醇结晶。胆固醇结晶的形成是晚期动脉粥样硬化斑块的特征。覆盖斑块的纤维帽破裂后,斑块内的胆固醇结晶暴露在血液循环中,导致小动脉管腔狭窄或闭塞并激活炎相关症因子引发局部和全身炎症反应。病变可累及肾脏、皮肤、胃肠道、眼睛、中枢神经系统等,肾脏是胆固醇结晶栓塞的常见靶器官。肾小管胆固醇晶体和肾间质胆固醇肉芽肿也并不少见,但具体机制尚缺乏深入研究。本文拟简介胆固醇在细胞内代谢过程,动脉粥样硬化斑块内胆固醇结晶形成原因,胆固醇结晶诱导炎症的细胞和分子机制和其对肾脏损害的表现。
细胞内胆固醇代谢
胆固醇是哺乳动物细胞膜的重要脂质成分,可维持膜的完整性和流动性,脂质筏是富含胆固醇和鞘磷脂的一种特殊膜结构,膜流动性更低。胆固醇的合成、摄取、外排、转化、酯化和运输由复杂的网络维持。细胞内胆固醇含量主要受羟甲基戊二酰辅酶A还原酶(HMG-CoA)活性和细胞从循环中摄取脂质速率的影响。HMG-CoA是胆固醇合成的限速酶,胞内胆固醇过载时该酶则受到抑制。胆固醇在血浆中主要以与极低密度脂蛋白(VLDL)及低密度脂蛋白(LDL)结合成胆固醇酯(ESC)的形式存在。胆固醇酯与细胞膜上的LDL受体(LDLR)、清道夫受体B族I型(SR-BI)、和CD36等受体结合后内吞进入细胞,经溶酶体酶解后,上述受体返回细胞膜,而ESC进一步水解为游离胆固醇(FC)滞留在细胞内,当细胞内FC浓度过高时,可通过负反馈调节机制降低上述受体的合成以维持细胞内正常的胆固醇浓度[1]。胆固醇的逆向转运即荷脂细胞将胆固醇分泌至细胞外的过程,涉及的主要因子有高密度脂蛋白(HDL)、载脂蛋白AI(ApoAⅠ)、凹陷蛋白、腺苷三磷酸结合元件A1(ATP binding cassette A1,ABCA1)和SR-BI等。ABCA1是介导胆固醇流出的最重要膜调控蛋白,可引起细胞表面脂筏的破坏,使细胞表面相关受体的聚集受到影响,易化炎症信号传导。HDL可促进过氧化物酶体增殖剂激活受体γ(peroxisome proliferator-activated receptorγ,PPAR-γ)的磷酸化,从而提高ABCA1的表达进而降低细胞内脂质含量。
动脉粥样硬化斑块中的胆固醇结晶形成
动脉粥样硬化斑块中的脂质主要由胆固醇、磷脂以及少量的三酰甘油和脂肪酸组成,胆固醇本身具有形成结晶的特性,当溶液中的浓度超过其溶解度,则以水化合物的形式析出形成结晶,体积膨胀。胆固醇的量越多,体积膨胀得越大[2],而斑块纤维帽则相应变薄,当纤维帽厚度<65 μm时斑块可能破裂[3]。斑块的形成是一个动态演变过程,在脂肪条纹向纤维斑块转变期间,胆固醇结晶开始形成[4],胆固醇结晶可在斑块坏死核心、内皮下及巨噬细胞内外出现。酰基辅酶A-胆固醇酰基转移酶(ACAT)催化FC和长链脂肪酸合成ESC,将FC转化为酯化状态,LDL颗粒中的胆固醇以酯化形式存在。斑块的形成始于胆固醇与LDL颗粒结合进入动脉壁内触发免疫反应,募集巨噬细胞到该区域,并大量摄取酯化胆固醇形成泡沫细胞。ESC在胆固醇酯水解酶(CEH)的作用下水解为FC,FC在动脉壁内积聚易形成胆固醇结晶[5]。酯化和反酯化平衡的破坏会导致泡沫细胞中的ESC/FC的积累。动脉粥样硬化早期,胆固醇结晶还可诱导血管内皮钙黏蛋白和α连环蛋白酪氨酸磷酸化增强,从而破坏血管内皮细胞间黏附连接并增加血管通透性。消退素D1(resolvin D1,RvD1)作为一种特异性促炎症消退介质,可以保护内皮细胞屏障功能不受胆固醇结晶破坏[5]。KellnerWeibel等[6]证实抑制ACAT可导致巨噬细胞泡沫细胞质膜双层中胆固醇一水合物晶体的形成。
胆固醇结晶诱导炎症反应的细胞分子机制
巨噬细胞表达多种细胞表面受体如C型凝集素受体(CLR)等以识别和内化致病性颗粒。CLR是一种新发现的模式识别受体家族,可识别病原体启动先天性免疫应答。人巨噬细胞诱导型C型凝集素受体(hMincle)是在活化的巨噬细胞和树突状细胞上表达的CLR。Kiyotake等[7]研究证实hMincle有一个胆固醇识别氨基酸序列(CRAC),通过该序列,胆固醇结晶与巨噬细胞表面的hMincle结合,从而引发先天免疫反应。hMincle通过与FcRγ链[一种基于免疫受体酪氨酸激活序列(ITAM)的接头蛋白]偶联以激活免疫细胞。有研究证明巨噬细胞和树突状细胞内胆固醇晶体可激活Nod样受体蛋白3(NLRP3)[30]。
补体通过感知危险、传递危险信号及触发细胞碎片的清除,在体内平衡中发挥重要作用。胆固醇结晶可被补体系统的凝集素途径和经典途径识别,从而激活C3和C5并释放炎性介质C5a片段。补体被胆固醇结晶激活后,与NLRP3炎症小体-caspase-1信号通路产生串扰并产生白细胞介素1β(IL-1β)。体外实验表明,胆固醇结晶可通过与甘露糖结合凝集素(MBL)和纤维胶凝蛋白2(ficolin-2)结合激活凝集素途径,从而导致补体激活产物的沉积[8-9]。在胆固醇结晶诱导的补体激活过程中,凝集素途径和经典途径有协同作用。胆固醇结晶对补体的强大激活潜能可将免疫细胞招募到斑块中促进胆固醇结晶形成,从而导致局部炎症。补体在细胞碎片和巨噬细胞聚集的区域与胆固醇结晶结合,吸引更多的免疫细胞进入胆固醇结晶[10]。胆固醇结晶启动补体激活途径后可释放促炎细胞因子如肿瘤坏死因子(TNF)和IL-1β。在人类全血模型中C5aR1拮抗剂对胆固醇结晶诱导的TNF和IL-1β有很强的抑制作用[11],由此可见C5a在这一反应中起主要作用。
嗜中性粒细胞和单核细胞衍生的巨噬细胞具有共同的造血祖先髓样细胞,它们具有共同和独特的免疫功能。当组织损伤或感染时,中性粒细胞首先浸润,随后是单核细胞。Brinkmann等[12]在2004年发现中性粒细胞坏死或者凋亡后,可释放一种网状物质来捕获、杀灭细菌,他们将其命名为中性粒细胞胞外诱捕网(neutrophil extracellular trap,NET)[12],这一过程命名为NET凋零[12]。NET包含DNA、组蛋白、嗜中性粒细胞弹性蛋白酶和髓过氧化物酶。晶体颗粒以受体相互作用蛋白1-受体相互作用蛋白3-混合系激酶区域样蛋白(RIPK1-RIPK3-MLKL)依赖的方式触发中性粒细胞坏死进而释放NET[13]。Warnatsch等[14]证明,细胞外胆固醇晶体与中性粒细胞相互作用触发NETs的释放,引发巨噬细胞产生炎性细胞因子IL-1β的前体(pro-IL-1β)。除了激活NETosis外,与巨噬细胞表面CD36蛋白结合的胆固醇可通过内吞作用被内化并激活炎症小体信号复合物。炎症小体通过caspase-1裂解pro-IL-1β促进IL-1β的成熟并释放到胞外发挥其生物学效应[14]。
NLRP3炎症小体是由NLRP3亚基、与凋亡相关的斑点样蛋白(apoptosis-associated speck-like protein containing a caspase recruitment domain,ASC)和无活性的caspase-1前体组成的蛋白复合物。NLRP3亚基由亮氨酸富集结构域(LRR)、Nod结构域和热结构域(PYD) 或caspase募集结构域(CARD)组成,可识别配体、介导自身聚集反应及转导下游信号。在受到刺激时,NLRP3炎症小体通过NLRP3-ASC-caspase-1-IL-1β/IL-18 轴的逐级活化在炎症免疫性疾病过程中发挥了关键作用。目前研究表明有多种不同的炎症小体激活机制,包括钾外排、钙内流、线粒体功能障碍、线粒体活性氧的产生、线粒体DNA或心磷脂的释放、溶酶体的不稳定和破裂[15]。已证明NLRP3炎症小体对胆固醇结晶等刺激有应答。NLRP3炎症小体发挥作用需要双重信号的刺激,第一信号为预刺激信号,通过活化MAPK和核因子κB(NF-κB)信号途径而上调NLRP3和 IL-1β、IL-18 前体的表达;第二信号又称活化信号,NLR的寡聚化及变构进而募集 ASC,活化 caspase-1促使pro-IL-1β活化为IL-1β并释放[16]。IL-1β是一种强有力的促炎细胞因子,是动脉粥样硬化的主要致病细胞因子,并与疾病的严重程度有关[17]。IL-1β通过减少ABCA1的表达抑制胆固醇向细胞外流出,从而提高细胞内胆固醇的浓度。在NLRP3基因敲除的糖尿病肾病小鼠模型研究中,敲除鼠的肾小管上皮细胞的空泡变性轻于对照组,提示NLRP3可增加细胞脂质负载[18]。有研究表明,被吞噬的颗粒导致溶酶体膜破裂后可引起NLRP3激活和细胞死亡[19-20]。针对组织蛋白酶b的特异性抑制剂可抑制NLRP3活化所致的细胞死亡和IL-1β分泌[21-23]。目前还发现了多种组织蛋白参与IL-1β产生,并促进pro-IL-1β的合成和NLRP3依赖的pro-IL-1β的活化[24]。
动脉粥样斑块破裂后,针对动脉内膜损伤,淋巴细胞局部反应性产生IL-6,IL-6循环到肝脏启动超敏C反应蛋白的合成,从而导致全身炎症反应[25],可出现贫血、血小板减少、白细胞增多、红细胞沉降率高、 C反应蛋白水平升高、低补体血症等。
胆固醇结晶栓塞性肾病
主动脉或其他大动脉的动脉粥样斑块破裂后,胆固醇结晶暴露于血液循环中并向下游血管床冲淋,引起动脉远端栓塞即称为胆固醇晶体栓塞或称动脉粥样硬化栓塞,导致远端组织的缺血和梗死。胆固醇晶体栓塞可能自发,但通常由动脉造影或血管内手术操作引起的医源性诱因所致。胆固醇晶体栓塞作为一种多系统疾病,可累及肾脏、皮肤、胃肠道、眼睛、中枢神经系统等多脏器,肾脏血流动力学的特性使其成为最易受累的器官。胆固醇结晶常阻塞弓形动脉和叶间动脉,从而导致整个肾单位的皮质区域缺血,造成肾损伤、肾功能下降,出现胆固醇晶体栓塞性肾病。胆固醇结晶栓塞性肾病临床表现分为急性、亚急性和慢性。急性、亚急性形式表现为肾功能突然下降,由不稳定斑块突然破裂后大量胆固醇晶体栓子堵塞到肾小动脉所致。慢性胆固醇结晶栓塞性肾病临床起病缓慢,与破裂的斑块内胆固醇晶体频繁而缓慢的迁移有关。当肾脏发生小的胆固醇晶体栓塞时,患者可不出现临床症状。慢性胆固醇晶体栓塞性肾病与其他慢性肾脏疾病(如慢性肾小球硬化、高血压性肾硬化)的症状相似,仅依据临床鉴别诊断较为困难,需肾活检进一步明确。皮肤表现是胆固醇结晶栓塞最常见的临床症状,如网状青斑、坏疽、蓝脚趾综合症等。当出现特征性的蓝脚趾综合症时,临床上需考虑可能累及肾脏损伤。
肾小管间质与胆固醇结晶
细胞膜的流动性主要由膜磷脂和胆固醇构建。在培养皿中,晶体可在细胞间紧密连接破坏后附着于肾小管上皮细胞,提示正常细胞膜的极性丧失可能是晶体-膜相互作用所需的条件[26]。Hirose等[27]最近研究草酸钙晶体形成早期肾小管细胞的超微结构变化,因氧化应激和脂质过氧化,使线粒体表现为空泡化、脂质变化和钙化,随后可在肾小管管腔中观察到晶核形成。人肾小管上皮细胞株HK-2在高糖培养下可出现胆固醇蓄积现象[28]。
在肾脏活检标本中可观察到在肾小管或肾动脉内胆固醇结晶表现为狭长、两头尖、腰部凸的梭形空隙[29]。1985 年Nast等[30]在5例肾病综合征患者肾活检标本中观察到肾间质中胆固醇肉芽肿形成,认为其与肾小管胆固醇晶体之间存在联系。上述5例患者肾小管细胞中均含有脂滴,因此他们认为胆固醇晶体最初可能来源于肾小管上皮内的脂质。胆固醇或ESC在肾小管上皮细胞内持续沉积可能导致胞内胆固醇晶核的形成。尿液中的胆固醇过饱和也可能形成小的胆固醇结晶。当上皮细胞内较大的晶体形成后可在其临近管腔内也发现胆固醇结晶。目前关于细胞内晶体释放到管腔内的机制尚未明确,而胆固醇结晶一旦从上皮细胞内进入管腔,晶体在管腔内可进一步扩大伸长或者随尿液排出。针状的胆固醇结晶达到一定的长度后可以在肾小管某个位置被卡住,尖锐边缘可以扭曲破坏肾小管上皮细胞,并穿透基膜,随后暴露于间质单核细胞形成胆固醇肉芽肿(图1)。此后有关肾小管中胆固醇结晶的相关报道极少。Hu等[31]研究表明,炎症通过上调血清CXC趋化因子配体16途径促进了肾小管间质中脂质的蓄积并导致肾小管间质损伤。
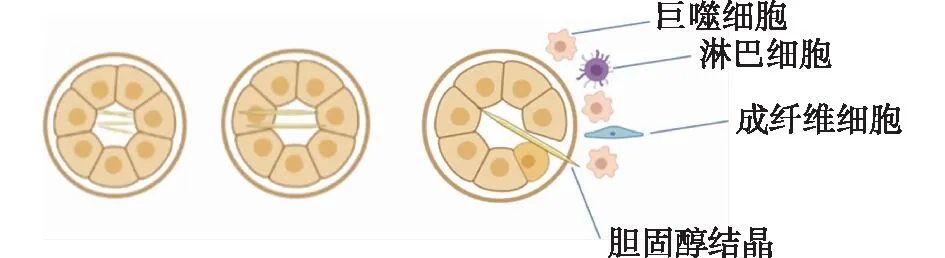
图1 胆固醇结晶诱导肾脏损害的机制
针状的胆固醇结晶在肾小管腔中逐渐增大后陷入肾小管上皮细胞最终刺破肾小管基膜后引发巨噬细胞、淋巴细胞介导的炎症反应,肾间质成纤维细胞激活转变为肌成纤维细胞。
小结:脂质代谢紊乱造成胆固醇蓄积进而形成结晶诱发炎症,可导致多种疾病的发生和进展。胆固醇稳态通常由胆固醇流入和胆固醇外排途径控制,一旦胆固醇稳态被破坏,随着胆固醇或ESC的持续沉积,细胞内胆固醇过饱和可形成胆固醇结晶,引起单核吞噬细胞等介导的炎症反应,炎症应激也可反向诱导脂质蓄积而加剧肾脏损伤。肾脏疾病伴脂质代谢异常的患者在临床并不少见,肾病综合征中肾小管胆固醇结晶也并非罕见的病理改变。因此,在临床诊治过程中应予以重视,尤其是肾小管内的胆固醇结晶,以便早期发现早期诊治。

