雷帕霉素及其衍生物治疗局灶节段性肾小球硬化
王斯斯 综述 管 娜 审校
局灶节段性肾小球硬化(FSGS)是导致终末期肾病的常见肾小球疾病,主要表现为激素耐药型肾病综合征(NS),治疗困难,治疗药物有限,亟待探讨新的治疗药物[1-3]。近年研究证实,哺乳动物雷帕霉素靶蛋白复合物1(mTORC1)通路过度活化可介导FSGS足细胞损伤机制,雷帕霉素(RAPA)及其衍生物如依维莫司可通过抑制过度活化的mTORC1保护足细胞,理论上有治疗FSGS的应用前景,本文对相关研究进展加以综述[4]。
mTORC1概述
mTORC1是由哺乳动物雷帕霉素靶蛋白(mTOR)、哺乳类致死SEC13蛋白8(mLST8)、mTOR调节相关蛋白(Raptor)、富含脯氨酸的Akt底物和包含DEP域的与mTOR相互作用的蛋白等组成的复合物[5]。mTOR是289 kDa的蛋白激酶,属于磷脂酰肌醇3-激酶相关激酶家族成员,是mTORC1中最重要的功能蛋白。mTOR起到分子感受器的作用,在多种信号刺激下,mTOR通过磷酸化下游底物核糖体蛋白S6磷酸激酶1(S6K1)和4E结合蛋白1(4E-BP 1)调控与细胞生长、增殖、代谢和死亡相关的关键蛋白的基因转录和蛋白质合成。mTORC1主要受磷脂酰肌醇3激酶(PI3K)和腺苷酸活化蛋白激酶(AMPK)调控,受结节性硬化复合物1/结节性硬化复合物2(Tsc1/Tsc2)抑制[6]。mTORC1参与调控蛋白质、核酸、脂质和其他大分子的生成,抑制分解代谢过程,如自噬和溶酶体生成,是调控细胞生长、增殖、代谢和死亡的核心机制(图1)[5]。

图1 mTORC1信号通路及功能PI3K:磷脂酰肌醇-3-激酶;Akt:蛋白激酶B;AMPK:腺苷酸活化蛋白激酶;mTORC1:哺乳动物雷帕霉素靶蛋白复合物1;4E-BP:4E结合蛋白;S6K1:核糖体蛋白S6激酶1;ULK:unc-51类自噬激活激酶;SREBP:固醇调节元件结合蛋白;PGC-1α:过氧化物酶体增殖物激活受体γ辅激活因子1α
mTORC1与足细胞损伤
mTORC1的适度活化是维持足细胞正常形态的必要条件。足细胞特异性Raptor敲除(RaptorΔpodocyte)小鼠足细胞mTORC1活化标记物pS6减少,足突融合[7]。mTORC1可通过抑制自噬维持足细胞基础自噬功能;调控WT1表达影响足细胞完整性;调控足细胞血管内皮生长因子(VEGF)生成影响肾小球滤过屏障功能;调控丙酮酸激酶M2影响足细胞分化,调控足细胞裂孔隔膜分子nephrin、瞬时受体电位阳离子通道蛋白6和细胞骨架接头蛋白Nck表达,影响足细胞细胞黏附性和迁移[8-11]。
mTORC1过度活化参与FSGS发病机制。在阿霉素(ADR)诱导小鼠足细胞损伤模型、ADR小鼠肾病模型和FSGS患者均观察到mTORC1过度活化现象[4,12]。来自基因敲除模型进一步证实,特异性敲除足细胞mTORC1负性调节因子Tsc1使mTORC1过度活化确实可致小鼠出现FSGS病变和蛋白尿[4,12-13]。
目前尚缺乏足细胞系对mTORC1过度活化引起的下游机制的研究。在小鼠模型中,mTORC1过度活化导致足细胞数量减少、足细胞脱落、足细胞肥大、足突融合、裂孔隔膜分子nephrin表达量正常但不能正常定位至裂孔隔膜部位、足细胞向成纤维细胞表型转换等,其中足细胞表型转换被认为与足细胞脱落有关[4,12-13]。
动物模型研究显示RAPA及其衍生物可显著减轻蛋白尿和FSGS。预防性应用RAPA或ADR注射后1~2周出现蛋白尿时治疗性应用RAPA均显著改善了ADR小鼠肾病模型蛋白尿及肾小球硬化[4,14]。在ADR大鼠肾病模型中,预防性或治疗性应用依维莫司均显著改善了蛋白尿[15]。在mTORC1过度活化所致小鼠肾病模型中,RAPA显著改善足细胞功能分子nephrin的分布、足突融合和蛋白尿[13]。在ADR小鼠肾病模型中,敲除一个Raptor等位基因可抑制过度活化的mTORC1,改善肾小球硬化和蛋白尿[4]。上述证据表明抑制过度活化的mTORC1可能成为新的足细胞保护靶点(图2)。
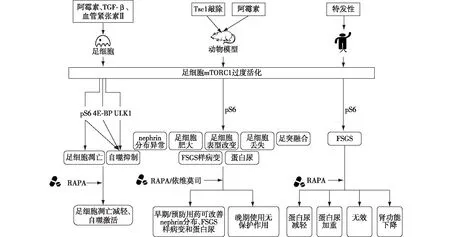
图2 mTORC1过度活化与足细胞损伤和FSGSTGF-β:转化生长因子-β;Tsc1:结节性硬化复合物1;mTORC1:哺乳动物雷帕霉素靶蛋白复合物1;pS6:磷酸化核糖体蛋白S6;4E-BP:4E结合蛋白;FSGS:局灶节段性肾小球硬化;RAPA:雷帕霉素;ULK1:unc-51类自噬激活激酶1
RAPA及其衍生物在FSGS的临床研究现状
RAPA于1964年被发现,之后其衍生物如依维莫司和坦西莫司等陆续被研发[5]。此类药物与FK506结合蛋白12结合后作用于mTOR激酶的FRB结构域,阻止mTOR激酶与特异性底物结合从而抑制mTORC1活性[16-18]。由于只有mTORC1复合物的FRB结构域可与RAPA及其衍生物结合,因此RAPA及其衍生物主要是mTORC1抑制剂。由于具有免疫抑制作用,RAPA于1999年被美国食品药品管理总局批准临床上用于器官移植患者[19],目前也被用于肾脏肿瘤和多囊肾患者[16-18]。
迄今主要有4篇研究(3篇成人和1篇儿童)报道了RAPA用于治疗激素耐药型NS或FSGS,结果不一(表1)[20-23]。Tumlin等[20]报道了RAPA治疗21例成人激素耐药型FSGS患者的前瞻性开放标签临床试验,治疗6个月后缓解率为57%。1例治疗前肾皮质间质纤维化达70%者治疗期间出现肾功能进行性下降。Tsagalis等[21]报道甲泼尼龙联合RAPA治疗3例成人原发性FSGS患者,治疗后均获缓解,肾功能未受影响。Liern等[22]报道RAPA治疗13例表现为激素耐药型NS且钙调磷酸酶抑制剂、环磷酰胺以及依那普利或氯沙坦治疗无效的原发性FSGS患儿,疗程 12个月,69%达完全或部分缓解。观察到的RAPA主要不良反应为高脂血症、贫血、口腔溃疡和胃肠道反应等。上述研究为RAPA进一步用于FSGS的治疗提供了临床证据。
然而,1项RAPA治疗FSGS患者的2期开放标签临床试验显示RAPA可加重一些患者病情[23]。该研究纳入了6例原发性FSGS成人患者,经8.0±3.0个月治疗后6例蛋白尿均未缓解,5例在用药后1~5个月出现肾功能下降,2例停用RAPA后2~7天肾功能恢复。其中2例因治疗后肾功能下降行肾活检发现严重的间质纤维化、肾小管萎缩和急性肾小管坏死。由于患者在用RAPA前未行肾脏病理检查,不能排除所发现肾脏病理改变与FSGS进展有关。此外,来自其他疾病的研究也报道了RAPA的肾脏不良反应,限制了其在FSGS的进一步应用。
RAPA的不良反应及机制
蛋白尿来自肾移植患者的研究报道蛋白尿是RAPA主要不良反应之一,被认为与高剂量应用RAPA有关。Loriga等[24]报道高剂量依维莫司与蛋白尿显著相关。Letavernier等[25]报道3例肾移植患者用高剂量RAPA(血药浓度15.8~17.1 ng/L)后出现NS和FSGS。RAPA相关蛋白尿主要是肾小球性蛋白尿。RAPA也抑制肾小管上皮细胞对白蛋白的重吸收,下调cubilin和megalin表达,该作用可被ACEI逆转[26]。RAPA相关肾小球性蛋白尿的机制被认为与抑制VEGF表达、裂孔隔膜分子表达和足细胞线粒体腺嘌呤核苷三磷酸(ATP)合成以及治疗时机的选择有关。

过度抑制mTOR活性mTOR维持适度活化是足细胞维持正常功能的前提。基因敲除模型证实,仅部分抑制过度活化的mTOR具有足细胞保护作用,而完全抑制mTOR活性可导致足细胞损伤和蛋白尿[4]。
抑制VEGF VEGF对足细胞生存和分化有重要作用。Letavernier 等[25]发现,在RAPA诱发的FSGS病变中,VEGF局灶性表达缺失。培养的人足细胞用治疗浓度的RAPA处理后,VEGF合成和蛋白激酶B磷酸化显著降低,发生细胞骨架重排和细胞表型变化[9]。RAPA抑制VEGF信号通路导致足细胞VEGF通路紊乱被认为与蛋白尿有关。
抑制足细胞及裂孔隔膜分子表达Stallone等[27]分析了110例应用RAPA的肾移植患者,根据用药后2年内尿蛋白情况将患者分为尿蛋白增多>70%和<70%组,结果发现尿蛋白增多>70%组足细胞裂孔隔膜分子nephrin和podocin显著减少,与RAPA高血药浓度显著相关。体外研究发现,足细胞分子WT1及裂孔隔膜关键分子nephrin、podocin和CD2ap表达与RAPA剂量有关,大剂量应用RAPA及其衍生物导致WT1和裂孔隔膜分子表达减少,破坏足细胞结构完整性[9,27]。然而,关于上述分子在RAPA肾脏不良反应中的作用也有不同的观点。Kim等[28]用高低不同剂量RAPA作用于C57BL/6小鼠,尽管观察到RAPA导致足细胞相关分子WT1、synaptopodin和nephrin等表达显著下调,但未导致蛋白尿,提出RAPA对上述足细胞分子的抑制作用不足以诱发蛋白尿。
抑制足细胞线粒体ATP合成Zschiedrich等[4]发现低剂量mTOR抑制剂不影响足细胞线粒体ATP合成,可减轻ADR诱导的足细胞线粒体功能障碍,而高剂量mTOR抑制剂显著抑制了足细胞线粒体ATP合成,加重了ADR诱导的足细胞线粒体功能障碍,提示对线粒体功能影响不同可能介导了mTOR抑制剂产生的不同足细胞和蛋白尿效应。
自噬障碍mTORC1为负性自噬调节因子。RAPA可抑制mTORC1使足细胞自噬增强和自噬溶酶体再循环障碍,自噬体和自噬溶酶体堆积,从而导致自噬循环障碍,受损线粒体清除障碍。mTOR过度抑制小鼠表现为蛋白尿、足细胞空泡变性和肾小球硬化改变,电镜下可见足细胞自噬体和自噬溶酶体增多[29]。
治疗时机的选择基因敲除模型研究显示,在疾病早期mTORC1过度活化可导致足细胞肥大。有学者认为,关于RAPA的应用存在治疗窗。在疾病早期足细胞肥大有代偿意义,此时予以RAPA类药物可能与肾损害有关。若足细胞mTORC1持续过度活化,可导致足细胞不可逆的损伤及表型转换,可能更适合RAPA类药物应用[4]。然而,目前尚缺乏用于评估患者RAPA类药物治疗时机的客观评价指标。
肾功能下降高剂量RAPA类药物与肾功能下降有关。Kim等[28]在小鼠实验中证实低剂量(3 mg/kg)RAPA对血清肌酐无影响,高剂量(10 mg/kg,30 mg/kg)RAPA导致血清肌酐显著增高。加重钙调磷酸酶抑制剂(CNIs)肾毒性、诱导肾小管上皮细胞转分化和肾间质纤维化等机制被认为参与RAPA不良反应。
与CNIs有关临床观察到RAPA类药物与CNIs联用时似乎更易出现肾损害,可能与RAPA及其衍生物加重CNIs肾毒性有关[30]。Cho等[23]报道3例用RAPA后出现肾功能快速下降患者中2例在RAPA治疗前曾用环孢素A治疗约3年。
肾小管上皮细胞损伤及肾间质纤维化RAPA可促进肾小管上皮细胞凋亡[31]。高剂量依维莫司可诱导人近端肾小管上皮细胞向间充质细胞转分化,α平滑肌肌动蛋白、波形蛋白、纤维连接蛋白和基质金属蛋白酶9表达增多,而低剂量依维莫司无此作用[32]。Tumlin等[20]报道,1例RAPA治疗后肾功能迅速下降者在治疗前有严重的肾间质纤维化,提示间质纤维化程度可能与用RAPA后肾功能下降有关。
小结:RAPA及其衍生物理论上可通过抑制过度活化的mTORC1保护足细胞治疗FSGS,然而现有临床结果不一,呈现有效、无效、甚至用药后出现蛋白尿或肾功能下降等表现,限制了RAPA在临床的应用。对RAPA效应机制及肾脏不良反应机制的深入研究有助于为临床筛选可能受益于RAPA及其衍生物治疗的患者类型以及指导用药提供理论参考。

