lncRNA MALAT1通过靶向miR-200a对非小细胞肺癌细胞增殖的影响
胡一明 张艺 徐旭燕
咸宁市中心医院 湖北科技学院附属第一医院呼吸与危重症医学科 437100
肺癌是极为常见的恶性肿瘤,其中非小细胞肺癌(non-small cell lung cancer,NSCLC)占所有肺癌的80%~85%[1]。传统上对于NSCLC的治疗多为手术切除、放化疗等综合治疗,其中手术切除可以获得较好的预后,但大部分患者确诊时已处于晚期,总体5年生存率只有15%左右[2-3]。近年来,以吉非替尼为代表的分子靶向治疗在NSCLC治疗中发挥重要作用,但随着疾病进展,其耐药问题仍成为制约疗效的瓶颈。长链非编码RNA(long non-coding RNA,lnc RNA)是一类长度大于200个核苷酸的非编码RNA,多作为肿瘤促癌基因参与调控基因的表达,与多种肿瘤细胞的发生、增殖和转移密切相关[4]。lnc RNA在多种类型肿瘤中呈特异性表达,与肿瘤的生长、转移显著相关。研究发现,lnc RNA是多种肿瘤(如肝癌、胃癌和肺癌等)早期诊断的标志物[5-7]。lncRNA肺腺癌转移相关转录因子1(metastasis associated lung adenocarcinoma transcript 1,MALAT1)作为与肺癌有关的lnc RNA[8],也被认为是肺癌的特异性指标之一[9]。miRNA作为MALAT1的靶基因,在MALAT1生物学功能的发挥中扮演重要角色。近年来研究发现,miR-200a可通过多种信号途径发挥抑癌或促癌作用,但是在NSCLC中lncRNA MALAT1与miR-200a表达之间的关系尚不明确。本文旨在研究NSCLC中lncRNA MALAT1与miR-200a表达之间的关系,为临床NSCLC的诊断、治疗或新药研发提供理论依据。
1 对象与方法
1.1 研究对象 前瞻性研究。收集2016年1月至2019年6月在咸宁市中心医院手术切除的90例原发性NSCLC组织及其癌旁组织,迅速保存在液氮中。其中男42例,女48例;年龄(59.5±6.5)岁,年龄范围为45~80岁;肺腺癌57例,肺鳞癌23例;肺癌TNM分期Ⅰ期28例,Ⅱ期37例,Ⅲ期25例。本研究符合《赫尔辛基宣言》的原则。
1.2 纳入及排除标准 纳入标准:(1)患者均经胸部CT和病理组织学或细胞学检查确诊为NSCLC;(2)既往未接受手术、放疗、化疗、分子靶向治疗及免疫治疗等一切治疗方法;(3)病理资料完整者。
排除标准:(1)既往接受任何手术、放疗、化疗、分子靶向治疗及免疫治疗者;(2)合并免疫系统疾病者;(3)合并其他恶性肿瘤者。
1.3 细胞株 人NSCLC细胞A549购自中国科学院上海细胞研究所。
1.4 主要仪器及试剂 RPMI1640培养基(美国Hyclone公司);胎牛血清(美国Gibco公司);胰蛋白酶(上海生物工程有限公司);Trizol试剂(美国英杰公司);高速冷冻离心机(美国Thermo Fisher公司);PrimeScriptTMRT Master Mix试剂盒及TB GreenTMPremix Ex TaqTM试剂盒(大连宝 生 物 公 司);sh-MALAT1、siRNA-control、miR-200a-mimic、miR-200a inhibitor(上海吉满生物科技有限公司);Lipofectamine 2000(美国Invitrogen公司);引物由上海生工生物工程股份有限公司合成;双荧光素酶测定系统(美国Promega公司);CCK-8试剂盒(美国Promega公司);Annexin-V-FITC/PI凋亡检测试剂盒(美国eBioscience公司);实时荧光定量PCR仪(美国Thermo Fisher公司)。
1.5 实验方法
1.5.1 细胞转染 将肺癌细胞A549培养于RPMI-1640培养基(包含10%胎牛血清+1%双抗)中,5%CO2、37℃恒温箱中孵育72 h,当细胞密度生长到80%时进行传代培养。用胰酶将A549细 胞 消 化 并 铺 板,分 为sh-Ctrl组、sh-MALAT1组、miR-200a-mimic组、miR-200ainhibitor组、sh-MALAT1+miR-200a-inhibitor组和sh-MALAT1+miR-200a-mimic组,按 照Lipofectamine 2000的操作说明书进行转染,将sh-MALAT1和miR-200a-inhibitor分别或同时转染A549细胞,只转染Lipofectamine 2000作为sh-Ctrl组,只 转 染miR-200a-mimic作 为miR-200a-mimic组。
1.5.2 实时荧光定量PCR检测肺癌组织和细胞中MALAT1、miR-200a表达 根据Trizol试剂说明书,采用Trizol法提取NSCLC组织及其癌旁组织和细胞系中的总RNA,分光光度仪测定m RNA浓度,按PrimeScriptTMRT Master Mix试剂盒说明书将样本中的m RNA逆转录为cDNA,并保存于-20℃中备用。采用实时荧光定量PCR法测定NSCLC组织及其癌旁组织和细胞中MALAT1、miR-200a水平。以GAPDH作为内参,引物序列如下。GAPDH正向引物:5'-TTCACCACCATGGAGAAGGC-3',反向引物:5'-GGCATGGACTGTGGTCATGA-3';MALAT1正 向引物:5'-GAAGATAGGCATTTGAGTGGCT-3',反向引物:5'-CTGAAGAGCATT-GGAGATCAGC-3'。PCR
反应体系(20μl):2μl逆转录产物、10μl SYBR Green Mix、正反向引物(10μmol/L)各0.5μl;PCR反应步骤及参数:95℃预变性30 s,95℃变性10 s,60℃退火延伸5 s(共40个循环),每个样本设3个复孔,根据溶解曲线判断产物的特异性。根据测得的CT值,采用2-ΔΔct法计算样本中MALAT1、miR-200a的相对表达量。
1.5.3 MTT法检测A549细胞的增殖 将对数生长期细胞经胰蛋白酶消化后,重悬,以1×103cells/孔接种于细胞培养板,37℃、5% CO2培养7 d后,加入浓度为5 g/L的MTT液10μl,继续培养5 h,吸除上清液,每孔加入150 μl DMSO,室温下搅拌10 min,分别在24、48、72和96 h测定各孔波长490 nm处的吸光度(optical density,OD)值,观察增殖情况。细胞增殖率=(OD实验孔-OD对照孔)/OD对照孔×100%。
1.5.4 流式细胞术检测A549细胞凋亡 将A549细胞培养至对数生长期,用PBS洗涤细胞2~3次,然后用胰蛋白酶消化,再用PBS重悬细胞并调整至细胞密度为1×105cells/ml。吸取细胞悬液1 ml置 于 离 心 管 中,离 心 半 径8.5 cm,4℃1 000 r/min离心10 min,弃去上清;加入预冷的PBS 1 ml重悬细胞,离心后吸弃上清,PBS洗1次;加入Binding Buffer 200μl重悬细胞,加入PI和Annexin-V后充分混匀,室温下避光静置20 min;加300μl结合缓冲液,流式细胞仪检测凋亡细胞,计算细胞凋亡率。
1.5.5 双荧光素酶报告基因法检测MALAT1与miR-200a之间的关系 将miR-200a的3'UTR区构建入海肾荧光素酶报告基因下游区,萤火虫荧光素报告基因作为内参对照基因,与MALAT1共同转染进入A549细胞,然后将A549细胞接种在24孔板中,分别用报告基因载体和miR-200a-mimic转染24 h,根据说明书,进行荧光素酶报告分析;其中miR-200a:5'-GACAGGATTCCAGGAACCAGTGTTT-3';MALAT 1:3'-TGTAGCAATGGTCTATTGTCACAAT-5'。
1.6 统计学分析 本研究数据在SPSS 21.0软件中进行统计学分析,计量资料以x-±s的形式表示,组间差异采用两独立样本的t检验,P<0.05为差异有统计学意义。
2 结果
2.1 NSCLC癌组织和癌旁组织MALAT1表达 NSCLC组织中MALAT1相对表达水平高于癌旁组织,差异有统计学意义(t=4.589,P<0.001),见图1。
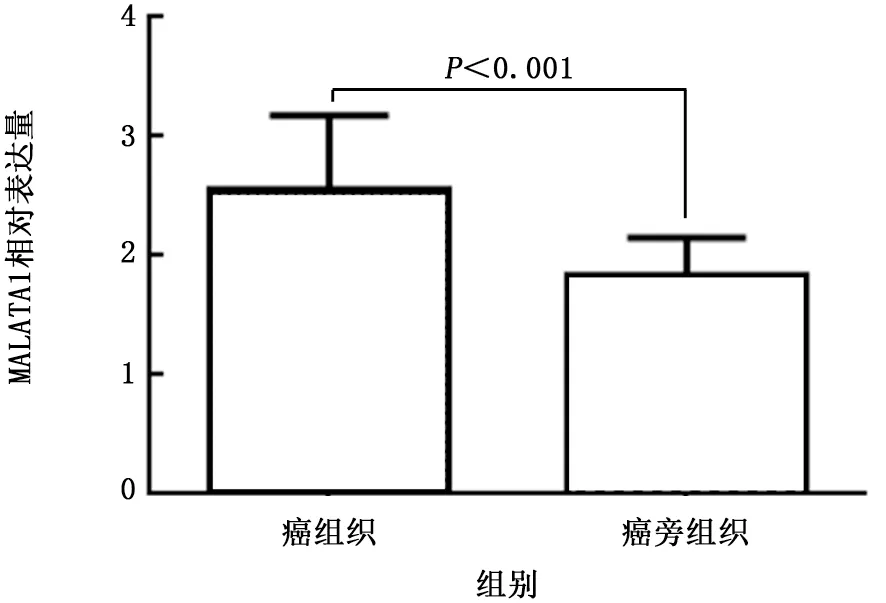
图1 非小细胞肺癌组织和癌旁组织MALATA1表达水平比较
2.2 sh-Ctrl组 与sh-MALAT1组MALAT1表达 与sh-Ctrl组相比,sh-MALAT1组的MALAT 1表达水平降低,差异有统计学意义(t=4.954,P<0.001)。见图2。

图2 sh-Ctrl组与sh-MALAT1组MALAT1表达水平比较
2.3 各组miR-200a表达水平比较 与sh-Ctrl组相比,sh-MALAT1组miR-200a表达水平升高(t=7.908,P<0.001),miR-200a-inhibitor组miR-200a表达水平下降(t=5.187,P<0.001);与sh-MALAT1+miR-200a-inhibitor组 相 比,miR-200a-inhibitor组miR-200a表达水平下降(t=8.571,P<0.001),sh-MALAT1组miR-200a表达水平升高(t=5.284,P<0.001)。见图3。

图3 各组miR-200a表达水平比较
2.4 MALAT1与miR-200a关系 荧光素酶实验结果显示:与sh-Ctrl组相比,miR-200a-mimic组的荧光素酶活性明显下降(t=4.536,P<0.001);而sh-MALAT1组和sh-MALAT+miR-200amimic组的荧光素酶活性比较,差异无统计学意义(t=0.247,P=0.834)。见图4。
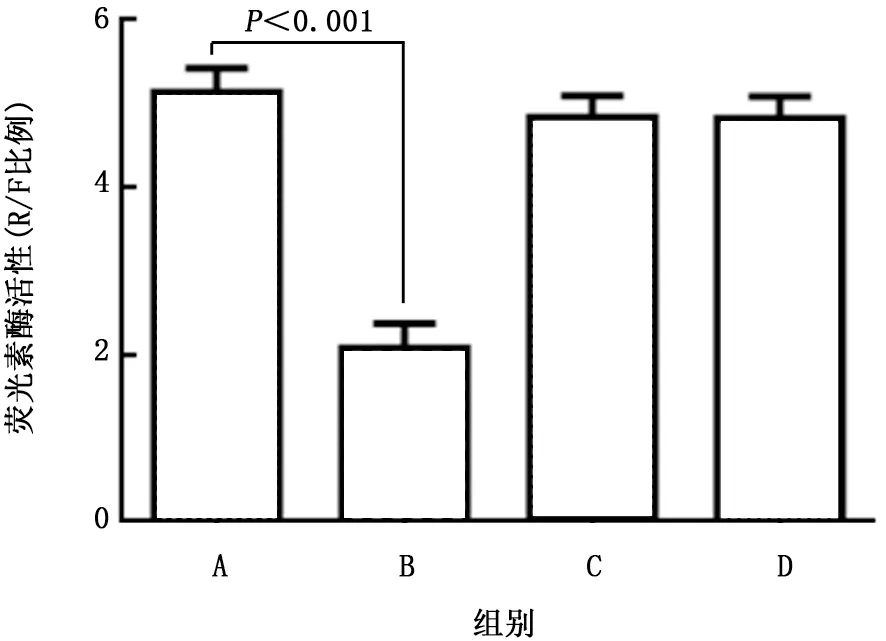
图4 荧光素酶分析MALAT1与miR-200a的靶向关系
2.5 各组A549细胞增殖情况比较 采用MTT法检测MALAT1和miR-200a对A549细胞增殖的影响。与sh-Ctrl组相比,sh-MALAT1组细胞增殖 率 降 低(t=4.158,P<0.001);与sh-MALAT1组 相 比,sh-MALAT1+miR-200ainhibitor组细胞增殖率增加(t=3.895,P=0.001)。见图5。

图5 各组A549细胞增殖情况比较
2.6 各组A549细胞凋亡情况比较 采用流式细胞术检测MALAT1和miR-200a对A549细胞凋亡的影响。与sh-Ctrl组相比,sh-MALAT1组细胞凋亡率升高(t=5.012,P<0.001),miR-200ainhibitor组细胞凋亡率降低(t=3.861,P=0.032);与sh-MALAT1+miR-200a-inhibitor组相比,sh-MALAT1组细胞凋亡率升高(t=3.748,P=0.035),miR-200a-inhibitor组细胞凋亡率下降(t=4.703,P<0.001)。见图6。
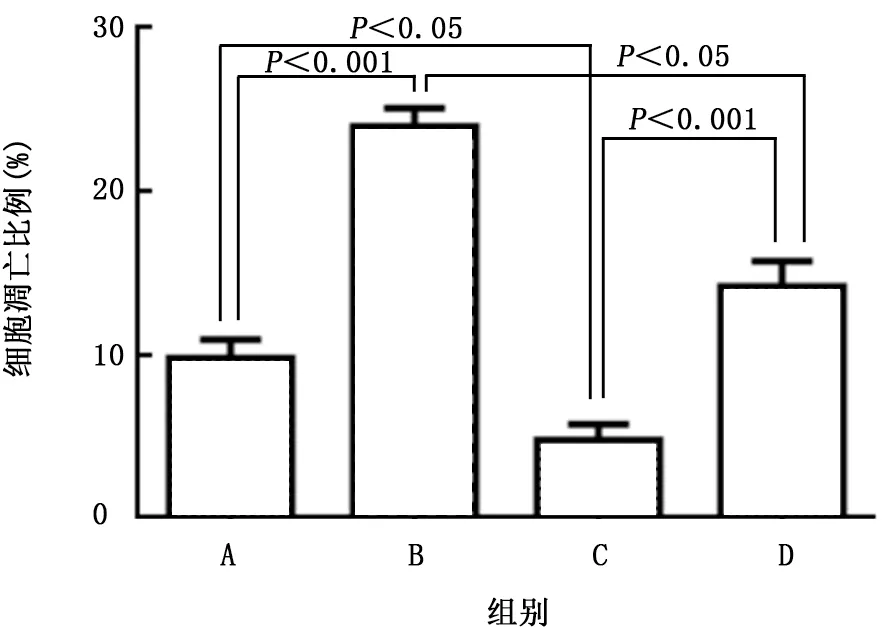
图6 各组A549细胞凋亡情况比较
3 讨论
lncRNA是一类长度为200个核苷酸以上的非编码RNA,本身并不编码蛋白,多以RNA的形式参与机体多种生物学功能的调控,如基因表达的遗传和表观遗传调控、基因表达的转录水平调控等[10-11]。研究发现,lnc RNA不仅在正常细胞增殖分化过程中发挥调控作用,在肿瘤发生、发展等过程中亦具有重要作用[12],恶性肿瘤中普遍存在异常lncRNA表达谱。MALAT1又称核富集转录产物2(nuclear enrichment transcript,NEAT2),是广泛参与基因调控的lnc RNA,可选择性地剪接或干扰基因表达[13]。MALAT1位于染色体11q13.1,被认为是一种潜在的癌基因,可通过多种途径调控肿瘤细胞增殖、侵袭、转移等生物学行为,影响肿瘤的发生、发展[14]。
MALAT1可通过靶向调控miRNA的表达发挥生物学作用[15]。miRNA是广泛存在于真核生物体内的单链非编码小分子RNA,MALAT1可特异性地与靶m RNA 3'UTR序列结合,导致靶m RNA降解或翻译抑制,从而出现转录后负调控靶基因的表达[16]。研究证明,miRNA在肿瘤发生、发展、侵袭、转移等生物学过程有重要作用,与NSCLC增殖、侵袭、转移等密切相关的miRNA包括miR-182、miR-200、miR-145等。其中miR-200a是miR-200家族一员,被认为能调控上皮-间质细胞转化,在某些肿瘤中表达下调促进肿瘤侵袭和转移[17]。
本研究显示,NSCLC组织中的MALAT1表达水平显著高于癌旁组织,提示MALAT1表达上调可能参与NSCLC的发生、发展过程,且其高表达与预后不良相关[18-19]。MALAT1作为Ⅰ期肺腺癌或鳞状细胞癌患者预后的负预测因子,与多种人类肿瘤相关,包括肝癌、肾细胞癌、膀胱癌、结直肠癌和宫颈癌[20]。
目前对于MALAT1的调控机制研究表明,其可以靶向调控miRNA的表达发挥生物学功能,已知的靶基因有miR205、miRNA200a、miR23c等[21-22]。本研究利用siRNA靶向抑制MALAT1后miR-200a的表达水平显著升高,且荧光素酶实验结果显示,在MALAT1突变体细胞中添加miR-200a-mimic对荧光素酶活性无明显影响,提示MALAT1通过单向负调控miR-200a的表达来参与NSCLC的发生、发展过程,这与文献报道的调控机制一致[23]。王亚飞等[24]研究发现,miR-200a在肺癌细胞株中的表达水平低于正常肺上皮细胞株,miR-200a的高表达可下调ECFR和c-MET抑制肺癌细胞迁移和侵袭。
增殖实验显示,抑制MALAT1的表达导致NSCLC细胞的增殖率降低,同时抑制MALAT1和miR-200a的表达后NSCLC细胞的增殖率明显增加,提示MALAT1可以抑制NSCLC细胞的增殖,并可能通过下调miR-200a起作用,该结果与文献报道一致[25]。细胞凋亡实验显示,靶向抑制MALAT1的表达后,NSCLC细胞凋亡率显著升高,当同时抑制MALAT1和miR-200a的表达后NSCLC细胞凋亡率明显下降,提示MALAT1通过靶向miR-200a抑制NACLC细胞的凋亡。其原因可能是MALAT1可以通过MALAT1/miR-200a信号通路来促进恶性肿瘤细胞的生长、迁移和侵袭,当MALAT1表达下降,细胞内的miR-200a表达上升,诱导下游程序性死亡配体表达增加,使肿瘤细胞程序性死亡[26]。许璐等[27]和Guo等[28]研究发现miR-200a在多种恶性肿瘤中通过靶向PI3K/AKT、TRAIL等途径来抑制癌细胞增殖以及促进癌细胞凋亡,这与本研究结果相一致。
综上所述,MALAT1和miR-200a均参与NSCLC的发生、发展过程,其机制可能是MALAT1靶向上调miR-200a来促进NSCLC细胞的增殖以及抑制NSCLC细胞凋亡。因此,MALAT1和miR-200a可以作为NSCLC的潜在诊断或治疗靶标,具有一定的临床应用价值。但是miR-200a调控NSCLC细胞增殖的具体分子机制仍需进一步研究。
利益冲突所有作者均声明不存在利益冲突

