陕西省输入型和二代新型冠状病毒肺炎病例的临床及影像特征分析
石璞玉 任郭侠 杨俊 陈明伟
1西安交通大学第一附属医院呼吸与危重症医学科 710061;2西安市胸科医院中医康复科 710061;3安康市中心医院呼吸与危重症医学科 725000
2020年2月,WHO将新型冠状病毒肺炎命名为COVID-19[1]。随后,国际病毒分类委员会将引发该疾病的新型冠状病毒命名为严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARS-Co V-2)。SARS-Co V-2以呼吸系统为主要靶器官,胸部影像学的特征性表现对于疾病诊断具有重要指导意义,病变范围、大小、变化趋势与疾病严重程度、进展和转归也密切相关。本研究回顾性分析了陕西省内153例输入型和二代感染COVID-19确诊病例的临床资料及CT影像学表现,探讨免疫炎症指标、肺部影像学特征、半定量CT评分与COVID-19病情轻重相关性,肺部病变严重程度、免疫炎症指标与COVID-19后期肺纤维化相关性,以期进一步提高对疾病的的认识和理解,为临床诊治和研究工作提供帮助。
1 对象与方法
1.1 研究对象 回顾性研究。纳入2020年1月23日至2021年4月1日陕西省内9个城市11所医院收治的153例确诊COVID-19病例。本研究通过西安交通大学第一附属医院伦理委员会批准(XJTU1AF2018LSK-021)。诊断标准符合国家卫生健康委员会《新型冠状病毒肺炎诊疗方案(试行第八版)》[2]。鼻咽拭子SARS-Co V-2核酸检测由陕西省疾病预防控制中心完成。根据临床分型标准分为非重症(轻型和普通型)和重症(重型和危重型)患者。轻型为临床症状轻微,影像学未见肺炎表现。普通型为具有发热、呼吸道等症状,影像学可见肺炎表现。重型为符合下列任何一条:(1)呼吸窘迫,呼吸频率≥30次/min;(2)静息状态下,指氧饱和度≤93%;(3)PaO2/吸入气氧浓度(FiO2)≤300 mm Hg(1 mm Hg=0.133 k Pa)。危重型为符合以下情况之一者:(1)出现呼吸衰竭,且需要机械通气;(2)出现休克;(3)合并其他器官功能衰竭需ICU监护治疗[2]。
1.2 研究方法 回顾性分析153例COVID-19患者的流行病学史、临床资料、影像学资料。流行病学资料主要包括性别、年龄、武汉或国外旅居史。临床资料包括基础疾病、并发症、临床结局、Pa O2∶FiO2、血常规、C-反应蛋白(C-reactive protein,CRP)、超敏C-反应蛋白(hypersensitive C-reactive protein,hs-CRP)、ESR、降钙素原、IL-6、乳酸脱氢酶、羟丁酸脱氢酶等免疫炎症指标。影像学资料包括病变范围、磨玻璃影、实变、支气管充气征、铺路石征、白肺、胸腔积液、气胸、肺纤维化、半定量CT评分。
1.3 CT检查方法 CT检查时用指定Toshiba 16排或者Toshiba 64排螺旋CT进行扫描。患者采用仰卧位,头先进,屏气方式进行扫描。扫描范围自胸腔入口至肋膈角以下。扫描参数:管电压120 k V,自动管电流,矩阵512 mm×512 mm,扫描层厚5 mm,层间隔5 mm,1.0 mm薄层重建。采集肺窗及纵隔窗,由2名工作经验丰富的影像科副主任医师在影像存储与传输系统工作站上阅片,分析患者的CT影像特征。CT半定量评分计算方法:基于肺叶计数的评估法,0分表示该肺叶没有病变,1~5分分别表示病变累及肺叶范围<5%、≥5%且≤25%、>25%且≤50%、>50%且≤75%、>75%,最后计算5个肺叶得分之和,满分25分[3]。当判定结果有分歧时,经过双方讨论后达成一致意见。
1.4 统计学分析 采用SPSS 23.0软件对数据进行统计学分析。计量资料和计数资料、等级资料分别以M(QR)(不符合正态分布)和例数(%)表示;计量资料、等级资料采用Mann-WhitneyU法进行统计学差异分析,计数资料采用χ2检验或Fisher确切概率法进行统计学差异分析。P<0.05为差异有统计学意义。
2 结果
2.1 流行病学特点 153例患者中,68例(44.4%)为输入型病例,85例(55.6%)为本地区 二 代 病 例,男74例(48.4%),女79例(51.9%),男女比例1∶1.06;年龄范围为4~89岁,年龄45(27)岁;发病到就诊的时间为5(4)d;65例(42.5%)并存基础疾病,包括高血压24例(15.7%),糖尿病9例(5.9%),心血管疾病6例(3.9%),脑血管疾病6例(3.9%),恶性肿瘤6例(3.9%),慢性呼吸系统疾病(COPD、支气管哮喘、支气管扩张)6例(3.9%),慢性肝病6例(3.9%),妊娠1例(0.7%),获得性免疫缺陷综合征1例(0.7%)。非重症病例99例(64.7%),其中 包 括 轻 型10例(6.5%),普 通 型89例(58.2%);重 症病例54例(35.3%),包括 重 型52例(34.0%),危 重 型2例(1.3%)。15例(9.8%)患者出现并发症(包括心律失常4例、ARDS 3例、急性肾损伤3例、呼吸机相关性肺炎2例、多器官功能障碍2例、休克1例),机械通气2例(1.3%),死亡1例(0.7%)。
2.2 临床和实验室特征 153例患者中,26例(17.0%)表 现 为 白 细 胞 计 数 减 低,69例(45.1%)表现为淋巴细胞计数减低,CRP、hs-CRP、ESR、IL-6的中位数高于正常上限。与非重症组相比,重症组CRP、hs-CRP、ESR、乳酸脱氢酶、羟丁酸脱氢酶的水平明显增高,淋巴细胞计数、PaO2∶FiO2明显减低(P值均<0.05),见表1。
2.3 影像表现 如图1所示,143例(93.5%)患者出现了胸部CT影像学异常,其中41例(26.8%)表现为单肺病变,102例(66.7%)表现为双肺病变,以肺野外带、胸膜下分布的磨玻璃影为典型的特征性的影像表现。28例(18.3%)合并肺实变影,其中5例(3.3%)合并支气管充气征,26例(17.0%)出现磨玻璃影融合、铺路石征,2例(1.3%)进展为白肺,6例(3.9%)出现胸腔积液,1例(0.7%)出现气胸。随着渗出或实变影的吸收,77例(50.3%)患者胸部影像学出现纤维条索影或肺纤维化。另外,与非重症患者相比,重症患者双侧肺磨玻璃影、胸腔积液、肺纤维化发生率明显增高(P值均<0.05)。重症组半定量CT评分明显高于非重症组(Z=-6.547,P<0.001),见表1。
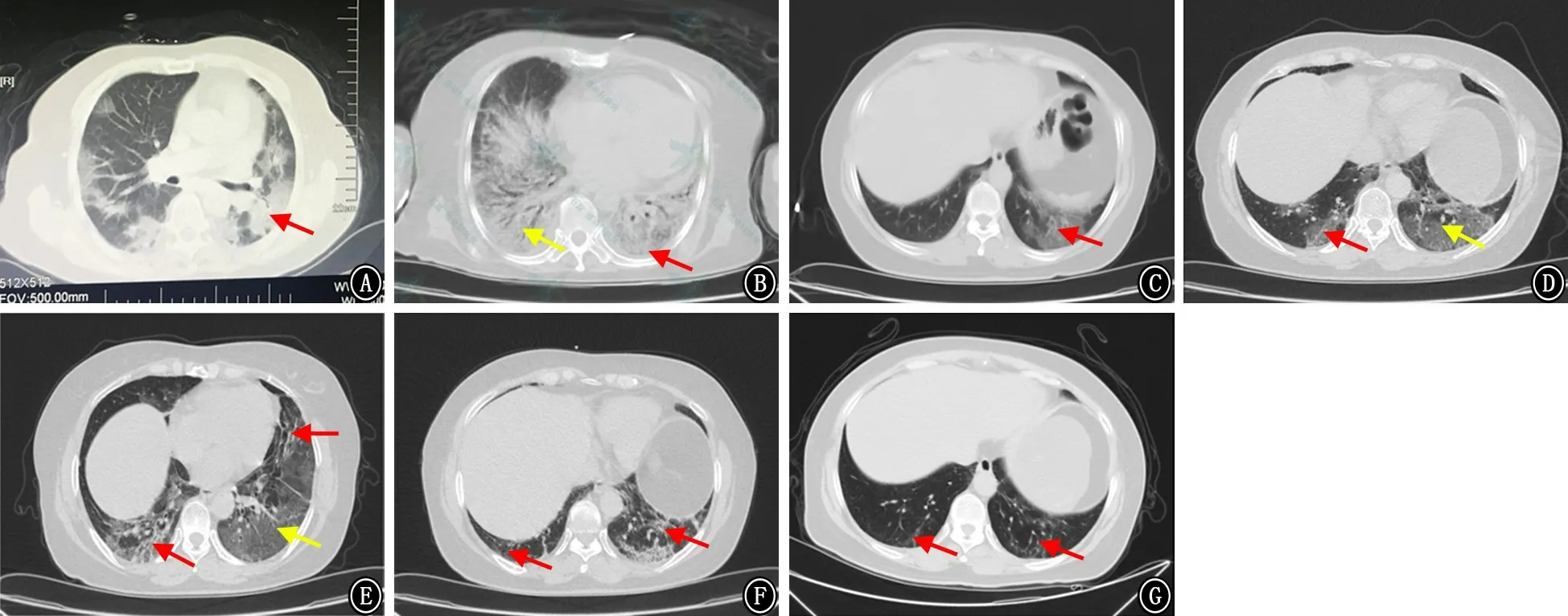
图1 输入型和二代新型冠状病毒肺炎患者胸部CT影像表现 A:66岁女性,双肺多发斑片状实变影(红色箭头);B:66岁女性,病情进展,累及多个肺叶,弥漫性渗出影(白肺)、支气管充气征(黄色箭头)、双侧少量胸腔积液(红色箭头);C:54岁女性,2020年2月3日胸部CT示左肺下叶磨玻璃影,其内可见网格征(红色箭头);D:54岁女性,2020年2月6日胸部CT示左下肺病变较前进展,呈铺路石样改变(黄色箭头),并出现右下肺磨玻璃斑片影(红色箭头);E:54岁女性,2020年2月8日胸部CT示双下肺病变较前进展(黄色箭头),并出现纤维条索影(红色箭头);F:54岁女性,2020年2月16日胸部CT示双下肺病变较前吸收,出现纤维化病灶(红色箭头);G:54岁女性,2021年1月25日胸部CT示双下肺遗留纤维化病灶(红色箭头)

表1 输入型和二代新型冠状病毒肺炎患者实验室检查结果及CT影像学特征
2.4 肺纤维化与临床指标的相关性 与未出现肺纤维化组患者相比,肺纤维化组患者年龄、CRP、hs-CRP、ESR、半定量CT评分更高,PaO2∶FiO2、淋巴细胞计数更低(P值均<0.05),见表2。

表2 输入型和二代新型冠状病毒肺炎患者肺纤维化与临床指标的相关性
3 讨论
本研究纳入的153例陕西省输入型和二代病例中,重症患者比例与武汉情况相似,但并发症发生率、病死率明显低于武汉病例[4-6],仅有2例患者需要机械通气治疗,提示武汉以外的二代、输入型病例较武汉地区的一代病例预后更好。伴随着一代病例向二代病例的转换,COVID-19的临床特征也逐渐发生变化。
与武汉一代病例不同,本研究纳入的输入型和二代病例中,大多数淋巴细胞在正常范围内,仅45.1%表现为淋巴细胞减少,淋巴细胞中位数(1.2×109/L)高于武汉一代病例(0.6×109/L~0.8×109/L)[4-5,7]。另外,重症患者淋巴细胞计数明显低于非重症患者,提示淋巴细胞计数与疾病严重程度相关。153例患者的CRP、hs-CRP、ESR、IL-6中位数高于正常上限,提示病毒入侵,诱发机体免疫反应及炎症因子风暴[8]。与非重症患者相比,重症患者中CRP、hs-CRP、ESR、乳酸脱氢酶、羟丁酸脱氢酶水平增高,提示炎症因子水平与疾病严重程度相关。
本研究显示,COVID-19患者在CT影像表现方面具有多灶性、多样性、动态演变的特点,以双肺病变、肺野外带、胸膜下分布为主,可表现为结节样、斑片状、大片状磨玻璃影或者实变影,病灶内血管增粗常见。CT动态演变以磨玻璃结节影、斑片影为基础,伴有间质增厚,血管影增粗、清晰可辨,其病理基础可能为病毒侵犯肺泡上皮细胞,肺泡间隔毛细血管扩张充血、肺泡腔内液体渗出和小叶内间隔间质充血[9]。进而范围增大、融合、实变,出现铺路石征、实变影、支气管充气征,短期内肺内可出现纤维化病灶,胸腔积液、气胸少见。增厚的小叶间隔线影叠加在磨玻璃样不透明背景下形成典型的铺路石样改变。随着肺泡腔、肺间质内的渗出增多,出现肺实变影、支气管充气征,病变广泛时出现白肺表现。本研究中,随着渗出或实变影的吸收,77例(50.3%)患者胸部影像学出现纤维条索影或肺纤维化。Sun等[10]研究显示,54.7%COVID-19患者后期影像学检查出现肺纤维化表现。既往研究显示,严重急性呼吸综合征患者疾病后期CT常表现为以肺泡及支气管为主的广泛纤维化[11]。
病理学研究显示:COVID-19与严重急性呼吸综合征、中东呼吸系统综合征的肺部病理特征非常相似[12-13],可表现为弥漫性肺泡损伤伴细胞纤维黏液样渗出,肺透明膜形成;肺间质表现出以淋巴细胞为主的单核炎症细胞浸润;肺泡腔内也发现了多核巨细胞以及非典型肥大肺泡上皮细胞[14]。另一项组织病理学研究显示,危重型COVID-19肺组织病理改变主要为细支气管炎、肺泡炎,伴有上皮细胞增生、萎缩、脱落、鳞状上皮化生,肺间质大量纤维化,间质出现包括淋巴细胞、浆细胞、单核细胞在内的炎症细胞浸润。免疫组织化学染色显示CD3、CD4、CD8、CD20、CD79a、CD5、CD38免疫细胞阳性,主要集中在肺间质和血管附近[15]。
本研究发现,与非重症患者相比,重症患者中肺纤维化发生率明显增高。与未出现肺纤维化组相比,肺纤维化组患者年龄、Pa O2∶FiO2、半定量CT评分更高,CRP、hs-CRP、ESR等炎症指标计数更高,淋巴细胞计数更低(P值均<0.05),提示肺部病变严重程度、免疫炎症反应可能与后期肺纤维化相关。纤维化是损伤修复的结果,病毒诱发的炎症反应导致肺间质内巨噬细胞、淋巴细胞浸润并刺激巨噬细胞和淋巴细胞释放自由基、细胞因子,损伤肺泡毛细血管,同时诱发肺纤维细胞增生,最终导致肺间质广泛增生。COVID-19患者肺部渗出吸收后出现纤维化是疾病转归过程中可逆转的现象,还是不可逆转的终末肺纤维化,仍需进一步随访观察。如何预防和降低肺纤维化的发生,以及如何治疗已经出现的肺纤维化,是亟待解决的重要临床课题。
综上所述,与武汉早期一代病例相比,陕西省输入型和二代病例预后较好,并发症发生率、病死率低。淋巴细胞计数、CRP、hs-CRP、ESR、乳酸脱氢酶、羟丁酸脱氢酶等免疫炎症指标和半定量CT评分与COVID-19严重程度相关。CT影像学表现以胸膜下分布磨玻璃影为基础,动态演变,伴有间质增厚,血管影增粗,肺实变,渗出性病变吸收后出现纤维化病灶。年龄,肺部病变严重程度,淋巴细胞计数、CRP、hs-CRP、ESR等免疫炎症指标与输入型和二代COVID-19后期肺纤维化发生相关。
利益冲突所有作者均声明不存在利益冲突

