基于Au NPs@g-C3N4 及目标物循环扩增构建miRNA 光电化学生物传感器
吴 莹, 安思雨, 李孟洁
(重庆科技学院建筑工程学院, 重庆401331)
0 前言
MicroRNA(miRNA)是一类非编码RNA,长度为19-23 个核苷酸的单链小分子,参与了许多生理和病理过程[1]。 大量研究表明,miRNA 异常表达与人类肿瘤疾病的发生与发展密切相关。 此外,miRNA 已被检测出对各种人类疾病有响应,如传染病、肾病和心脏病[2]。因此,miRNA 被认为是一种新的、 有效的疾病诊断标志物。 基于miRNA 具有含量低、相似性高、易降解、尺寸小等固有特征,亟需开发一种灵敏度高、稳定性好、特异性强、 易于量化miRNA 的新方法。 光电化学(PEC)传感器是一种新兴的、迅速发展起来的、光信号输入与电信号输出相结合的分析技术[3]。 迄今为止,由于其灵敏度高、稳定性好、特异性强等优点,PEC 传感器已成功用于检测各种类型的目标物, 因此构建PEC 传感器定量检测miRNA 是一种有前景的方法[4]。
在PEC 传感器的构建过程中,光电材料的选择至关重要。 类石墨氮化碳(g-C3N4)由绿色无毒、低成本元素组成,因其易加工、化学性质稳定和导电性优异,在生物传感、电催化和光催化等领域受到了广泛的关注[5]。此外,g-C3N4(2.7 eV)的带隙使其具有独特的光电性能。 然而, 基于纯g-C3N4构建的PEC 传感器因其光生电子-空穴对快速复合导致检测灵敏度低。 为了抑制光生电子-空穴对的复合,近些年提出了多种策略,包括构造异质结、设计敏化结构、掺杂新元素和结合等离子体金属[6]。 其中,半导体与等离子体金属的耦合已成为抑制复合和改善光电流响应的一种常见而有效的途径。 等离子体金属的引入会发生表面等离子体共振(SPR)效应[7]。 具体而言,入射光的电磁场将驱动金属粒子中电子的集体振荡,从而增强光吸收和界面电荷转移能力。 因此,该工作合成并采用了具有SPR 增强效应的纳米金修饰的氮化碳(Au NPs@g-C3N4),它具有优异的光电性能,可提供优良的初始光电流信号。
该文基于Au NPs@g-C3N4作为光电信号材料及T7 核酸外切酶参与的目标物循环扩增过程, 提出了一种高灵敏的PEC 生物传感平台,用于定量检测microRNA-141(miRNA-141)。 如图1所示, 首先将具有优良PEC 性能的Au NPs@g-C3N4涂覆在电极表面,会产生强烈的初始光电流信号。 通过Au-N 键固载S1-S2 之后,将封闭剂(HT)孵育在电极表面。 随后,加入miRNA-141 和T7 核酸外切酶, 其中miRNA-141 可以与S2 杂交,从而触发T7 外切酶将S2 剪切成许多单链核苷酸, 同时释放miRNA-141 与下一个S2 杂交。在T7 外切酶参与的目标物循环扩增的帮助下,可以将少量的miRNA-141 转化为大量的单链S1。 最终,S1 和标有SiO2的S3 杂交,产生空间位阻效应,从而直接阻断外部电子供应和光捕获途径。 因 此, 随 着miRNA-141 浓 度 的 升 高,Au NPs@g-C3N4的光电流响应逐渐被抑制, 从而可定量检测miRNA-141 浓度。 该文所设计的PEC生物传感平台不仅拓宽了Au NPs@g-C3N4在生物分析中的应用, 而且为miRNA 的灵敏检测提供了新的方法。
1 实验部分
1.1 仪器与试剂
仪器:光致电化学分析仪(荷兰IVIUMSTAT公司)、CHI660E 电化学工作站(上海辰华仪器公司)、JSM-7800F 扫描电子显微镜 (SEM, 日本JEOL 公司)、三电极体系:玻碳电极(Φ=4 mm)为工作电极、铂电极为对电极、饱和甘汞电极为参比电极。
试剂:己硫醇、凝血酶、戊二醛、四水氯金酸(HAuCl4·4H2O)、3-氨丙基三乙氧基硅烷(APTES)、四乙氧基硅烷(TEOS)、三聚氰胺、T7 外切酶、人体血清样本、 NH3·H2O、NaBH4、H2O2、K3[Fe(CN)6]、K4[Fe(CN)6],该工作采用超纯水制备溶液,用0.1 mol/L Na2HPO4、0.1 mol/L KH2PO4和0.1 mol/L KCl混合制备0.1 mol/L 磷酸盐缓冲溶液(PBS,pH=7.0),相关核酸序列由生工生物工程(上海)股份有限公司提供,序列如表1 所示:

表1 该文中相关的核酸序列Tab.1 Sequence information for the nucleic acids used in this study
1.2 Au NPs@g-C3N4 的合成
g-C3N4的合成方法与之前报道的相同[8]。 首先,在坩埚中加入5 g 三聚氰胺,并在80 ℃的大气中干燥24 h。 接着,将中间产物转移到马弗炉中, 然后在550 ℃下以5 ℃/min 的升温速度煅烧3 h。 最后,用硝酸和超纯水离心去除残留的碱性杂质。获得的浅黄色产品(g-C3N4)储存在冰箱中以供后续使用。
为 制 备Au NPs@g-C3N4[9], 混 合20 μL HAuCl4水溶液(10 mmol/L)和5 mL g-C3N4水溶液(2 mg/mL),然后在黑暗中搅拌2 h。 接着,将新鲜制备的硼氢化钠溶液(0.01 mol/L)逐滴加入上述溶液中并不断搅拌。 直到气体停止析出,反应完成。最后, 通过离心洗涤得到的Au NPs@g-C3N4在5 mL 超纯水中重新分散,以供后续使用。
1.3 SiO2 和S3-SiO2 复合材料的合成
按以前的报道所述[10],获得SiO2颗粒。 简单地, 将6 mL 超纯水、16.5 mL 乙醇和2 mL NH3·H2O 混合,不断搅拌得到均质溶液。 20 min 后,加入用2 mL TEOS 分散的18.5 mL 乙醇溶液,在30℃下搅拌15 h。 二氧化硅颗粒用乙醇离心洗涤三次,然后分散在乙醇中。
根据文献[10],制备了用氨基修饰的SiO2颗粒(SiO2-NH2)。 将0.5 mL APTES 和30 mL 制备的SiO2颗粒混合并剧烈搅拌。 随后,将混合物在回流下加热至76 ℃超过24 h。 将产物(SiO2-NH2)用乙醇离心清洗数次。 最后,将SiO2-NH2分散在超纯水中并在4 ℃下储存。
为了制备S3-SiO2复合材料, 将30 μL SiO2-NH2,10 μL 0.05%戊二醛和1 mL 2 μmol/L 末端含有氨基的S3 混合并在室温下连续搅拌2 h 以完成交联反应[11]。 通过离心纯化获得的S3-SiO2复合物,然后再分散在1 mL 磷酸缓冲液(PBS)中以备后续使用。
1.4 PEC 生物传感器的构建
首先,将15 μL Au NPs@g-C3N4(2 mg/mL)涂在玻碳电极(GCE)表面,在37 ℃下干燥,得到Au NPs@g-C3N4/GCE。 然后, 将制备的20 μL S1-S2(2 μmol/L)滴在Au NPs@g-C3N4/GCE 表面,保存12 h,通过Au-N 键稳定固载。 随后,将10 μL 己硫醇(HT,0.1 mmol/L)孵育30 min 以阻断非特异性位点。 随 后, 将20 μL 不同浓度的目标物(miRNA-141)和100 U/mL T7 外切酶在25 ℃下孵育90 min。 如 图1 所 示,T7 外 切 酶 参 与 的miRNA-141 循环扩增过程将被触发。 具体地说,miRNA-141 将取代S1 形成miRNA-141/S2 的双链,该双链可被T7 外切酶从5’到3’方向切割。结果,S2 被切割成单链核苷酸,miRNA-141 被释放以取代下一个S1。 经过N 次循环后,大量的单链S1 裸露在电极表面。 最后, 将20 μL S3-SiO2复合材料涂覆在GCE 表面, 在37 ℃下孵育2 h。图1 呈现了PEC 生物传感平台的构建过程。
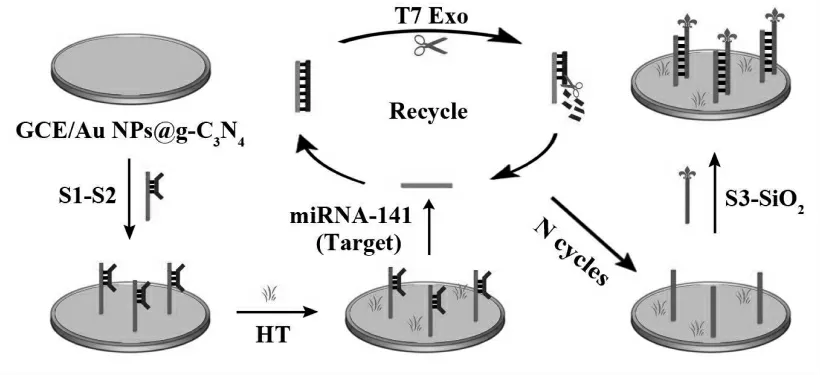
图1 PEC 生物传感器的制备过程示意图Fig.1 Schematic diagram of the PEC biosensor construction process
1.5 PEC 测量
PEC 测量是在含0.125 mol/L H2O2(电子供体)的5 mL PBS 缓冲溶液中进行。 选择波长为460 nm 的LED 灯作为激发光源,在0.0 V 电位下关-开-关10-20-10 秒。 电化学阻抗的测量在含有5.0 mmol/L [Fe(CN)6]3-/4-和0.1 mol/L KCl 的2 mL PBS 中。 所有测量均在室温下进行,采用传统的三电极体系,包括饱和甘汞电极(参比电极)、铂丝(对电极)和玻碳电极(工作电极)。
2 结果与讨论
2.1 不同材料的表征
用扫描电镜(SEM)表征了实验所涉及的纳米材料,包括g-C3N4、Au NPs@g-C3N4和SiO2。 如图2A 所示, 合成的g-C3N4的形貌为二维薄雾状结构。用Au NPs 修饰后,可以清晰地看到g-C3N4表面有许多均匀修饰的纳米颗粒(图2B)。 此外,在图2C 中记录了SiO2颗粒的SEM 图像。SiO2颗粒呈大小均一的球状结构,粒径约为350 nm,这表明SiO2颗粒的制备是成功的。

图2 g-C3N4(A)、Au NPs@g-C3N4(B)和SiO2 颗粒(C)的SEM 图像Fig.2 SEM images of g-C3N4(A),Au NPs@g-C3N4(B)and SiO2 particles(C)
2.2 实验条件的优化
为了获得优异的PEC 分析性能, 对PBS 中H2O2浓度和激发波长进行了优化。如图3A 所示,在0.02 mol/L~0.125 mol/L H2O2浓度范围内,光电流随其浓度的增大呈上升的趋势。 但随着H2O2浓度的进一步增加,光电流达到稳定。 因此,最佳的H2O2浓度为0.125 mol/L。 从图3B 可以看出,在660 nm、623 nm、523 nm、460 nm 四种不同激发波长下,均未观察到明显的光电流。 在440 nm处, 观察到的光电流为1.2 μA。 当照射波长为365 nm 时,光电流最高为4.1 μA。 因此,该PEC生物传感器的最佳激发波长为365 nm。
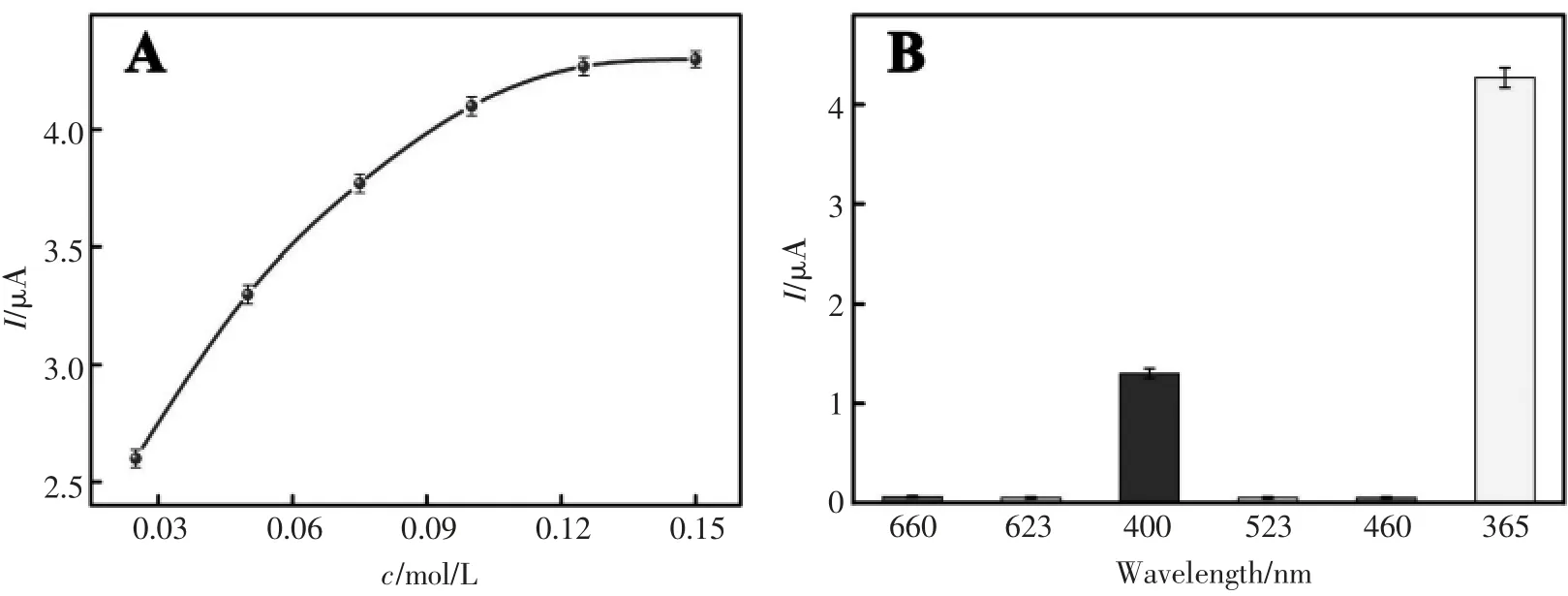
图3 检测溶液中H2O2 浓度(A)和激发波长(B)对光电流信号的影响Fig.3 Effect of the H2O2 concentration in detection solution(A)and the irradiation wavelength(B)on the photocurrent signal
2.3 PEC 生物传感器制备过程的PEC 表征
为了评估所制备的PEC 传感器的可行性,图4 比较了逐步修饰过程中的光电流。在裸GCE 下观察到接近零的光电流(曲线a)。由于Au NPs@g-C3N4优异的光电性能, 在GCE 表面涂覆Au NPs@g-C3N4后,光电流信号急剧增加(曲线b)。当S1-S2(曲线c)和HT(曲线d)连续孵育在GCE 表面上时,由于电荷转移能力较差,光电流信号逐次减小。 最终,在T7 外切酶、miRNA-141 和S3-SiO2孵育后,光电流信号显著降低(曲线e),这说明DNA 杂交引入的SiO2能够阻断电子转移,有效猝灭Au NPs@g-C3N4的光电流。 这些结果表明,该生物传感器的逐步构建过程是成功的。
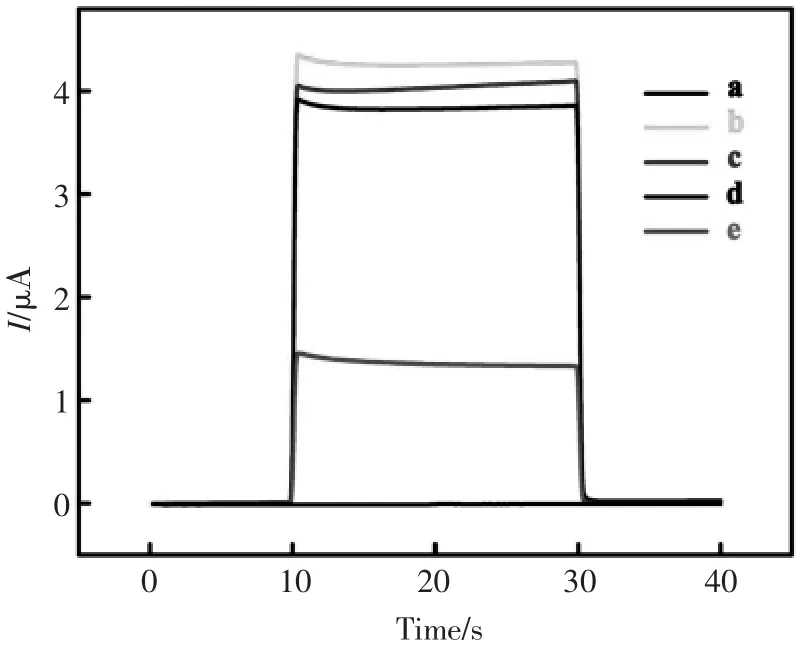
图4 生物传感器制备过程的PEC 表征:(a) 裸电极,(b)Au NPs@g-C3N4/裸电极,(c)S1-S2/Au NPs@g-C3N4/裸电极,(d) 己硫醇/S1-S2/Au NPs@g-C3N4/裸电极,(e)S3-SiO2/T7 外切酶/miRNA-141/己硫醇/S1-S2/Au NPs@g-C3N4/裸电极Fig.4 PEC responses for each immobilized step:(a)bare GCE,(b)Au NPs@g-C3N4/GCE,(c)S1-S2/Au NPs@g-C3N4/GCE,(d)HT/S1-S2/Au NPs@g-C3N4/GCE and(e)S3-SiO2/T7 Exo/miRNA-141/HT/S1-S2/Au NPs@g-C3N4/GCE
2.4 PEC 生物传感器制备过程的电化学表征
如图5 所示,采用电化学阻抗谱(EIS)测量对PEC 生物传感器的制备进行了表征。 EIS 测试在含有5.0 mmol/L[Fe(CN)6]3-/4-和0.1 mol/L KCl 的2 mL PBS(pH7.0,0.1 mol/L)中进行,频率范围为10 kHz 至0.1 Hz,交流电压为5 mV,直流电电压为0.22 V。裸GCE 的电荷转移电阻(Ret)为曲线a(Ret≈20 Ω)。Au NPs@g-C3N4修饰后的GCE 的Ret值明显增加(Ret≈180 Ω,曲线b),这可能是由于Au NPs@g-C3N4阻碍了电极表面的电子转移。当S1-S2 固定在Au NPs@g-C3N4/GCE 上时, 由于DNA序列导电性较差,Ret继续增加(Ret≈370 Ω,曲线c)。 不导电的HT 孵育后Ret进一步增加(Ret≈480 Ω, 曲线d)。 由于空间位阻效应的存在,在S3-SiO2、T7 外切酶和miRNA-141 孵育后,Ret显著增加(Ret≈730 Ω,曲线e)。 这些结果表明,PEC生物传感器的制备是成功的。
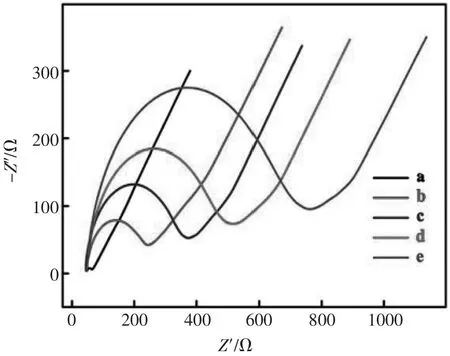
图5 生物传感器制备过程的EIS 表征:(a) 裸电极,(b)Au NPs@g-C3N4/裸电极,(c)S1-S2/Au NPs@g-C3N4/裸电极,(d) 己硫醇/S1-S2/Au NPs@g-C3N4/裸电极,(e)S3-SiO2/T7 外切酶/miRNA-141/己硫醇/S1-S2/Au NPs@g-C3N4/裸电极Fig.5 EIS responses for each immobilized step:(a)bare GCE,(b)Au NPs@g-C3N4/GCE,(c)S1-S2/Au NPs@g-C3N4/GCE,(d)HT/S1-S2/Au NPs@g-C3N4/GCE and(e)S3-SiO2/T7 Exo/miRNA-141/HT/S1-S2/Au NPs@g-C3N4/GCE
2.5 PEC 生物传感器的性能分析
为了评价所提出的PEC 生物传感平台的分析性能,在最佳条件下测量了一系列不同浓度的miRNA-141 光电流信号,如图6A 所示。 结果发现, 随着miRNA-141 浓度从1 fmol/L 增加到1 nmol/L,光电流信号急剧下降。 图6B 为光电流信号与miRNA-141 浓度对数之间的线性响应曲线。 线性回归方程为:I=-0.3633 lgc+1.481,相关性系数为0.9925 (其中I 和c 分别为光电流信号和miRNA-141 浓度),检出限为0.3 fmol/L。 同时,将该传感器的分析性能与已有的方法进行了比较。 如表2 所示,该论文所构建的PEC 传感器具有相对较宽的线性范围和相对较低的检出限。这些结果进一步表明,该文所构建的PEC 传感器对miRNA-141 的定量检测是可靠和灵敏的。

图6 (A)不同miRNA-141 浓度的光电流信号,(B)光电流信号与miRNA-141 浓度对数的线性关系Fig.6 (A)Photocurrent signals with various miRNA-141 concentrations,(B)Linear relationship between the photocurrent signals and the logarithm of miRNA-141 concentration

表2 PEC 生物传感器同其他测定miRNA 的方法对比Tab.2 The PEC biosensor compared with other miRNA analytical methods
2.6 PEC 生物传感器的选择性和稳定性
为了探索PEC 生物传感器的选择性,该实验利用凝血酶、miRNA-21 和miRNA-155 作为干扰物。 从图7A 中可以看出,在存在10 nmol/L 干扰物的情况下,检测到较强的PEC 信号,与空白检测结果相同。而当检测样本为0.1 nmol/L miRNA-141 时,PEC 信号明显减弱。 结果表明,该生物传感器对miRNA-141 检测具有良好的选择性。 此外,该实验还采用0.1 nmol/L miRNA-141 孵育的PEC 生物传感器在连续的“关-开-关”光照下进行8 个周期的监测。如图7B 所示,PEC 信号的相对标准偏差(RSD)为2.06%,这说明该文提出的PEC 生物传感器对miRNA-141 的检测具有良好的稳定性。
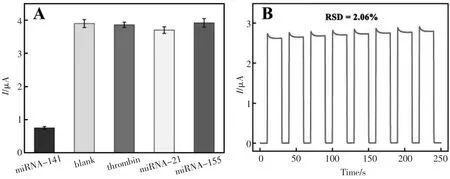
图7 PEC 生物传感器的选择性(A)及稳定性(B)Fig.7 Selectivity(A)and stability(B)of PEC biosensor
3 结论
综上所述, 将Au NPs@g-C3N4作为光电信号材料, 进一步结合T7 外切酶参与的目标物循环扩增过程, 提出了一种用于miRNA-141 灵敏检测的PEC 生物传感器。 由于g-C3N4独特的光学和电子性质以及Au NPs 的表面等离子体共振(SPR)增强效应,合成的Au NPs@g-C3N4可以产生较强的PEC 信号。此外,引入T7 外切酶启动目标物循环扩增过程可以将少量的miRNA-141 转化为大量的单链S1。 输出的单链S1 进一步与S3-SiO2杂交,使得SiO2能有效猝灭Au NPs@g-C3N4的初始光电流信号,导致PEC 信号降低,从而显著提高miRNA-141 检测的灵敏度。 该文设计的PEC 生物传感器为Au NPs@g-C3N4在生物分析中的应用提供了新的平台, 并为miRNA 的灵敏检测提供了一种有效的方法。

