基于二氧化钛构建铅离子光电化学生物传感器
安思雨, 吴 莹, 李孟洁
(重庆科技学院建筑工程学院, 重庆401331)
0 前言
铅离子(Pb2+)是一种普遍存在的且不可生物降解的剧毒污染物,它对生态和全球公众健康已经造成了严重的危害[1]。 大量研究表明,Pb2+可以通过空气、 地表水以及土壤等途径对人体的神经、造血、心血管和内分泌系统造成不利影响[2]。因此,高效、灵敏的检测Pb2+对于环境的治理和疾病的早期诊断具有重要意义。 目前,许多分析方法被用于对Pb2+进行定量检测, 包括电化学分析法[3]、荧光分析法[4]、比色分析法[5]、表面增强拉曼光谱法[6]等,然而这些方法存在成本高、耗时长、灵敏度低、准确度低以及稳定性不好等问题。因此,人们迫切需要研发成本低、灵敏度高、稳定性好、 准确度高的检测技术以满足对Pb2+的定量分析, 从而实现对生态系统污染程度的监测,进一步为疾病的早期诊断提供科学依据。 光电化学(PEC) 分析是以修饰在电极上的光活性物质为基础,通过光照激发电极上光活性材料,最终由产生的电流强度确定待测目标物含量的一种检测方法[7]。 光电化学作为一种极具应用前景的新兴检测技术, 采用了两种信号完全分离的模式,从而显著降低了背景信号干扰,获得比传统的检测方法更好的稳定性,更高的灵敏度及准确性。 因此,受到了越来越多科研工作者的关注,在分析化学、 医学和环境监测等领域得到了广泛的应用[8]。 迄今为止,PEC 生物传感器已经成功地检测到了蛋白质、 金属离子、 细胞、microRNA 和DNA 等多种不同的目标分析物,因此有望实现对Pb2+高效、灵敏的检测。
在光电化学分析过程中,PEC 生物传感器的性能与其表面修饰的光电材料密切相关。 光电材料的光电转化效率直接影响光电流的大小,进而影响对目标物检测的灵敏度,故光电材料的选择是构建PEC 生物传感器的核心要素之一。常用的光电材料包括无机半导体材料、有机半导体材料及其复合材料。 二氧化钛(TiO2)、量子点(QDs)和硅(Si)等无机半导体材料因其独特的光学、电学和催化性能被广泛应用于太阳能电池、光催化系统以及PEC 生物传感器的构建等[9]。在无机半导体材料中,TiO2因其优异的光电性能而成为一种极具吸引力的典型材料。 众所周知,TiO2是一种n 型半导体材料,具有成本低、无毒、化学稳定性高、生物相容性好等优点。 通常,TiO2的带隙为3.2 eV 且具有优异的光电性能, 这归因于其强大的紫外光吸附能力和较大的比表面积。 由于上述优异的性能,TiO2在光催化、环境监测、食品安全和医药等领域有着广泛的应用[10]。莫方静等[11]开发了一种基于TiO2光电材料的PEC 适体传感器,以实现凝血酶的灵敏检测。阮冲等[12]采用了TiO2纳米颗粒作为敏感元件通过催化发光(CTL)现象设计了测定乙酸甲酯的气体传感器。 受这些文献报告的启发,基于TiO2优异的光电性能和PEC 传感策略的优势,有望以TiO2作为基底修饰性材料构建新型PEC 生物传感器用于Pb2+的灵敏检测。
该研究以重金属离子Pb2+为检测对象, 基于“signal off”模式,再结合光电性能优异的基底材料TiO2,构建了准确度高、灵敏度高、稳定性好、特异性强的PEC 生物传感测试平台(图1)。 首先在玻碳电极(GCE)表面修饰光电材料TiO2,由于其良好的生物相容性、较大的比表面积和优异的光电性能,可以观察到很高的初始PEC 信号。 然后在上述电极上电沉积一层金纳米粒子(Dep Au),随后通过Au-S 键将DNA 固载在电极表面,接着用1-己硫醇(HT)封闭电极表面的非特异性吸附位点。 最终,在Pb2+存在的情况下,Pb2+会与富含鸟嘌呤的DNA 结合,使其折叠形成G-四联体结构,从而获得显著降低的PEC 信号。因此,通过记录PEC 信号的变化实现对目标物Pb2+的灵敏检测。在该工作中所构建的PEC 生物传感器灵敏度高、特异性好、重现性好、稳定性好,为Pb2+的检测开辟了新的途径,同时为检测其他重金属离子提供了新的方法。
1 实验部分
1.1 仪器与试剂
仪器:CHI660E 电化学工作站(上海辰华仪器公司)、TPEC10W 系列LED 光源(广州彤泰科技有限公司)、KQ-5200DE 数控超声波清洗器(昆山市超声仪器有限公司)、FA1004C 电子天平(上海市佑科仪器仪表有限公司)、JSM-7800F 扫描电子显微镜(SEM,日本JEOL 公司)、三电极体系:玻碳电极(Φ=4 mm)为工作电极、铂电极为对电极、饱和甘汞电极为参比电极。
试剂: 钛酸四丁酯(C16H36O4Ti)、 无水乙醇(CH3CH2OH)、 冰 醋 酸 (CH3COOH)、 氯 金 酸(HAuCl4)、1-己 硫 醇(HT)、过 氧 化 氢(H2O2)、Tris-HCl 缓冲溶液、铁氰化钾(K3[Fe(CN)6])、氯化钾(KCl)、氯化钠(NaCl)、六水氯化镁(MgCl2·6H2O)、无水氯化钙(CaCl2)、硝酸铅(Pb(NO3)2),采用M10UP分析超纯水机制备超纯水,用0.1 mol/L Na2HPO4、0.1 mol/L KH2PO4和0.1 mol/L KCl 混 合 制 备 了0.1 mol/L 磷 酸 盐 缓 冲 溶 液 (PBS,pH=7.0),DNA 由生工生物工程(上海)股份有限公司提供 , 具 体 序 列 号 如 下 :5' -SH -CTCTCTCTCTCTGGTTGGTGTGGTTGGACG-3'
1.2 二氧化钛的制备
将10 mL 钛酸四丁酯加入到含有3.5 mL 无水乙醇的烧杯A 中并搅拌10 min。 同时, 将0.4 mL 冰醋酸和1 mL 超纯水的混合溶液倒入含有3.5 mL 无水乙醇的烧杯B 中, 再滴加HCl 将pH调节至3。 随后,将烧杯A 中的溶液以3 mL/min的速度滴入烧杯B 中,随即搅拌30 min,再在40℃水浴中加热2 h 以形成胶体溶液。 将胶体溶液在70 ℃下干燥,即可获得二氧化钛(TiO2)。 最终,将8 mg TiO2分散到1 mL 超纯水中, 离心洗涤,通过连续超声获得均一的溶液, 并将其储存在4℃下供进一步使用。
1.3 PEC 生物传感器的构建
该文设计的PEC 生物传感器的构建过程如图1 所示。 首先,玻碳电极(GCE)用氧化铝(Al2O3)粉末在绒面革上反复抛光,在改性前用超纯水清洗干净。 然后, 将10 μL TiO2滴到上述清洁的GCE 表面上, 于37 ℃的烘箱中干燥以形成均匀的膜。接下来,将TiO2修饰的电极浸在1%的氯金酸溶液中,在-0.2 V 恒定电位下电化学沉积10 s获得一层镀金(Dep Au)的薄膜。 随后,在该电极上滴加5 μL 2 μmol/L DNA 在4 ℃下孵育过夜,再滴加10 μL 0.1 mol/L HT 作为封闭剂, 并在室温下培养40 min 以阻断非特异性吸附位点。 最后,在电极上滴加10 μL 不同浓度的Pb2+, 室温下放置40 min。

图1 PEC 生物传感器的制备过程示意图Fig.1 Schematic diagram of the stepwise PEC biosensor construction process
1.4 PEC 测量
PEC 测量是在5 mL 0.1 mol/L PBS 缓冲溶液和0.1 mol/L H2O2的混合溶液中进行, 其中H2O2是电子供体, 使用CHI 660E 电化学工作站记录光电流-时间响应曲线。 然后将波长为365~370 nm 的LED 灯作为激发光源,在0.0 V 电压下关-开-关10-20-10 秒。
2 结果与讨论
2.1 二氧化钛的SEM 表征
图2 是二氧化钛的扫描电子显微镜(SEM)表征图。 照样结果显示,制得的二氧化钛成大小不均一的块状且具有较好的分散性,结果表明块状的二氧化钛已经成功制备。

图2 二氧化钛的SEM 表征Fig.2 SEM characterization of TiO2
2.2 实验条件的优化
由于H2O2的浓度和光辐照的波长都对光电流强度产生一定的影响,为了保证PEC 生物传感器的良好分析性能,使电极具有最佳的光电流强度,因此进行了一系列的优化实验。从图3A 可以看出在0.02 mol/L~0.10 mol/L H2O2浓度范围内,光电流随其浓度的增大逐渐呈上升的趋势。 但是, 当H2O2浓度从0.10 mol/L 继续增加至0.14 mol/L 时, 光电流随其浓度的增大逐渐下降。 因此,该实验选择0.10 mol/L 为H2O2的最佳浓度。图3B 显示出光电流在不同的激发波长下呈现波动趋势。激发波长在515~525 nm(矩形d)之间时,未观察到明显的光电流。 混合白光(5000~5500 K)照射下(矩形e)可观察到0.4 μA 的光电流信号。进一步与混合白光照射下的光电流相比, 激发波长为395~405 nm(矩形b)和455~465 nm(矩形c)时,光电流分别增加到1.2 μA 和0.7 μA。 当激发波长为365~370 nm(矩形a)时,可以观察到最高的光电流(2.2 μA)。因此,选择365~370 nm 用作该PEC 生物传感器检测目标的最佳激发波长。
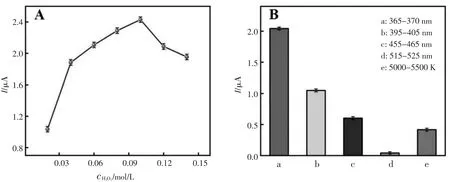
图3 检测溶液中H2O2 浓度(A)和激发波长(B)对光电流的影响Fig.3 Effect of the H2O2 concentration in detection solution(A)and the irradiation wavelength(B)on the photocurrent
2.3 PEC 生物传感器制备过程的PEC 表征
为了研究组装的PEC 生物传感器的可行性,在5 mL PBS 和50 μL H2O2的混合溶液中进行测量并记录了逐步修饰过程中的光电流。 如图4 所示,与裸电极(曲线a)的光电流相比,经光电性能优异的TiO2修饰后的电极具有较高的光电流(曲线b)。在修饰电极上沉积金纳米粒子(Au NPs)后,因为Au NPs 的覆盖使得TiO2表面的照明面积减小,光电流略有降低(曲线c)。 通过Au-S 键作用,将DNA 稳定地固载到被修饰的电极表面, 光电流再次降低(曲线d),经HT 阻断非特异性吸附位点,光电流进一步降低(曲线e)。 最终,当Pb2+存在时,单链DNA 和Pb2+会发生特异性配位,使其折叠形成G-四联体结构,进而阻碍了电子转移,光电流继续降低(曲线f)。 这些结果表明该PEC 生物传感器已成功制备。
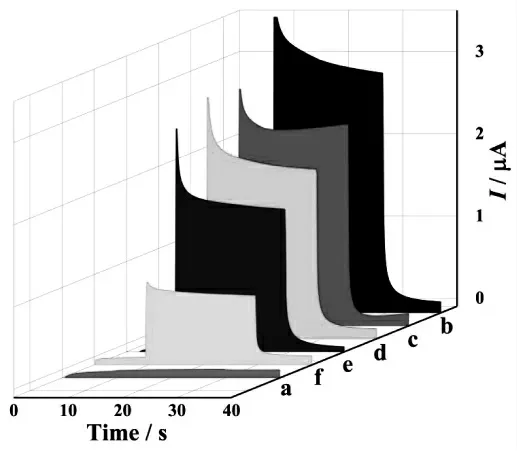
图4 生物传感器制备过程的PEC 表征:(a) 裸电极,(b) 二氧化钛/裸电极,(c) 沉积金/二氧化钛/裸电极,(d) 核酸适配体/沉积金/二氧化钛/裸电极,(e)1-己硫醇/核酸适配体/沉积金/二氧化钛/裸电极,(f) 铅离子/1-己硫醇/核酸适配体/沉积金/二氧化钛/裸电极Fig.4 PEC responses for each immobilized step:(a)bare GCE,(b)TiO2/GCE,(c)Au NPs/TiO2/GCE,(d)DNA/Au NPs/TiO2/GCE,(e)HT/DNA/Au NPs/TiO2/GCE and(f)Pb2+/HT/DNA/Au NPs/TiO2/GCE
2.4 PEC 生物传感器制备过程的电化学表征
利用循环伏安法(CV)研究了所制备PEC 生物传感器的修饰过程, 如图5A 所示, 裸电极(GCE) 的CV 表征曲线显示为一对对称的氧化还原峰(曲线a)。 导电性能差的TiO2修饰在电极表面后,氧化还原峰值电流显著降低(曲线b)。 由于Au NPs 良好的导电性促进了电子转移,所以当在电极表面沉积Au NPs 后, 氧化还原峰电流增加(曲线c)。 随着DNA 固载在电极表面后,DNA 在电极表面上形成的负电层对测试溶液中带负电荷的铁氰化物分子具有排斥作用,导致氧化还原峰值电流与曲线c 相比降低了(曲线d)。 接着用HT 阻断非特异性吸附位点, 观察到的氧化还原峰电流进一步降低(曲线e)。 最后,当Pb2+孵育在电极表面时,DNA 和Pb2+形成的G-四联体结构阻碍了电子转移,氧化还原峰电流再次降低(曲线f)。结果表明,该PEC 生物传感器的每一步修饰过程都是成功的。
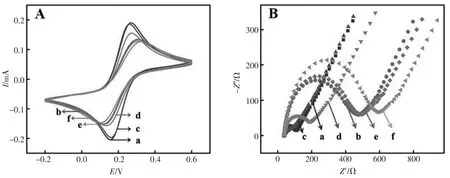
图5 生物传感器制备过程的CV 表征(A)和EIS 表征(B):(a) 裸电极,(b) 二氧化钛/裸电极,(c) 沉积金/二氧化钛/裸电极,(d) 核酸适配体/沉积金/二氧化钛/裸电极,(e)1-己硫醇/核酸适配体/沉积金/二氧化钛/裸电极,(f) 铅离子/1-己硫醇/核酸适配体/沉积金/二氧化钛/裸电极Fig.5 CV(A)and EIS(B)responses for each immobilized step:(a)bare GCE,(b)TiO2/GCE,(c)Au NPs/TiO2/GCE,(d)DNA/Au NPs/TiO2/GCE,(e)HT/DNA/Au NPs/TiO2/GCE and(f)Pb2+/HT/DNA/Au NPs/TiO2/GCE
此外,还利用了电化学阻抗谱(EIS)技术进一步研究该电极表面性质。 一般,阻抗图谱由一个半圆和一条直线组成,半圆的直径相当于电子转移阻抗(Ret),它反应了氧化-还原探针在接近电极表面时受到的扩散限制。 图5B 是传感器制备过程中不同修饰步骤的电化学阻抗谱,TiO2修饰在电极表面后,与电子转移电阻(Ret)相关的半圆(曲线b)相比于裸电极(曲线a)的半圆显著增加,表明半导体TiO2抑制了电子转移。当导电性能良好的Au NPs 沉积在电极表面时,Ret降低(曲线c)。随着DNA 和HT 逐步修饰到电极表面后,由于电子转移受阻,Ret依次增加(曲线d 和e)。 最终,孵育在电极表面的Pb2+与DNA 特异性配位形成G-四联体结构,从而进一步诱导Ret的增加(曲线f)。以上结果再次证明PEC 生物传感器的成功制备。
2.5 PEC 生物传感器的性能分析
为研究所构建的PEC 生物传感器的检测性能,在最优的条件下对不同浓度Pb2+的PEC 响应进行了检测。 如图6A 所示, 随着Pb2+浓度的增加,光电流呈现下降趋势。 图6B 呈现了Pb2+浓度对数与光电流之间的线性相关图,其线性回归方程为I=-0.159 lgc+1.47,相关系数r=0.993。 此外,该文构建的PEC 生物传感器的检测性能与相关文献报道的其他检测Pb2+方法的检测性能相比(表1),该工作所构建的传感器具有更宽的线性范围(500 fmol/L~500 nmol/L)和更低的检测限(0.17 pmol/L)。 这些结果进一步证实了所设计的生物传感器对Pb2+的检测具有高灵敏度和宽线性范围, 为实际样品中Pb2+的检测提供了潜在的应用途径。

图6 PEC 生物传感器对不同浓度Pb2+的PEC 响应图(A)及校正曲线图(B)(Pb2+的浓度分别为:500 fmol/L,5 pmol/L,50 pmol/L,500 pmol/L,5 nmol/L,50 nmol/L,500 nmol/L)Fig.6 PEC responses of different concentrations of target Pb2+(A)and the corresponding calibration curve(B)(the concentrations of target Pb2+were 500 fmol/L,5 pmol/L,50 pmol/L,500 pmol/L,5 nmol/L,50 nmol/L,500 nmol/L)

表1 PEC 生物传感器同其他测定铅离子的方法对比[3-6,13]Tab.1 The PEC biosensor compared with other Pb2+analytical methods
2.6 PEC 生物传感器的稳定性和选择性
为了评估PEC 生物传感器的稳定性,在辐照波长为365~370 nm 的光照下,设置了9 个“关-开-关” 周期性循环对500 nmol/L Pb2+进行检测。从图7A 中可以看出,光电流响应基本维持不变,并且可以计算出相对标准偏差(RSD)为1.12%,这表明构建的PEC 生物传感器在检测Pb2+时表现出良好的稳定性。 此外, 还利用Mg2+、Na+、Ca2+、Hg2+、K+和空白溶液作为干扰物质,对构建的传感器的选择性进行了研究。 如图7B 所示, 当500 nmol/L 干扰物孵育在被修饰的电极表面后可以观察到强烈的光电流响应,并且与空白对照获得的光电流响应几乎相同。 然而,当5 nmol/L Pb2+孵育在被修饰的电极表面后, 光电流响应降低,并且明显低于这五种干扰物质。 显然,这些结果表明了所构建的PEC 生物传感器对Pb2+的检测表现出优异的选择性。
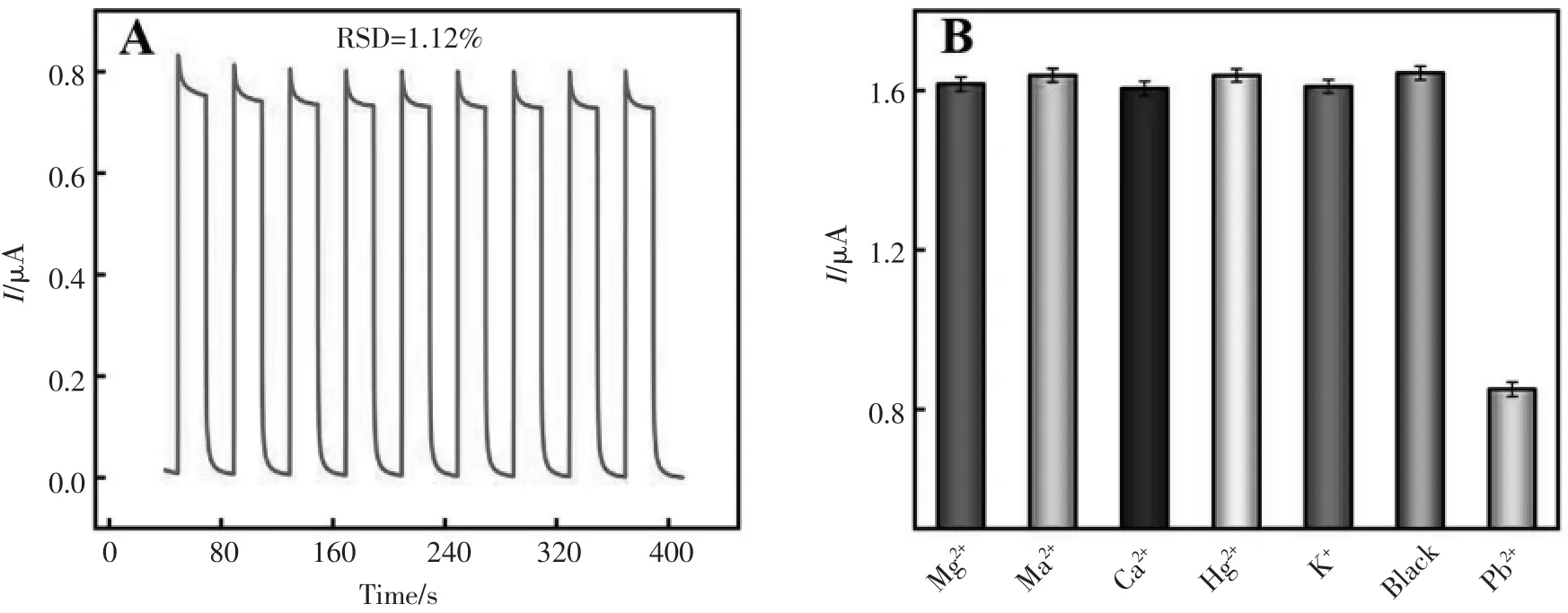
图7 PEC 生物传感器的稳定性(A)及选择性(B)Fig.7 Stability(A)and selectivity(B)of PEC biosensor
3 结论
综上所述,该工作基于TiO2作为光电材料成功构建了“signal off”模式的PEC 生物传感器,并将其应用于Pb2+的灵敏检测。 正是因为TiO2具有独特的光电特性, 获得了较高的初始PEC 信号。利用Pb2+与DNA 特异性配位形成稳定的G-四联体结构阻碍了电子转移, 导致PEC 信号显著降低。该PEC 生物传感器制备简单、检测灵敏、稳定性好、选择性高,为Pb2+的测定提供了一种快速、准确的检测方案。 此外,该文构建的PEC 生物传感器也能扩展到其他与环境相关的各种有毒重金属离子的微量或痕量检测,在环境监测和医疗诊断中有着广阔的发展前景和潜在的应用价值。

