SAMHD1蛋白在食管癌中的表达特点及其临床意义
黄云龙, 张仁泉, 姚 龙, 宁光耀
食管癌是一种高病死率和预后差的恶性肿瘤,总体5年生存率低于13%,究其原因,一方面由于肿瘤侵袭和转移导致复发和预后不良,另一方面因食管癌临床诊断时常偏晚期。尽管已有广泛报道在食管癌中有多个基因突变,但仍不全面了解其发生发展的分子机制。最近,一种新的细胞内抗病毒因子,由真核生物SAMHD1基因编码的全称为不育-α-基序结构域(SAM域)和组氨酸/天冬氨酸残基双联体结构域(HD域)包涵蛋白1的蛋白,在癌症中的差异表达被越来越多的人所关注。已有研究表明SAMHD1在慢性淋巴细胞白血病、结肠直肠癌、肝癌、肺癌、皮肤T细胞淋巴瘤等癌症中的降低。该研究通过免疫组化的方法检测食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)中SAMHD1的表达水平,分析SAMHD1表达与ESCC临床病理参数及患者生存预后之间的关系,为ESCC的诊治及预后评估提供新思路。
1 材料与方法
1.1 病例资料
标本源于安徽医科大学第一附属医院2009年1月—2013年12月期间收治的204名食管鳞状细胞癌患者,统计其详细的术后临床病理资料且根据UICC/AJCC 第8版食管癌TNM分期标准进行严格术后病理分期,并跟踪随访生存预后情况。所有患者均未接受任何术前放化疗,并且他们都接受了微创食管癌切除手术。1.2 试剂
SAMHD1的小鼠抗人单克隆抗体购自武汉三鹰生物技术有限公司。免疫组化试剂盒(SP-9001)购自北京中杉金桥生物有限公司。1.3 免疫组化
使用链霉菌抗生物素蛋白-过氧化物酶连接法(streptavidin-peroxidase,SP)检测实验标本中SAMHD1表达。将样本固定在4%中性多聚甲醛中,常规包埋在石蜡中,连续切成4 μm切片,并使用HE方法常规染色以进一步确认病理诊断。然后进行免疫组织化学染色。将石蜡切片用二甲苯脱蜡,用梯度乙醇水合,浸入3%HO溶液,并在室温下用灭活内源性过氧化物酶温育10 min。使用0.01 mol/L枸橼酸钠缓冲液(pH = 6.0,95~100 ℃,20 min)在加热的水浴中修复抗原。在室温冷却后,用磷酸盐缓冲液(PBS)洗涤样品,加入小鼠抗人SAMHD1单克隆抗体,然后在37 ℃恒温下持续培养2 h。然后将它们用PBS漂洗3次(每次5 min),加入生物素标记的第二抗体,在室温下孵育30 min,再次用PBS洗涤3次(每次5 min)。使用DAB作为显色剂,用蒸馏水冲洗样品,用苏木精染色,用乙醇和二甲苯脱水,用中性胶密封。选择阳性表达SAMHD1的多形性胶质母细胞瘤标本作为阳性对照,用PBS替换一抗后获得阴性对照。1.4 评估标准
SAMHD1表达在细胞质或细胞核上显示为黄色或棕色染色为阳性,并且在细胞质或细胞核中为黄色或棕色颗粒。在高倍视野(×400)下观察,每个切片检查随机5个恶性细胞区域,基于阳性染色细胞的数量和颜色深度,使用半定量评分确定结果:阳性细胞百分比≤5%为0分,6%~25%为1分,26%~50%为2分,51%~75%为3分,> 75%为4分。关注阳性细胞的颜色深度,基本上没有着色为0点,浅黄色为1点,浅棕色为2点,深棕色为3点。在将2个得分相乘后得到分数进行判别:0~2分为阴性结果,3~4分为弱阳性,5~8分为中度阳性,9~12分为强阳性;将阴性和弱阳性定义为低表达,中等阳性和强阳性定义为高表达。见图1。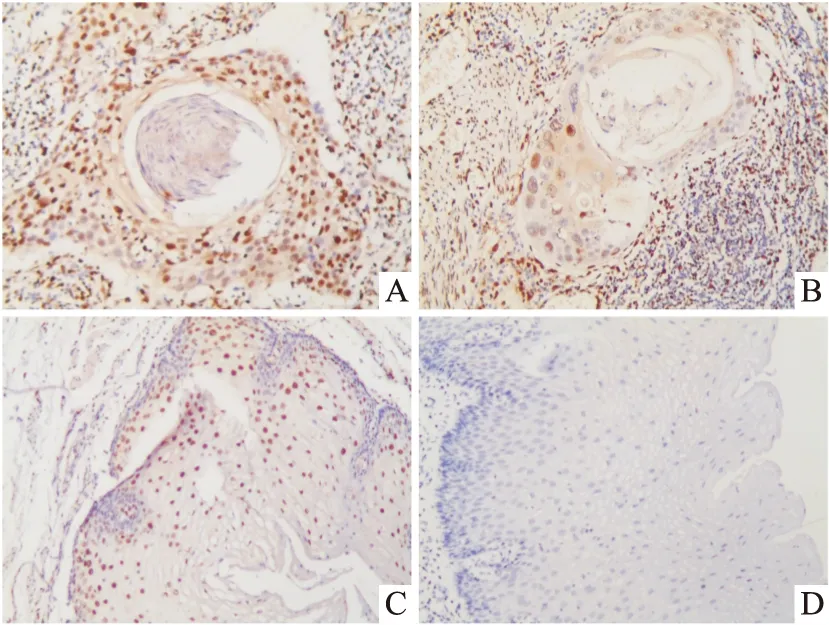
图1 ESCC组织中SAMHD1免疫组织化学染色表达 SP×400A:强阳性;B:中度阳性;C:弱阳性;D:阴性
1.5 统计学处理
应用SPSS 20.0软件进行统计分析,用χ检验比较在不同组之间SAMHD1表达与临床病理参数的相关性。采用Kaplan-Meier法绘制累积生存率曲线和无进展生存率曲线,计算累积生存率及无进展生存率,Log-rank检验进行生存分析。P
<0.05为差异有统计学意义。2 结果
2.1 SAMHD1在ESCC中的表达情况
SAMHD1主要在ESCC细胞的细胞质或细胞核中表达,204例ESCC组织中SAMHD1免疫组织化学染色表达水平,119例高表达,强阳性有59例(图1A),中度阳性有60例(图1B);85例低表达,弱阳性有33例(图1C),阴性有52例(图1D)。2.2 SAMHD1表达与食管癌临床病理特征的关系
SAMHD1的表达在患者的年龄、性别、肿瘤(T、N、TNM)分期、上纵膈淋巴结的转移间差异无统计学意义。与肿瘤长径<4 cm的相比,肿瘤长径≥4 cm的病例中,SAMHD1低表达更为显著(P
=0.013),且肿瘤分化程度越差,SAMHD1表达越低(P
=0.001),有腹腔淋巴结转移的食管癌病例中SAMHD1的表达更低(P
=0.044)。见表1。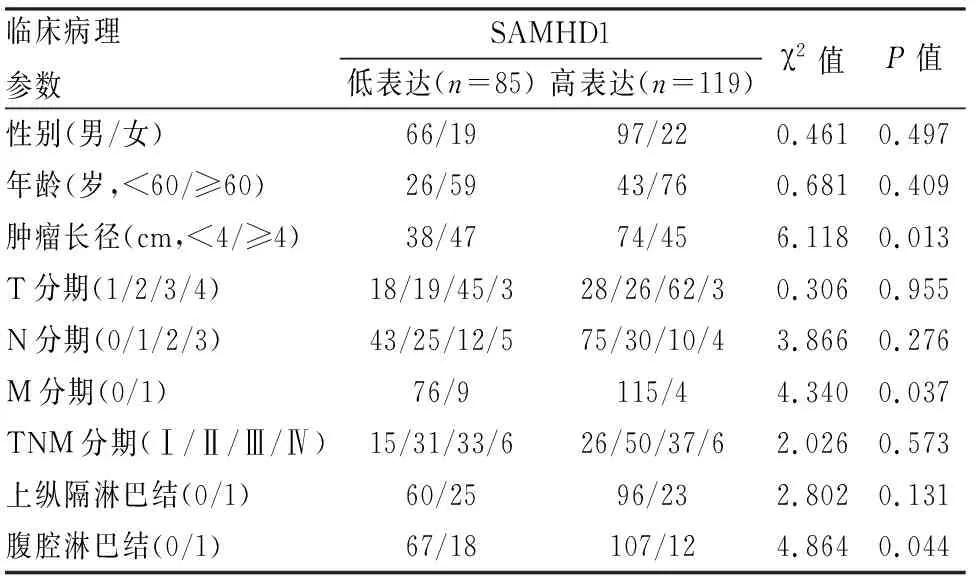
表1 SAMHD1在ESCC组织中的表达与临床病理特征的关系
2.3 SAMHD1表达与食管癌患者预后的关系
2
.3
.1
SAMHD1在ESCC中的表达对累积生存率和无疾病进展生存率的影响 与高表达SAMHD1组相比,低表达SAMHD1组的累积生存率更低 (图2A),差异有统计学意义(P
=0.044);与高表达SAMHD1组相比,低表达SAMHD1组的无进展生存率更低 (图2B), 差异有统计学意义(P
=0.011)。
图2 SAMHD1在ESCC中的表达对累积生存率和无疾病进展生存率的影响
2
.3
.2
204例患者临床特征影响累积生存率和无疾病进展生存率的单因素分析 累积生存率和无疾病进展生存率的单因素分析如表2所示:肿瘤大小、T分期、N分期、TNM分期、上纵膈淋巴结转移、腹腔淋巴结转移、SAMHD1表达影响累积生存率(P
<0.05),而肿瘤大小、分化程度、T分期、N分期、TNM分期、上纵膈淋巴结转移、腹腔淋巴结转移、SAMHD1表达影响无疾病进展生存率(P
<0.05)。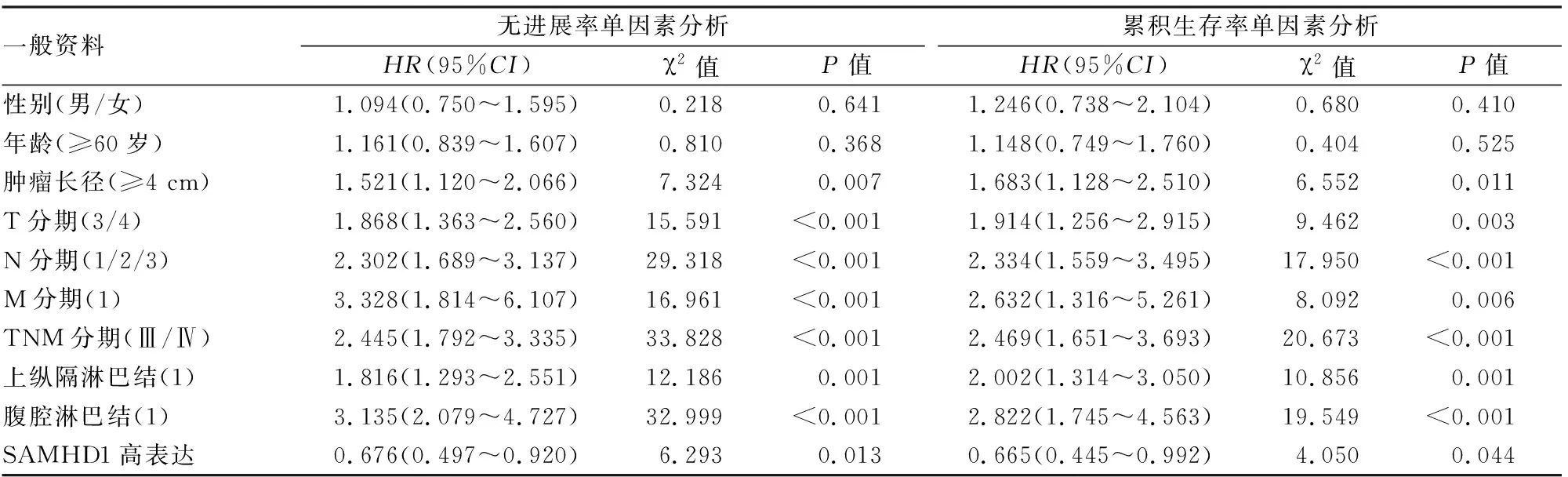
表2 204名患者临床特征影响累积生存率和无进展生存率的单因素分析
2
.3
.3
患者临床特征影响累积生存率和无疾病进展生存率的多因素分析 累积生存率和无疾病进展生存率的多因素分析结果见表3:腹腔淋巴结转移是影响累积生存率的危险因素(P
<0.05),分化程度、T分期、转移、腹腔淋巴结转移、SAMHD1表达是影响无疾病进展生存率的危险因素(P
<0.05)。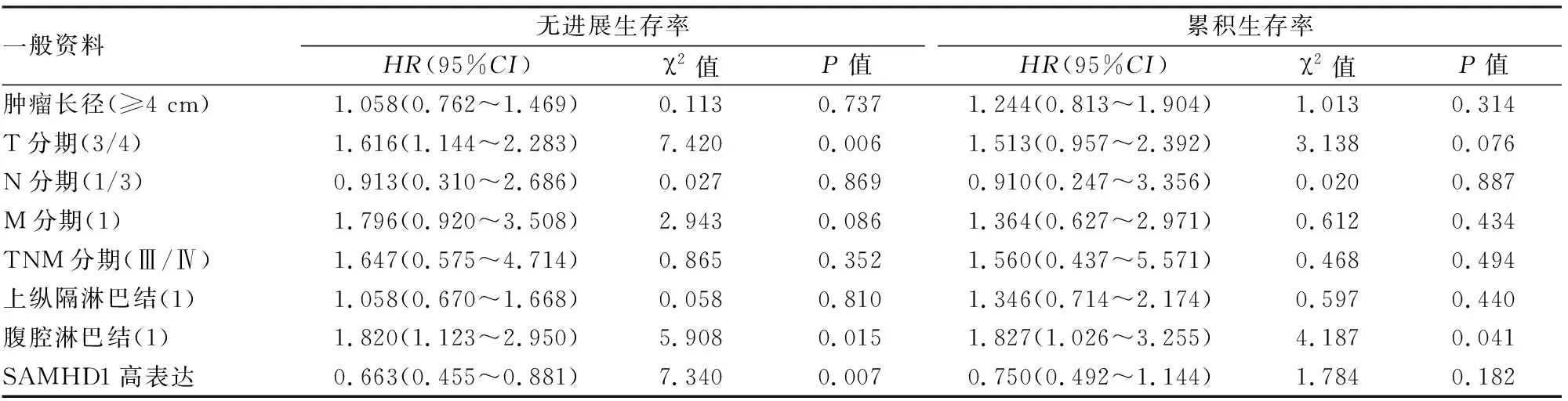
表3 204名患者临床特征影响累积生存率和无进展生存率的多因素分析
3 讨论
临床资料表明,ESCC患者术后5年生存率远高于未行手术切除的。然而,由于早期ESCC没有明显的症状且临床缺乏其早期诊断检测方法,大多数ESCC患者被诊断时为晚期,并且失去了手术最佳治疗窗口。当前,传统的肿瘤标志物,如CEA和细胞角蛋白19片段,被用于诊断和评估ESCC进展。但是,CEA和Cyfra 21-1检测的敏感性和有效性不足以进行早期ESCC检测。因此,迫切需要能够早期ESCC检测的改良生物标记。
SAMHD1在细胞中的生理功能是通过其dNTP酶活性维持细胞内dNTP的体内平衡。dNTPs由核糖核苷酸还原酶(RNR)合成并由SAMHD1水解。Franzolin et al发现SAMHD1在细胞静止期中表达最高,在培养人体细胞中于细胞周期的S期表达最低。且外,在增殖细胞中SAMHD1的下调抑制了细胞周期进程和dNTP库的调节,这表明SAMHD1是DNA前体库的重要调节因子。因此,推测SAMHD1的下调或功能障碍可导致异常的dNTP池和异常细胞周期,可以诱发癌细胞的产生。SAMHD1在几种癌症中的突变或下调,与本研究中食管鳞状细胞癌中的低表达结果相吻合。以上结果表明SAMHD1可能是一种潜在肿瘤抑制因子。此外,与参与细胞周期负调控的Rb
、p
53、CDKN
2A
等抑癌基因和负调控转录因子的WT
、DCC
等基因相似,SAMHD
1作为肿瘤抑制基因,参与肿瘤发生发展,并且如上述研究结果表明,SAMHD1与食管鳞状细胞癌的临床病理学特征具有相关性,SAMHD1低表达的食管鳞癌患者中,其临床病理中肿瘤直径大、肿瘤分化程度差且腹腔淋巴结阳性转移率也高,均预示着肿瘤远期预后较差,且通过单因素与多因素分析结果判断,食管鳞状细胞癌中SAMHD1的表达与患者预后具有相关性,即SAMHD1越低表达,食管鳞状细胞癌患者的生存预后越差。总之,SAMHD1在ESCC组织中的表达明显低于配对的正常组织,并与腹腔区域淋巴转移、TNM分期和肿瘤组织学分化程度相关。较低SAMHD1表达的ESCC患者中,术后生存率及无进展生存率亦较低。因此,SAMHD1可作为预测ESCC肿瘤进展和预后的分子标记物。同时,设想通过一定的方式恢复SAMHD1在癌细胞中的表达,甚至有所提高,也可以成为癌症治疗的一个手段。

