miR-223在甲型流感病毒诱导的肺上皮细胞炎症中的作用机制
刘翠翠,尚立群,段进进,陈瑞琳,张永庆,杨淑梅
NOD样受体蛋白(NOD-like receptor protein,NLRP)家族是NLR的重要成员,其中NOD样受体蛋白3(NLRP3)炎症小体是由NLRP3、凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing CARD,ASC)和半胱氨酸天冬氨酸蛋白酶1前体(pro-cysteine-aspartic acid protease 1,Pro-Caspase-1)组装成的多蛋白复合体,可将Pro-Caspase-1剪切为有活性的Caspase-1,进而剪切白细胞介素前体(pro-interleukin,Pro-IL)包括Pro-IL-1β、Pro-IL-18和Pro-IL-33形成有活性的成熟IL-1β、IL-18和IL-33,分泌至细胞外,介导炎症反应和诱导免疫病理损伤。
微小RNA(microRNA,miRNA)是一类长度约为20~24个核苷酸的内源小RNA,其介导的转录后调控在基因表达的控制中发挥重要作用。研究表明,微小RNA-223(microRNA-233,miR-223)能够特异性作用于NLRP
3 mRNA的3′-UTR区,从而抑制NLRP3的翻译表达。在病毒入侵时,为了避免引起免疫反应,机体会释放miRNA抑制NLRP3炎症小体的激活。目前,关于miR-223在流感病毒引起的肺部损伤中作用的研究报道较少。该研究旨在探究miR-223对流感病毒引起的肺部损伤的作用及其机制,为临床上流感的治疗提供新的理论依据。1 材料与方法
1
.1 材料
收集甲型流感患者32例和正常受试者32例的血清样本,所有患者均知情同意,且本研究已获国家科研伦理委员会批准。正常人肺上皮细胞(bronchial epithelial cells, BEAS-2B)购自中国科学院细胞库,以及甲型流感病毒(influenza A virus, IAV,A/Puerto Rico/8/34/H1N1)(于9~11 d的可育SPF鸡蛋的尿囊内繁殖)。RPMI 1640培养基、胎牛血清购自美国HyClone公司;TRIzol、反转录试剂盒和实时荧光定量聚合酶链反应(RT-qPCR)试剂盒购自美国Promega公司;BCA蛋白质定量检测试剂盒购自美国Thermo Fisher Scientific公司;兔抗鼠NLRP3、兔抗鼠Bax、兔抗鼠Caspase-3、兔抗鼠Bcl-2和鼠抗GAPDH购自美国Abcam公司;转染试剂Lipofectamine3000购自美国Invitrogen公司;PCR引物、miR-223 mimic以及阴性对照NC mimic由北京擎科生物科技有限公司设计、合成。1
.2 实验方法
1
.2
.1
细胞培养 本研究所有细胞常规培养于RPMI 1640培养液(含10%胎牛血清,100 U/ml青霉素及0.1 mg/ml链霉素),置于37 ℃、5% CO的细胞培养箱,隔天换液,细胞融合至80%~90%时传代,传至第3代进行后续实验。1
.2
.2
细胞处理 使用犬肾上皮细胞系MDCK来测定病毒的滴度,感染复数(MOI)为1。使用IAV病毒侵染BEAS-2B细胞,时间分别为12、24、36、48 h,测定细胞活力,后选取最适处理时间(36 h)进行后续实验。使用RT-qPCR检测不同处理组细胞中miR-223或NLRP3的表达情况。1
.2
.3
实验分组 将细胞分为未处理组、IAV组、IAV+NC mimic组、IAV+miR-223 mimic组。IAV病毒侵染的BEAS-2B细胞为IAV组;未感染IAV病毒的BEAS-2B细胞为未处理组;IAV病毒侵染BEAS-2B细胞36 h后用Lipofectamine3000将阴性对照NC mimic以及miR-223 mimic分别转染至BEAS-2B细胞中,分别为IAV+NC mimic组和IAV+miR-223 mimic组。1
.2
.4
RT-qPCR检测mRNA表达 TRIzol法提取BEAS-2B细胞中总RNA,进行反转录合成cDNA。RT-qPCR检测miR-223基因的mRNA表达,β-actin为内参。引物序列如下:miR-223正向序列为5′-ACGTTAGCTACACTTGCGTT-3′,反向序列为5′-AGTGCCGTTGCATACAAAGG-3′;β-actin正向序列为5′-CTCACCATGGATGATGATATCGC-3′,反向序列为5′-AGGAATCCTTCTGACCACTGC-3′。以2法计算基因相对表达量。1
.2
.5
Western blot检测蛋白表达 消化对数生长期的BEAS-2B细胞,接种于25 cm培养瓶中,细胞融合至80%~90%时进行细胞转染。48 h后收集各组细胞,收集细胞上清液,并消化下贴壁细胞,加RIPA裂解液于冰上裂解10 min,4 ℃、12 000 r/min离心30 min(离心半径9.5 cm)。上清液用BCA蛋白质定量检测试剂盒测定蛋白含量后,取30 μg蛋白进行SDS-PAGE凝胶电泳,130 V恒压电泳2 h;湿转法将蛋白转移至PVDF膜上;室温下以含5%脱脂奶粉的Tris缓冲液封闭PVDF膜1 h,冲洗后分别与一抗孵育,4 ℃过夜;TBST清洗膜8 min,重复4次,加相应的辣根过氧化物酶(horseradish peroxidase,HRP)标记的二抗,室温孵育2 h;TBST重复清洗膜4次,ECL试剂盒检测蛋白表达。1
.2
.6
细胞活力的检测 将各组细胞以1×10个/孔的密度接种于96孔板中,于37 ℃、5% CO培养箱中培养24 h;向培养板中加入IAV病毒分别于37 ℃、5% CO培养箱中培养12、24、36、48 h,每个分组设3个复孔并设空白对照,每孔加入20 μl CCK-8溶液,孵育24 h;酶标仪测定450 nm处的OD值。以上实验重复3次,取平均值。1
.2
.7
细胞凋亡率的测定 将miR-223 mimic以及阴性对照NC mimic分别转染BEAS-2B细胞,于37 ℃、5% CO条件下培养48 h;将细胞以1×10个/孔的密度接种在6孔板中。根据细胞凋亡检测试剂盒的说明,用冷的PBS将细胞洗涤2次,然后用细胞凋亡检测试剂盒中的膜联蛋白V-FITC/PI染色。细胞凋亡率用流式细胞仪分析。以上实验重复3次。1
.2
.8
活性氧(reactive oxygen species,ROS)的测定 将BEAS-2B细胞以1×10个/孔的密度接种于6孔板中,于37 ℃、5% CO培养箱中培养24 h;收集细胞,在37 ℃下用ROS指示剂DCFH-DA(10 μmol/L)在PBS中培养30 min。使用流式细胞仪分析荧光。实验独立重复3次。1
.2
.9
miR-223与NLRP3表达量的相关性分析 绘制散点图来判断miR-223与NLRP3表达量之间的关系形态。相关系数根据样本数据计算的miR-223与NLRP3表达量之间线性关系强度的统计量。具体计算公式:r
=Cov
(x
,y
)/σ
σ
。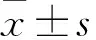
2 结果
2.1 miR-223在IAV感染的患者血清和细胞中的表达
RT-qPCR结果显示,miR-223在流感患者血清中的相对表达量低于正常受试者中的表达,而NLRP
3在流感患者中的相对表达量高于正常受试者中的表达(图1A、B)。进一步的研究表明,BEAS-2B细胞经IAV处理后,细胞活力随时间降低(图1C)。此外,用IAV处理BEAS-2B细胞后,miR-223的相对表达量降低,而NLRP
3的相对表达量增加,且具有时间依赖性(图1D、E)。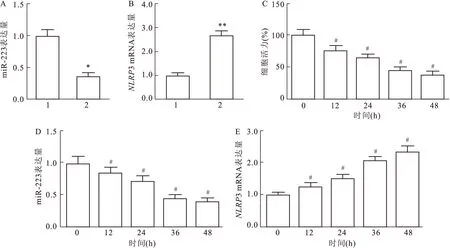
图1 miR-223在IAV感染的患者血清和细胞中的表达
2.2 过表达miR-223对BEAS-2B细胞的炎症和氧化应激的影响
与未处理组相比,IAV处理组炎症因子IL-6、IL-1β和TNF-α的水平显著升高;而将IAV处理的细胞转染miR-223 mimic后,炎症因子的水平降低(F
=5.269,P
=0.031 1,图2A~C)。此外,与IVA组或IVA+NC mimic组相比,IAV+miR-223 mimic组细胞内ROS水平显著降低(F
=7.358,P
=0.021 6,图2D),同样细胞内NAD的水平也明显下降(F
=15.872,P
=0.009 5,图2E)。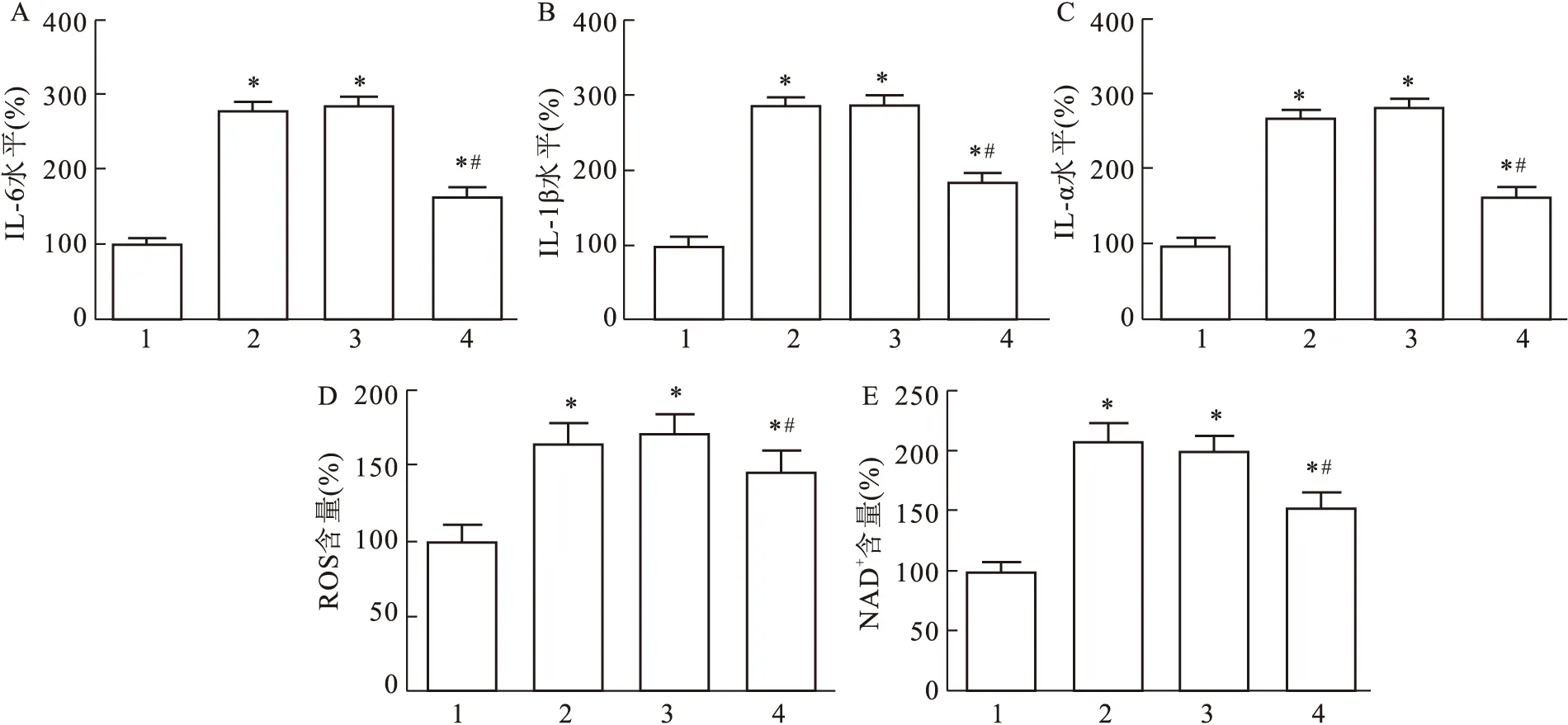
图2 过表达miR-223对BEAS-2B细胞炎症和氧化应激的影响
2.3 过表达miR-223对BEAS-2B细胞凋亡的影响
当细胞经IAV处理后,细胞活力降低,而转染miR-223 mimic使IAV处理的细胞活力显著升高(F
=3.125,P
=0.042 3,图3A);此外,与IAV组相比,IAV+miR-223 mimic组细胞的凋亡率降低(F
=13.687,P
=0.006 5,图3B),且细胞中Caspase-3和Caspase-9的蛋白表达水平和凋亡相关蛋白Bax/Bal-2的比值降低(F
=5.544,P
=0.026 8,图3C~E)。
图3 过表达miR-223对BEAS-2B细胞凋亡的影响
2.4 过表达miR-223对NLRP3的表达以及TLR4/NF-κB通路蛋白表达的影响
与IAV组相比,IAV+NC mimic组NLR3P蛋白表达水平降低(F
=6.766,P
=0.041 1,图4A、B);此外,与IAV组相比,IAV+NC mimic组TLR4和p-p65蛋白水平也显著下降(F
=10.264,P
=0.008 7,图4C、D);通过对32个流感患者血清中miR-223和NLRP3表达量的相关性分析显示,二者表达量呈负相关(F
=8.967,P
=0.025 4,图4E)。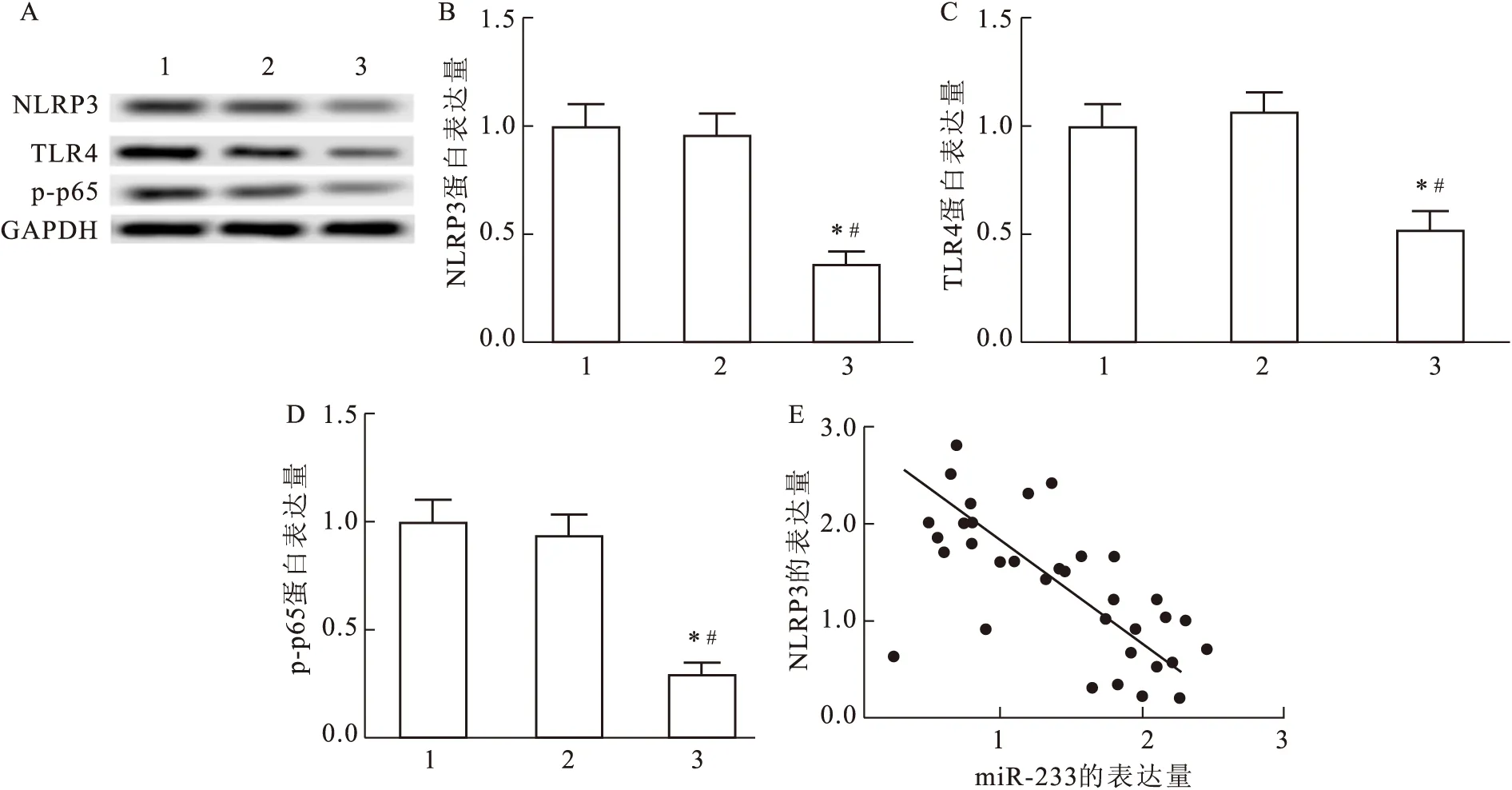
图4 过表达miR-223对NLRP3的表达以及TLR4/NF-κB通路蛋白表达的影响
2.5 miR-223保护IAV诱导的BEAS-2B免受损伤的调控机制
CCK-8检测结果显示,与IAV组相比,IAV+miR-223 mimic组的细胞活力增加;IAV+pcDNA3.1-TLR4组和IAV+pcDNA3.1-NLRP3组细胞活力均减弱(F
=12.364,P
=0.0268,图5A),且IL-1β和ROS的表达水平增加,且细胞凋亡率升高。IAV+pcDNA3.1-NLRP3组和IAV+ miR-223 mimic+pcDNA3.1-TLR4组IL-1β、ROS水平和细胞凋亡率显著低于IAV+miR-223 mimic组,与IAV组无显著性差异(F
=2.168,P
=0.048 7,图5B~D);此外,与IAV组相比,IAV+miR-223 mimic组细胞中Caspase-3的表达水平明显降低;IAV+pcDNA3.1-NLRP3组和IAV+ miR-223 mimic+pcDNA3.1-TLR4组Caspase-3的表达量显著高于IAV+miR-223 mimic组,与IAV组无显著性差异(F
=11.257,P
=0.013 6,图5E)。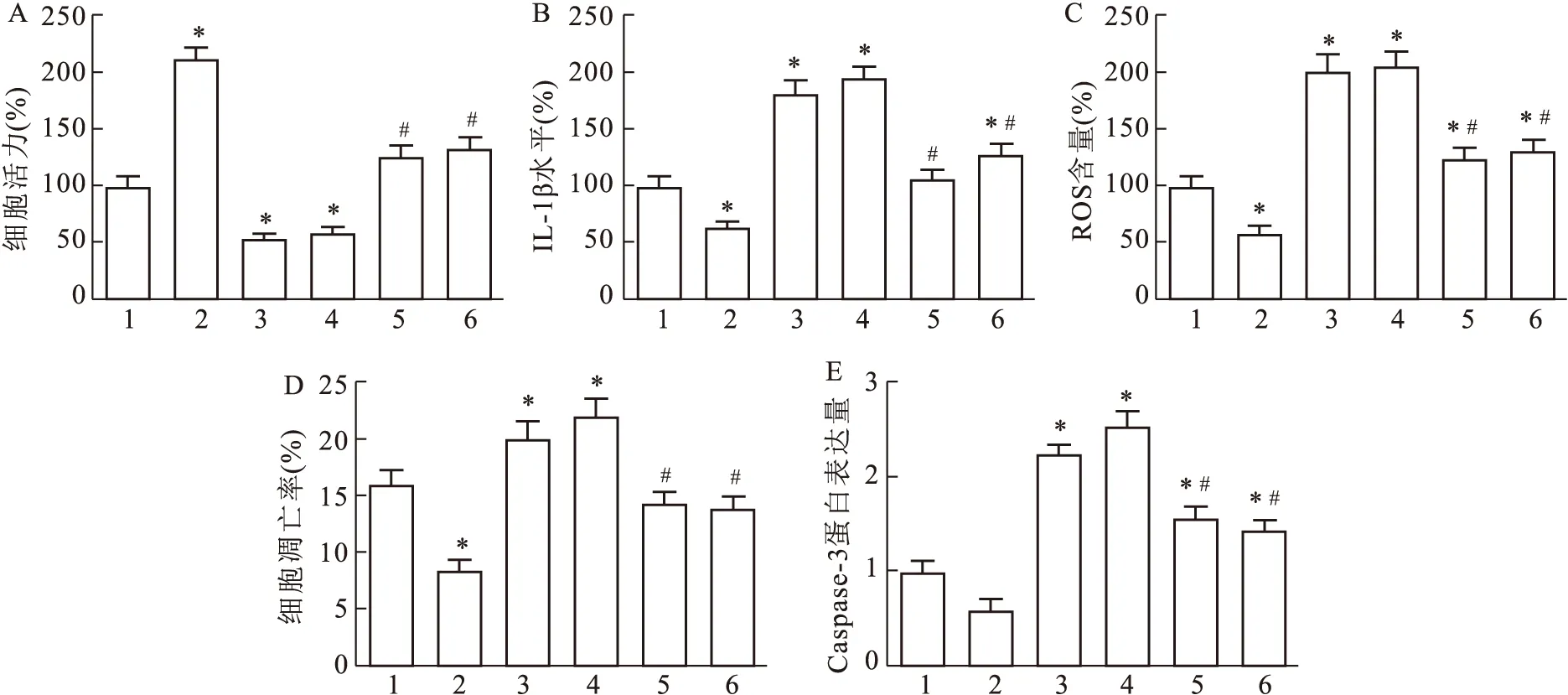
图5 TLR4/NF-κB通路和NLRP3参与miR-223对IAV诱导的细胞损伤的保护机制
3 讨论
IAV可引起反复流行,造成人类高发病率和病死率。因此深入研究IAV的感染致病及免疫反应的机制,对研发流感病毒疫苗和抗病毒药物具有深远意义。该研究表明miR-223在IAV感染的患者血清细胞中的表达均下调,提示miR-223可能与IAV感染过程具有一定的相关性。miR-223广泛参与调控细胞的生物学过程和多种病理过程,如癌症、自身免疫性疾病和炎症性疾病。该研究表明过表达miR-223可抑制IAV诱导的BEAS-2B细胞炎症,这与郝俊芳 等在LPS诱导的小鼠乳腺上皮细胞所得到的结论一致。李芸芸 等指出miR-223可显著降低心脏缺血再灌注后心机细胞的氧化应激反应。此外,miR-223还可抑制糖基化终产物诱导的人脂肪间充质干细胞凋亡。与前人的研究一致,该研究显示过表达miR-223降低IAV诱导的BEAS-2B的细胞凋亡率。以上表明,IAV感染可使miR-223表达下调,过表达miR-223可缓解 IAV诱导的BEAS-2B细胞损伤。
NLRP3炎症小体信号通路在IAV感染后引起炎症反应,并可释放炎症因子放大炎症反应。当IAV感染引起炎症小体激活时,大量的炎性因子会诱导严重肺脏免疫病理损伤,如急性肺损伤和急性呼吸窘迫综合征。Chung et al证实NLRP3炎症小体活化后释放的IL-1β破坏上皮细胞,并进一步诱导IL-6、TNF-α的产生,进而诱发细胞因子引起严重的急性肺损伤。越来越多的研究表明,miR-223能够抑制NLRP3炎症小体活化,进一步抑制炎症性疾病的进展。此外,激活miR-223的转录显著抑制炎性介质NLRP3的活化,并降低IL-1β产生来防止炎症损伤。Sha et al的研究表明,NLRP3在miR-223敲除小鼠表达水平升高,导致IL-1β产生和肠道炎症易感性增加。该研究显示miR-223抑制了NLRP3的活化以及TLR4/NF-κB信号通路的激活,且TLR4/NF-κB通路和NLRP3参与了miR-223对IAV诱导的细胞损伤的保护机制,表明miR-223可能是通过抑制TLR4/NF-κB信号通路并抑制NLRP3炎症小体的活化来抑制IAV感染造成的BEAS-2B细胞损伤。

