低氧降低肺癌A549细胞对培美曲塞的药物敏感性
葛若木,魏 翔,孙晓梅,周 青,汪 渊,张素梅
肺癌严重危害人类的健康,其发病率、病死率都位居世界首位。肺癌的分类有很多种,其中按照组织病理学分类可分成非小细胞肺癌(NSCLC)和小细胞肺癌(SCLC)。抗叶酸制剂培美曲塞(pemetrexed, Pe)是肺癌的常用化疗药物,这种化疗药物结构上含有核心为吡咯嘧啶的基团,作用是破坏细胞内叶酸依赖性的正常代谢过程,抑制细胞DNA复制,进而抑制肿瘤的生长。并且Pe在一定剂量范围内对肺癌细胞增殖有抑制作用且随药物浓度增加而增强。目前临床上Pe作为一线抗癌药物已经被广泛应用,且化疗药物Pe对非小细胞肺癌的疗效十分显著,而化疗药物用药过程中遇到的主要问题就是肿瘤细胞对化疗药物产生耐药。肿瘤微环境的常见情况是不同程度的低氧,且低氧对Pe耐药有影响作用。该研究利用模拟物理低氧环境,研究低氧环境下非小细胞肺癌A549细胞对化疗药物Pe耐药的影响机制。
1 材料与方法
1.1 主要材料与试剂
A549细胞购自美国ATCC细胞库;RPMI 1640培养基购自美国Gibco公司;胎牛血清(FBS)购自杭州四季青公司;二甲亚砜(dimethyl sulfoxide,DMSO)购自美国Sigma公司;BCA试剂盒购自上海碧云天生物技术公司;一抗Bax、Caspase-3、Bcl-2、p53、NF-κB购自美国Millipore公司;山羊抗鼠、山羊抗兔、兔抗山羊二抗购自美国Millipore公司。1.2 主要仪器
酶标仪(型号:Thermo MultiskanGO,美国Thermo-Fisher公司);低温离心机(型号:Sorvall Legend Micro 21R,美国ThermoFisher Scientific公司);电泳仪(型号:DYY-11,北京六一仪器厂);-80 ℃冰箱(型号:MDF-U73V,日本Sanyo公司);CO细胞培养箱(型号:MCO-20AIC,日本Panasonic公司);超净工作台(型号:SW-CJ-1F型,苏州净化设备有限公司);正置显微镜(型号:DM4000B,德国Leica公司);电子天平(型号:DC-120AS,南京苏测计量仪器有限公司);摇床(TS-1型,海门其林贝尔仪器制造有限公司);全自动数码凝胶成像系统(型号:ChemiQ4600,上海欧翔公司)。1.3 方法
1
.3
.1
细胞的培养 从液氮中取出冻存的A549细胞,在37 ℃水浴中复苏,用RPMI 1640培养基(10%FBS、1%青链霉素混合液)于37 ℃、5% CO恒温培养箱中培养,当细胞密度达到80%左右时,用0.25%胰酶进行消化传代。1
.3
.2
低氧处理 将低氧组细胞放置于37 ℃、5% CO、1% O恒温培养箱中培养48 h。1
.3
.3
细胞分组 将A549细胞分为6组:常氧对照组,细胞常规培养未做任何处理;常氧溶剂组,A549细胞培养基中加入DMSO后常氧培养;常氧加药组,在完全培养基中加入Pe,配制成8 μmol/L Pe溶液,将A549细胞置于常氧中培养;低氧细胞组,A549常规培养,置于低氧培养箱中;低氧溶剂组,A549细胞培养基中加入DMSO后低氧培养;低氧加药组,在完全培养基中加入Pe,配制成8 μmol/L Pe溶液,并将A549细胞置于低氧培养箱中培养。1
.3
.4
四甲基偶氮唑蓝(methyl thiazolyl terazolium, MTT)比色法 用完全养基培养A549细胞至对数生长期,然后消化细胞。1 000 r/min离心7 min,收集沉淀的细胞。用完全培养基重悬离心管中的细胞沉淀,制备成单细胞悬液,并计数。在96孔培养板中接种细胞,每个孔大约3 000个,共计种3块96孔培养板,然后置于常氧培养箱中继续培养,至细胞贴壁,约8 h。用完全培养基配置成不同药物浓度(1、2、4、8、16、32、64 μmol/L),然后用这些不同药物浓度的培养基进行换液,另外设置细胞对照组和溶剂对照组,前者用不加药物的完全培养基进行换液,后者用加入DMSO溶剂的完全培养基进行换液。3块培养板分别置于常氧培养箱中继续培养24、48、72 h,然后每孔加入20 μl MTT试剂,在细胞培养箱内继续孵育4 h。随后取出培养板,将每孔中的培养基用枪头吸出,然后每个孔再加入100 μl DMSO,用酶联免疫检测仪在570 nm波长处测定各孔吸光度。1
.3
.5
Hoechst染色 将洁净盖玻片高压灭菌后于70%乙醇中浸泡,移入超净台内用酒精灯烘干。将盖玻片夹除放于6孔板内,然后种入细胞,大约50%的密度。再分别用完全培养基、加入DMSO和Pe的完全培养基换液培养48 h,将培养基吸出,加0.5 ml固定液,10 min后弃去固定液,磷酸盐缓冲液(phosphate buffer saline, PBS)洗3 min,共2遍后吸出PBS。PBS洗涤时用摇床晃动。加入0.5 ml Hoechst 33258染色液,染色5 min。用摇床晃动数次,弃去染色液,PBS洗3 min,共2遍后吸出PBS。洗涤时用摇床晃动。在载玻片上滴1滴抗荧光淬灭封片液,细胞的一面盖向载玻片,让细胞接触封片液,注意不要有气泡产生。用荧光显微镜观察,激发波长350 nm左右,发射波长460 nm左右。1
.3
.6
Western blot检测 A549细胞在6孔板内生长密度达80%后,PBS洗3次,将长满A549细胞的6孔板放在冰上,加100 μl含蛋白酶抑制剂的蛋白裂解液,裂解30 min后,用细胞刮将贴壁的细胞刮下来,收集细胞蛋白于EP管中,4 ℃、14 000 r/min离心30 min,取上清液,用BCA法测定蛋白浓度,根据测出的蛋白浓度数值,将不同分组的细胞,用蛋白裂解液配成同体积同浓度液体,再加上蛋白上样缓冲液,混匀,然后煮沸使蛋白变性,-80 ℃保存。配制SDS-PAGE凝胶,蛋白上样进行电泳,每组蛋白上样量保持一致,然后转移到PVDF膜上。置于封闭液中在摇床上室温封闭2 h,封闭液为5%脱脂牛奶,一抗4 ℃摇床孵育过夜,二抗室温孵育2 h后进行显影。用QuantityOne软件分析各条带的灰度值,并计算。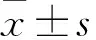
2 结果
2.1 实验适宜的Pe浓度筛选
用MTT比色法筛选Pe适宜实验使用浓度,8 μmol/L Pe对A549细胞的增殖有抑制作用,并与作用时间和作用浓度呈正比,在8 μmol/L的药物浓度下作用48 h后,A549细胞的抑制率达到30%左右,因此选取此浓度作为实验的药物浓度。见图1。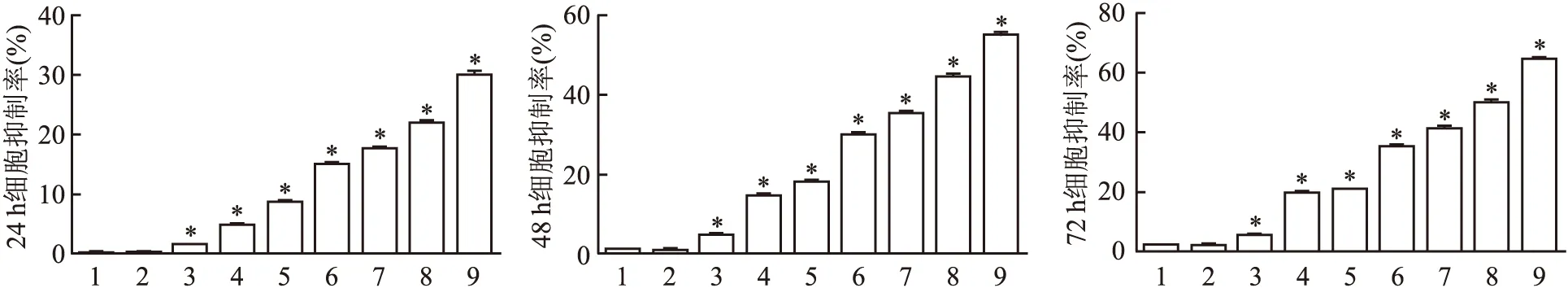
图1 Pe分别作用A549细胞24、48、72 h后细胞的相对抑制率
2.2 A549细胞于Pe作用后在低氧环境与常氧环境下细胞凋亡率比较
常氧环境下,与常氧对照组相比,常氧加药组A549细胞的凋亡率升高,凋亡率约为9%,差异有统计学意义(P
<0.05 )。而在低氧环境下,低氧加药组A549细胞的凋亡率较常氧下降低,凋亡率约为3%,与常氧对照组相比,差异有统计学意义(P
<0.05 )。见图2。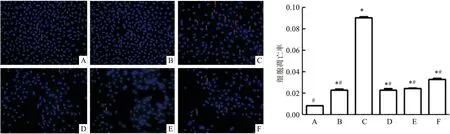
图2 A549细胞作用于Pe后在常氧和低氧培养箱48 h后细胞的凋亡率 Hoechst 33258染色 ×400
2.3 A549细胞在低氧培养箱培养48 h后低氧诱导因子-1α(hypoxia inducible factor-1α,hif-1α)蛋白表达量表达
常氧组与低氧组的各3组细胞分别置于常氧培养箱和低氧培养箱中培养48 h,与常氧对照组比较:低氧培养箱中的3组细胞hif-1α的表达升高,差异有统计学意义(F
=1 150.932,P
<0.05)。见图3。
图3 低氧培养箱培养48 h后hif-1α蛋白表达量
2.4 低氧环境中,加入Pe后,A549细胞中促凋亡蛋白Bax、p53表达量变化
在低氧环境下,低氧加药组促凋亡蛋白Bax表达量较常氧加药组减少 (F
=860.017,P
=0.018)。在常氧环境下,常氧加药组Bax、p53蛋白的表达量升高(F
=860.017、19 601.811,P
<0.05)。而低氧环境下,低氧加药组的p53蛋白表达量远远低于常氧加药组(F
=19 601.811,P
<0.05)。见图4A、B。2.5 低氧环境下,Pe作用于A549细胞后,抗凋亡蛋白Bcl-2 表达量变化
常氧环境下,Pe作用于A549细胞48 h后,常氧加药组Bcl-2蛋白较常氧对照组表达减少,差异有统计学意义(F
=485.856,P
<0.05)。低氧环境下,低氧加药组Bcl-2蛋白表达较常氧加药组差异无统计学意义,但是低氧对照组的Bcl-2蛋白表达量较常氧对照组降低(F
=485.856,P
<0.05)。见图4C。提示低氧环境下,加药后Bcl-2蛋白表达降低幅度要小于常氧环境下。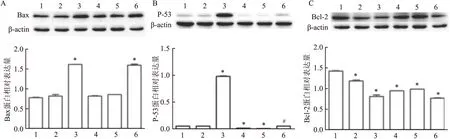
图4 Pe作用于A549细胞48 h后,在常氧和低氧环境下Bax、p53、Bcl-2蛋白表达量
3 讨论
非小细胞肺癌是最常见的肺癌类型,约占所有肺癌的80%。化疗药物Pe是一种新型抗叶酸制剂,常用于晚期非小细胞肺癌的治疗。肿瘤的内环境常处于低氧状态,低氧对肿瘤的生长、增殖、迁移和凋亡都有不同程度的影响。而hif-1α是低氧反应最关键的因子,调节肿瘤细胞的代谢、增殖和血管生成等。近年来,有研究表明在低氧环境下,叶酸抑制了核hif-1α的积累,且呈剂量依赖性。低氧条件下叶酸通过PI3K/AKT/hif-1α途径促进细胞自我保护,体内的低氧环境会对抗叶酸制剂的作用产生影响,所以对Pe耐药机制的研究必须考虑低氧环境对其影响。近年来,细胞凋亡与抗癌药物相互作用的研究越来越多,大量研究表明凋亡是化疗药物引发细胞死亡的主要方式,凋亡成为化疗药物研究和抗肿瘤研究的新焦点。凋亡是多方面因素控制的过程,有多个基因参与,如Bcl
-2家族、抑癌基因p
53等。在人类癌症中,约有50%以上的癌症具有抑癌基因p
53突变,从而导致p53蛋白积聚并失去激活调节细胞周期和凋亡的靶基因的功能。低氧与p53蛋白活性之间存在相互影响的关系,并且p53蛋白与顺铂耐药和hif-1α之间也有联系。除此之外,Bcl
-2家族也参与凋亡的形成和抑制。本研究用低氧培养箱模拟物理低氧环境,观察常氧和低氧环境下肺癌细胞A549的增殖以及凋亡情况。结果显示,常氧环境下,Pe对A549细胞的增殖起到抑制作用,并促进肺癌细胞A549凋亡。而在低氧环境下,Pe的这些作用受到抑制,说明低氧环境减弱了Pe的抗肿瘤作用,且这可能是造成肺癌细胞对Pe耐药的原因之一。该研究表明,常氧环境下,促凋亡蛋白Bax、p53在Pe作用下表达量升高,而抗凋亡Bcl-2蛋白表达减少(P
<0.05),说明Pe对A549细胞有促凋亡的作用;而常氧环境下在Pe作用后,抗凋亡Bcl-2蛋白表达减少(P
<0.05),也说明了Pe减少了A549细胞的抗凋亡作用。但是低氧加药组p53蛋白的表达量较常氧加药组的表达量降低,且与低氧对照组无差异,说明低氧环境使得Pe的促凋亡作用受到了抑制。常氧和低氧环境下,加入Pe后,抗凋亡Bcl-2蛋白的表达量均减少,但是在低氧环境中,Bcl-2蛋白表达量的减少程度小于常氧环境中,说明了在Pe作用后,低氧环境下的A549细胞的抗凋亡作用受到了抑制。这都说明了低氧环境可能减少A549细胞对Pe的敏感性。综上所述,Pe对肺癌A549细胞的增殖具有抑制作用,并促进A549细胞凋亡,而低氧环境会减弱Pe对A549细胞的促凋亡作用。低氧环境对Pe的作用,很可能是通过降低其促凋亡作用来产生的。低氧诱导的凋亡抵抗可能使A549细胞对化疗药物Pe的敏感性降低。该研究只用了1种肺癌细胞A549,在后续的实验中,继续对其他的肺癌细胞株进行研究,以进一步论证低氧环境下肺癌细胞对Pe敏感性的影响。

