地塞米松缓释剂肾囊植入对阿霉素肾病大鼠的保护作用
秦志强,范慢利,王 坤,章 成,周兰兰,3
肾病综合征(nephritic syndrome,NS)是一种主要临床表现为水肿、高脂血症、低蛋白血症和蛋白尿的疾病,并且会进一步恶化成肾功能衰竭,对身体健康会产生极大威胁。低蛋白血症是肾脏疾病最有代表性的临床表现,不仅是肾损伤的标志之一,而且是参与各种肾脏疾病发展的重要致病因素。根据目前的研究,在NS中蛋白尿的产生与肾小球滤过屏障的形态及功能异常之间联系密切,尤其是足细胞裂孔隔膜的结构和功能。肾小球滤过屏障损伤的特点就是产生大量蛋白尿。
学者研究发现了包括Nephrin在内的多个由足细胞表达的分子,对足细胞发挥正常的结构与功能有着重要作用。实验研究表明NPHS
1基因对Nephrin进行编码,而NPHS
1基因突变可导致Nephrin表达缺失,导致裂孔隔膜结构遭到破坏从而产生大量蛋白尿,同时在光学显微镜下可见广泛的肾小球硬化,与芬兰型遗传性肾病综合征密切相关。糖皮质激素(glucocorticoid,GC)是目前临床治疗肾病综合征普遍使用的药物之一。传统激素治疗是一种长期的药物治疗过程,虽然可以控制病情,但副反应表现明显,常见表现为严重感染、骨质疏松和股骨头坏死等合并症。地塞米松缓释植入剂(dexamethasone implant, DexI)是一种新的长效制剂,它能保持稳定和恒定的释放。该研究旨在探讨在大鼠的肾囊进行一次性注射DexI探讨其对阿霉素肾病大鼠的作用以及对作用机制进行探究,为接下来进行临床研究提供理论支持。
1 材料与方法
1.1 药品、试剂与仪器
DexI:安徽四维药业有限公司(合肥)提供,使用0.9%氯化钠溶液溶解配置,现配现用,批号:20141128-2;DexI赋形剂:安徽四维药业有限公司(合肥)提供,使用0.9%氯化钠溶液稀释,现配现用,批号:20140731;注射用盐酸多柔比星:海成药业有限公司提供,使用0.9%氯化钠溶液稀释配置,现配现用,批号:131101;兔抗Nephrin单克隆抗体:Abcam,货号:AB136894;蛋白裂解液:江苏碧云天生物技术研究所提供;蛋白酶抑制剂:江苏碧云天生物技术研究所提供;FITC标记山羊抗兔LgG,北京中杉金桥生物技术有限公司提供,批号:122319A;免疫组化染色试剂盒,北京中杉金桥生物技术有限公司提供,批号:13152A06,122319A。1.2 阿霉素肾病模型(adriamycin-induced nephropathy,AIN)制备及24 h尿蛋白检测
雄性SD清洁级大鼠,体质量150~200 g,来自安徽医科大学动物实验中心(许可证号:SCXK(皖)2017-001),所有实验动物均符合美国国立卫生研究院(NIH)关于实验动物护理和使用指南,并经安徽医科大学动物护理和使用委员会批准(许可证号:SYXK(皖)2017-006)。随机分为对照组和模型组,模型组大鼠尾静脉注射阿霉素4 mg/kg,隔周再次注射阿霉素3.5 mg/kg制备肾病模型,整个成型实验连续进行4周。实验过程中,大鼠单独置于特制代谢笼,禁食不禁水,收集24 h尿液,取上清液,采用双缩脲法测定24 h尿蛋白含量。造模前及造模后每周检测1次24 h尿蛋白,连续4周,成模后再连续检测8周。1.3 实验分组给药及肾囊注射术
1
.3
.1
实验分组给药 雄性SPF级大鼠,取成模大鼠随机分为单纯模型组(Model组)、受试药辅料组(Exc组)、受试药高中低剂量组(DexI 2.8、1.4、0.7 mg/kg)和地塞米松阳性对照组(Dex 0.1 mg/kg)。对照组随机分为正常对照(WT组)和假手术组(Sham组),假手术组进行手术操作而没有肾内注射,模型组处以手术操作以及DexI的肾囊穿刺,辅料组进行手术操作以及在肾囊内注射对照赋形剂(1.4 mg/kg,Accessory组),受试药组分别在肾囊内一次性地塞米松注射给药(2.8、1.4、0.7 mg/kg)。阳性药对照组采用灌胃给药地塞米松(0.1 mg/kg,qd),连续给药8周。1
.3
.2
肾囊注射术 水合氯醛(300 mg/kg)麻醉大鼠,无菌条件下行背部正中切口,逐层剥离皮肤、肌肉、腹膜,分别暴露大鼠两侧肾囊,使用特制针进行药物的肾囊内注射,完成注射后对手术切口逐层缝合,最后在切口处滴加青霉素注射液(现配现用)进行消毒。1.4 阿霉素肾病大鼠肾功能检测
造模前及造模后每2周进行1次血肌酐(serum creatinine,SCR)和尿素氮(blood urea nitrogen,BUN)检测。采样时对大鼠使用内眦静脉取血后处理得到血清,采用碱性苦味酸法分光光度计检测比色,测算血清SCR含量。采用氨基硫脲与二乙酰一肟在磷酸溶液反应方法分光光度计检测比色,测算血清BUN含量。1.5 阿霉素肾病大鼠肾脏HE病理组织学检查
实验结束后,麻醉大鼠,用预冷0.9%氯化钠溶液和浓度为4%多聚甲醛灌注后取肾,依次用4%多聚甲醛及20%和30%蔗糖水溶液固定。按标准操作制备石蜡切片。每组选择4只动物制作切片,使用光学显微镜(200×)观察肾皮质,每张动物切片选取5个高倍视野。。1.6 免疫组织化学法检测阿霉素肾病大鼠肾组织Nephrin的表达
大鼠腹腔注射水合氯醛(350 mg/kg),按上述方法灌流取肾,常规制备石蜡切片,采用过氧化物酶标记的链霉卵白素法染色法染色。具体操作步骤按试剂说明书进行。每组4只动物,每张切片选取5个高倍视野,显微镜下观察切片Nephrin表达,采用Image-Pro Plus 6.0专业图片分析软件测量免疫阳性产物平均光密度(MOD)值。1.7 免疫印迹法检测阿霉素肾病大鼠肾组织Nephrin的表达
实验结束后处死大鼠,摘取肾脏,取肾皮质50 mg,加入400 μl 蛋白裂解液和 10 μl 蛋白酶抑制剂研磨,提取总蛋白。按照标准操作流程进行聚丙烯酰胺凝胶电泳。使用专属Bioshine ChemiQ 4600化学发光成像系统对图片进行收集工作,对收集的图片使用Image J软件测定目的蛋白对应的条带与对应内参条带之间灰度值的比值。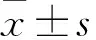
2 结果
2.1 大鼠AIN的建立
建立改进版AIN模型,AIN处理的动物在造模1周后出现体质量值下降、活动性降低、毛发脱落、进食量降低等表征。建模2周后,大鼠出现明显的全身性水肿以及毛发直立等现象。建模3周后,24 h尿蛋白开始增加一直持续到12周,血肌酐(表1)和尿素氮(表2)于第4周开始上升,一直持续到12周。模型建立12周后,大鼠外观明显消瘦。如图2所示,根据切片观察得出AIN处理的病理学表现为肾小管大量扩张、系膜区增大、部分肾小球萎缩、肾小管上皮细胞呈空泡状、炎性细胞大量浸润、局部组织纤维化等典型特征。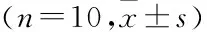
表1 地塞米松植入剂一次性肾囊植入对阿霉素肾病大鼠血肌酐的影响
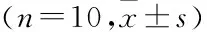
表2 地塞米松植入剂一次性肾囊植入对阿霉素肾病大鼠尿素氮的影响
2.2 DEXI对AIN大鼠24 h尿蛋白的影响
造模前及造模后每周检测1次24 h尿蛋白,结果见图1所示。造模前各组含量无明显差异,与假手术组比较,模型组24 h尿蛋白从第3周开始增加持续到第12周(P
<0.05,P
<0.01)。与模型组比较,第6周开始,DexI各组24 h尿蛋白开始降低,持续至12周,差异有统计学意义(P
<0.05,P
<0.01)。从第7周开始,口服阳性对照Dex组24 h尿白开始下降并持续至12周,差异有统计学意义(P
<0.05,P
<0.01)。治疗第8~12周,高剂量DexI降尿蛋白作用强于Dex,差异无统计学意义。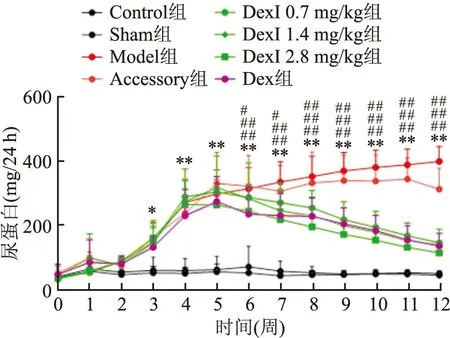
图1 DexI对阿霉素肾病大鼠不同时间段24 h尿蛋白的影响
2.3 DEXI对阿霉素肾病大鼠肾功能的影响
根据表1和表2数据,与假手术组比较,进行DexI处理的大鼠在第4周至第12周血肌酐和尿素氮明显增加,具有统计学意义(P
<0.01),与对照组数据比较具有统计学意义(P
<0.05,P
<0.01)。与模型组相比,AIN大鼠的血肌酐水平在DEXI各组中的第6周至12周降低,差异有统计学意义(P
<0.05,P
<0.01),口服地塞米松对照组给药后第8~12周血肌酐水平下降,差异有显著性(P
<0.01)。与模型组相比,受试药各组和地塞米松阳性对照组给药后第8~12周均可显著降低阿霉素肾病大鼠的尿素氮水平,差异有统计学意义(P
<0.05)。2.4 DexI改善AIN诱导的肾脏组织病理学的破坏
经HE染色处理,在光学显微镜下观察(×200),正常组和假手术组肾组织没有发生明显改变(图2A、B)。单纯AIN处理组和单纯DexI赋形剂可观察到明显变化,包括明显地肾小管舒张、部分肾小球萎缩、上皮细胞呈现空泡样、系膜细胞增生、肾囊壁加厚、肾球囊出现明显粘连、毛细血管淤塞、伴随炎性细胞大量浸润、肾纤维化(图2C、D)。治疗8周后,受试药各剂量组和地塞米松阳性对照组炎性细胞浸润均有明显改善,肾小管舒张和肾间质纤维化均有明显改善(图2E~G)。DexI高剂量组间质组织无肾小球出血和炎性细胞浸润(图2E)。口服阳性对照Dex组有轻度肾小球出血,间质组织中仍有炎性细胞浸润(图2H)。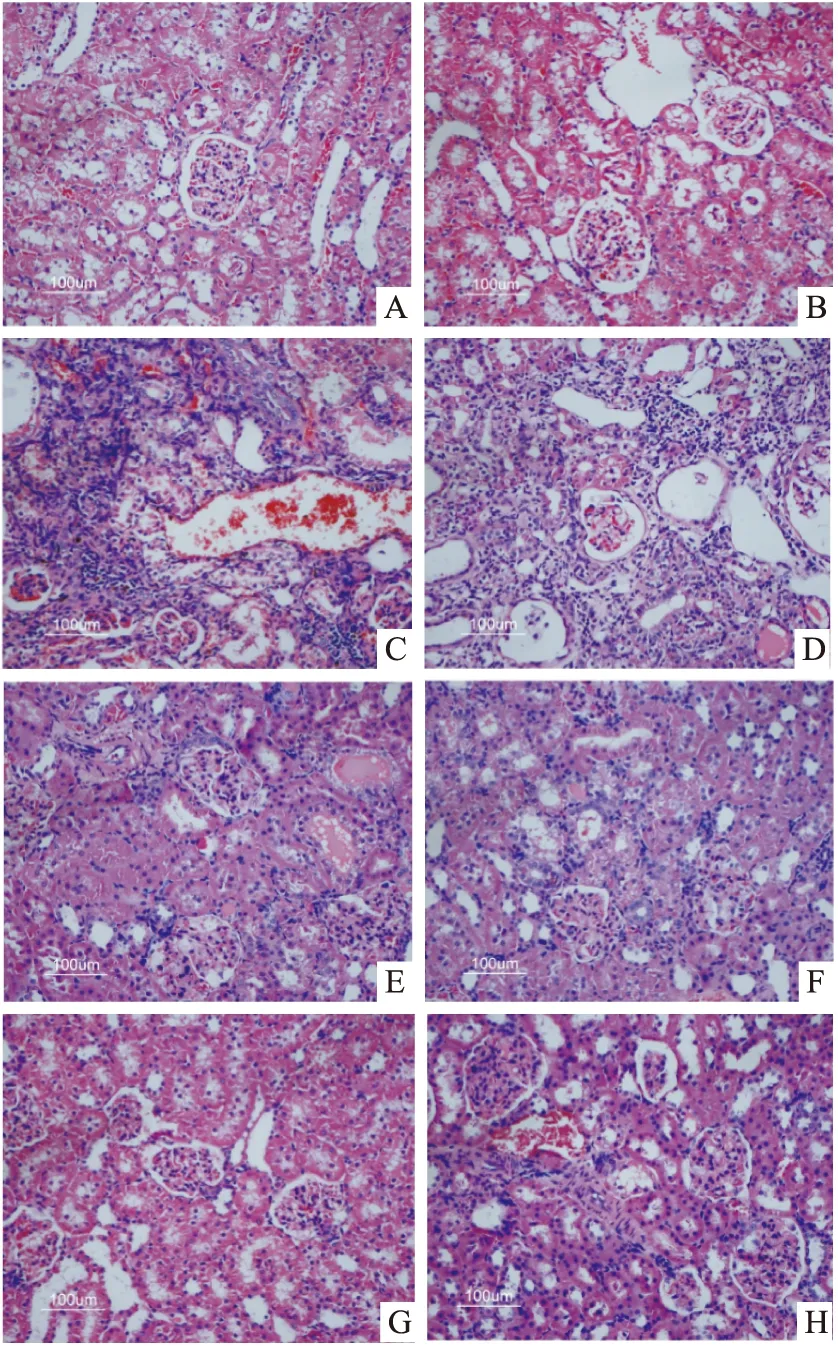
图2 DexI处理对AIN大鼠肾组织病理学的影响 HE染色 ×200
2.5 DexI对AIN大鼠肾组织Nephrin表达的的影响
根据免疫组化实验结果,Nephrin在正常对照组和假手术组几乎没有阳性表达,而在单纯AIN处理组和DexI赋形剂组表达明显;阳性表达主要沿着肾小球毛细血管呈现袢线性分布,可观察到明显的棕色颗粒状。与正常组对比,单纯AIN处理组和DexI赋形剂组Nephrin阳性表达明显增加,差异有统计学意义(P
<0.01)。与模型组相比,DEXI各剂量组和口服地塞米松阳性对照组可显著降低大鼠肾组织Nephrin的表达,差异有统计学意义(P
<0.05,P
<0.01)。见图3。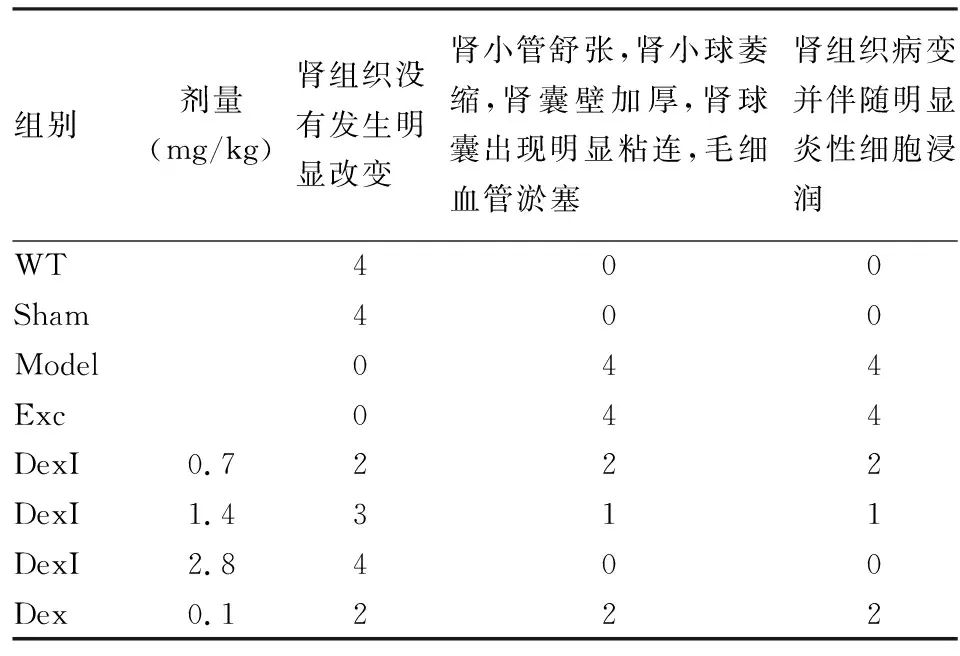
表3 DexI处理对AIN大鼠肾组织病理学分级程度分布的影响(n=4,只)
图3 DexI对AIN肾组织Nephrin表达的影响 免疫组化 ×400
2.6 DexI对AIN大鼠肾组织Nephrin表达的影响
与正常对照和假手术组相比,单纯AIN处理组和DexI赋形剂组Nephrin蛋白的表达量明显增加,差异有统计学意义(P
<0.01)。与模型组相比,DexI高、中、低剂量和口服地塞米松阳性对照可显著抑制大鼠肾组织Nephrin蛋白表达水平的增加,差异有统计学意义(P
<0.05,P
<0.01)。见图4。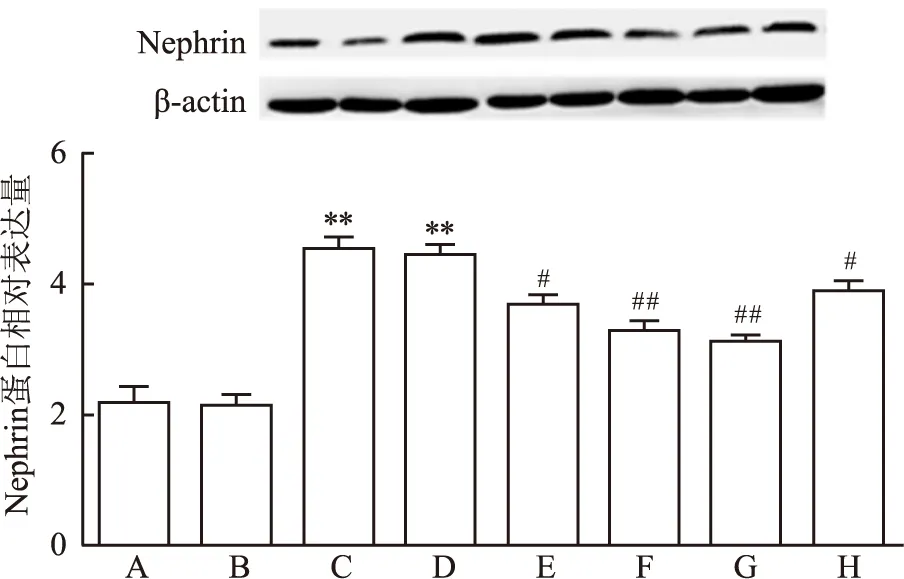
图4 地塞米松植入剂肾囊植入对阿霉素肾病大鼠肾组织Nephrin表达的影响
3 讨论
肾病综合征以大量蛋白尿、低蛋白血症、高脂血症和水肿为特征,最终可导致肾功能衰竭。目前,临床缺乏对肾病综合症有效的治疗手段。本研究旨在探讨一种新的地塞米松缓释剂对阿霉素肾病的治疗作用。采用一次性肾囊植入受试药的方法,并与连续8周口服药物进行比较。
建立一种可靠、稳定的肾病综合征动物模型,是研究肾病的重要手段,也是开发新的、有效药物的前提。Pereira et al建立的阿霉素肾病动物模型是目前公认的能较好模拟人类CDC的动物模型。本实验建立模型后连续观察8周,大鼠外观明显消瘦,一般状态差,NS受损金指标24 h尿蛋白持续稳定升高,肾功能也持续异常。病理组织学显示肾小管扩张,部分肾小球萎缩,系膜细胞增生,系膜区增大,肾小管上皮细胞空泡样改变,大量炎性细胞浸润,局灶性纤维化等典型阿霉素肾病改变。
与AIN组相比,DexI一次性肾囊植入的大鼠一般情况好,干预4周后,水肿症状及腹泻症状减轻,精神状态基本恢复,食物和饮水量明显增加(本文未作数据显示)。与口服对照大鼠比较,DexI植入剂组大鼠拥有更高的体质量和更好的状态。受试药各组和口服8周阳性对照组24 h尿蛋白含量均明显下降,并可显著降低血肌酐及尿素氮水平,改善肾功能,表明地塞米松植入剂一次性肾囊植入可与长期口服药一样,可以保护阿霉素肾病大鼠的肾功能损害,并可有效降尿蛋白。DexI高剂量组的降尿蛋白等作用强于口服给药组。
糖皮质激素是目前用于治疗肾病综合征的常规药物之一。然而,糖皮质激素对足细胞和肾小球的保护作用机制尚未明确。有研究表明,可能与影响足细胞裂孔隔膜相关蛋白分子的表达和分布有关。足细胞蛋白在形成完整的抗蛋白尿过程中起着关键作用,维持足细胞结构和肾小球滤过屏障功能。Nephfin是芬兰科学家Kestina在1998年首次鉴定的蛋白分子,特异性分布于裂孔隔膜。NS大鼠肾组织Nephrin表达与蛋白尿的严重程度呈正相关。本研究免疫组化和Western blot 检测均发现,阿霉素肾病大鼠造模12周后 Nephfin表达明显升高上升。DexI各组一次性肾囊植入和长期口服治疗均可显著下调Nephrin蛋白的过度表达,且DexI作用更强。
目前,有关阿霉素肾病大鼠Nephfin蛋白表达与尿蛋白的相关性呈现两种结果,Xing et al研究从造模第1周开始持续升高至第4周,结果显示Nephfin蛋白表达与病情正相关,与本研究结果高度一致,本研究阿霉素肾病造模一直延续至第12周。但也有研究显示,阿霉素肾病大鼠Nephrin蛋白是减少的,与尿蛋白呈现负相关关系。不同研究结果可能与建模过程中取材时间点有关,有文献显示整个造模过程中,Nephrin蛋白表达量呈现动态变化特点,可能对应着肾脏疾病发展的不同阶段。
总之,该实验表明地塞米松缓释植入剂作为一种新的药物剂型,通过肾囊植入,一次给药,可以明显达到与长期口服给药同等甚至更好的效果,改善阿霉素肾病大鼠的症状,增强其抵抗力,并能对抗病理组织学的损伤。其作用机制可能与下调足细胞Nephrin蛋白的表达,保护肾小球滤过屏障损伤有关。该新制剂对肾病的保护作用及在减少药物副作用和并发症方面的作用需要继续探讨。

