裸鼠异种移植急性T淋巴细胞白血病模型的建立
张爱君,潘文文,胡晓曦,吴育晶,魏 伟
急性T淋巴细胞白血病(acute T-cell lymphoblastic leukemia, T-ALL)是一种来源于骨髓的侵袭性恶性肿瘤。近年来,我国T-ALL发病率呈升高趋势,部分患者出现耐药和复发等现象导致预后不佳,因此T-ALL的相关病理机制和药理学研究有着重要意义。目前对T-ALL疾病发病机制的认识很大程度上来源于对人体以及原代人T-ALL细胞的体外研究,在研发治疗T-ALL新药的药理学研究中,实验动物模型的选择和建立至关重要。目前的白血病动物模型包括异种移植性白血病、自发性白血病、诱发性白血病和转基因动物模型,其中异种移植性白血病模型较为常用,多选用BALB/c 裸鼠造模。T-ALL动物模型的建立除了动物种类,移植途径的选择也很重要。因此,为了建立操作简便、经济可靠、重复性好和观察指标明确的T-ALL模型,该文将通过比较尾静脉移植和皮下移植人Jurkat细胞建立异种移植T-ALL裸鼠动物模型的优缺点,为研究T-ALL的发病机制以及相关新药的研发奠定实验基础。
1 材料与方法
1.1 主要药物、试剂与仪器
环磷酰胺粉针剂(CTX,0.2 g/支)购自安徽医科大学第一附属医院;BV421抗人CD3抗体购自美国BioLegend公司;CD3抗体购自美国Santa Cruz公司;Triton X-100购自上海碧云天公司;EDTA抗原修复液、HO、DAB购自北京中杉金桥生物技术有限公司;仪器Olympus显微成像系统购自日本Olympus公司;CytoFLEX型流式细胞仪购自美国贝克曼公司;人白介素-2(interleukin-2, IL-2)ELISA试剂盒购自南京优宜佳生物科技有限公司;Tecan Infinite M1000酶标仪购自瑞士TECAN公司。1.2 细胞来源与培养
人Jurkat细胞株购于美国ATCC细胞库,将Jurkat细胞置于10%灭活胎牛血清、1%双抗的RPMI 1640培养液中,然后放入37 ℃、5% CO恒温培养箱中培养。1.3 实验动物
40只雌性BALB/c裸鼠,5周龄,体质量17~20 g,购自江苏集萃药康生物科技有限公司[SPF级,合格证号:SCXK(苏)2018-0008]。1.4 T-ALL白血病细胞移植
将40只裸鼠随机分为正常组(n
=10)、尾静脉移植组 (n
=15)和皮下移植组(n
=15)。粉针剂环磷酰胺用灭菌0.9 %氯化钠溶液稀释成浓度为20 mg/ml的溶液,腹腔注射CTX 2 mg/只,连续注射2 d;第3天收集处于对数生长的Jurkat细胞,调整细胞密度至2.5×10个/ml。尾静脉移植组裸鼠,尾静脉缓慢注射无菌Jurkat细胞5×10个/只(0.2 ml),连续注射2 d;皮下移植组裸鼠,于裸鼠颈背皮下注射无菌Jurkat细胞5×10个/只(0.2 ml),连续注射2 d。1.5 动物饲养
所有裸鼠饲养在层流架上无菌独立送风隔离IVC笼中, 与其接触的物品、饲料和饮用水均须灭菌处理。SPF条件下饲养1周后正常组裸鼠尾静脉注射0.2 ml无菌PBS,其余两组分别采取尾静脉移植和皮下移植进行细胞移植。1.6 观察记录
每天观察裸鼠进食、行动、弓背及精神情况;每周记录1次体质量。裸鼠出现明显消瘦、弓背、精神萎靡、体质量下降20%时视作濒死状态。1.7 标本采集及处理
分别在造模第7天和第14天时裸鼠尾部取血20 μl,进行流式细胞术检测并挑选出造模成功裸鼠。造模第28天裸鼠出现明显消瘦、弓背、体质量下降超过20%,眼球取血后颈椎脱臼法处死并取出裸鼠肝、脾组织,取部分脾脏轻轻研磨,制成单细胞悬液用于流式细胞术检测,剩余组织置于4%的多聚甲醛中常温保存。1.8 流式细胞术检测裸鼠外周血、脾脏和骨髓中Jurkat细胞
分别将第7天和第14天时取的20 μl外周血,用红细胞裂解液完全裂解后离心得细胞沉淀,然后向细胞沉淀中加入50 μl PBS重悬混匀,加入检测所需抗人CD3流式抗体,混匀后4 ℃避光孵育30 min。清洗1次后流式细胞仪上机检测Jurkat细胞在裸鼠外周血中的百分比。以裸鼠外周血中有Jurkat细胞表达为造模成功。根据Jurkat阳性裸鼠数量计算造模成功率,挑出造模成功裸鼠进行后续实验。第28天颈椎脱臼处死裸鼠后,取出脾脏充分研磨,获取的脾脏细胞用50 μl PBS重悬混匀,同法加入抗体孵育后用流式细胞仪检测。取得的骨髓细胞用50 μl PBS重悬混匀,同法加入抗体孵育后流式细胞仪检测。通过检测各组裸鼠脾脏和骨髓细胞中人CD3细胞百分比,反映裸鼠脾脏和骨髓细胞中Jurkat细胞浸润情况。
1.9 外周血和骨髓瑞氏-吉姆萨染色
取第28天裸鼠新鲜的抗凝全血1滴(约5 μl),置于干净载玻片的一端1 cm处,左手持载玻片,右手持推片从血滴前方后移接触血滴,使血滴沿推片后缘展开,推片与载玻片以30°~45°、匀速、平稳地向前移动推制成血涂片,滴加瑞氏-吉姆萨染液,染色1 min,再将磷酸盐缓冲液滴加于瑞氏-吉姆萨染液上,以洗耳球吹出微风使液面产生涟漪状,使两液充分混合,染色3~10 min,流水冲洗,待干,镜检。剪掉裸鼠大腿上的皮肤和肌肉,暴露股骨及两端相连的关节,然后从股骨两端关节头处取下股骨,剪断股骨一端,用抽有0.9%氯化钠溶液的1 ml注射器插入骨髓腔深处,将冲出的骨髓液用200目纱网过滤,PBS溶液冲洗1遍后,取10 μl左右进行瑞氏-吉姆萨染色,在光学显微镜下计数200个有核细胞,计算其中Jurkat细胞所占比例(%)。1.10 裸鼠肝脾病理学和免疫组化学分析
取4 %的多聚甲醛固定48 h后的组织样本,石蜡包埋、切4 μm组织切片。取正常裸鼠对应组织用于组织病理学等对照。采用苏木精-伊红染色法对所取组织进行染色,光学显微镜观察组织病理学变并拍照,检测Jurkat肿瘤细胞株在肝脏和脾脏组织中的浸润情况及病理改变。1.11 裸鼠肝脾组织免疫组织化学染色
各组裸鼠肝脾组织的石蜡切片经60 ℃恒温箱烘烤2 h,经脱蜡和水化后用抗原修复液热修复15 min,冷却后用山羊血清封闭20 min,加入抗人CD3一抗(1 ∶50),4 ℃孵育过夜。第2天取出复温,洗涤后加入二抗37 ℃孵育20 min,PBS洗涤3次滴加DAB显色,选取适当时候终止反应。苏木精染色10~30 s后用蒸馏水冲洗后再经脱水、晾干后,中性树脂封片。最后光学显微镜下观察Jurkat细胞浸润情况。细胞染色呈棕黄色为阳性。1.12 ELISA检测血清IL-2表达水平
按照人IL-2细胞因子ELISA检测试剂盒说明书操作,检测裸鼠血清中IL-2浓度,反映浸润Jurkat细胞分泌炎性细胞因子功能。将标准品倍比稀释,检测时分别设待测样品孔和空白孔(空白孔不加样品及酶标试剂,其余步骤相同),每孔加入100 μl标准品或样品,37 ℃孵育90 min,洗板4次,尽量甩干洗液。每孔再加入100 μl生物素化抗体工作液,封口37 ℃孵育60 min,再次洗板后加入100 μl酶结合物工作液,封口,37 ℃孵育30 min,洗板,加入100 μl显色剂,37 ℃孵育10~20 min加入100 μl终止液用酶标仪立即读取450 nm吸光度值,最后根据标准曲线计算裸鼠血清中IL-2浓度。1.13 统计学处理
SPSS 24.0和GraphPad Prism8软件对结果进行统计学分析。数据用%表示,两组间比较采用t
检验,多组间差异的比较采用单因素方差分析(ANOVA)。P
<0.05为差异有统计学意义。2 结果
2.1 整体观察结果
尾静脉移植组和皮下移植组至第7天未出现明显变化,于第14天开始表现出嗜睡、饮食欠佳等状态,于第21天尾静脉移植组和皮下移植组出现弓背、消瘦、活力减低和明显萎靡不振等现象(图1),于第28天则有部分裸鼠出现濒死状态,伴有脊柱弯曲。正常对照组裸鼠正常生长,活泼好动,食欲精神良好,未出现病态体征。
图1 第21天T-ALL裸鼠整体状态1:正常组;2:尾静脉移植组;3:皮下移植组
2.2 指标检测
2
.2
.1
外周血、骨髓和脾脏流式检测结果 正常组BALB/c裸鼠无胸腺,为先天性T细胞免疫缺陷,人Jurkat细胞表面特异性标志物为CD3,通过流式细胞术检测人CD3细胞的百分比可以反映移植入BALB/c裸鼠体内的Jurkat细胞的百分比。第7天和第14天外周血流式细胞术检测结果显示Jurkat细胞在造模第7天时已经在外周血中浸润,其中尾静脉移植组裸鼠外周血中Jurkat细胞百分比平均为7.24%,皮下移植组平均为4.30%。第14天外周血中Jurkat细胞百分比,尾静脉移植组(16.16%±3.30)高于皮下移植组(8.14%±1.05)(t
=5.241,P
<0.01,图2)。第28天裸鼠脾脏细胞流式细胞术检测结果显示:尾静脉移植组和皮下移植组裸鼠脾脏中均有Jurkat细胞表达,且尾静脉移植组(7.31% ± 2.30%)Jurkat细胞百分比高于皮下移植组(3.60%±1.95%)(t
=3.838,P
<0.01);骨髓细胞检查结果与脾脏一致,尾静脉移植组和皮下移植组裸鼠骨髓中均有Jurkat细胞表达,尾静脉移植组(3.95% ± 2.95%)Jurkat细胞百分比高于皮下移植组(1.90%±1.35%),差异有统计学意义(t
=2.846,P
<0.05)(图3)。尾静脉移植组成模率为73%,皮下移植组成模率为40%。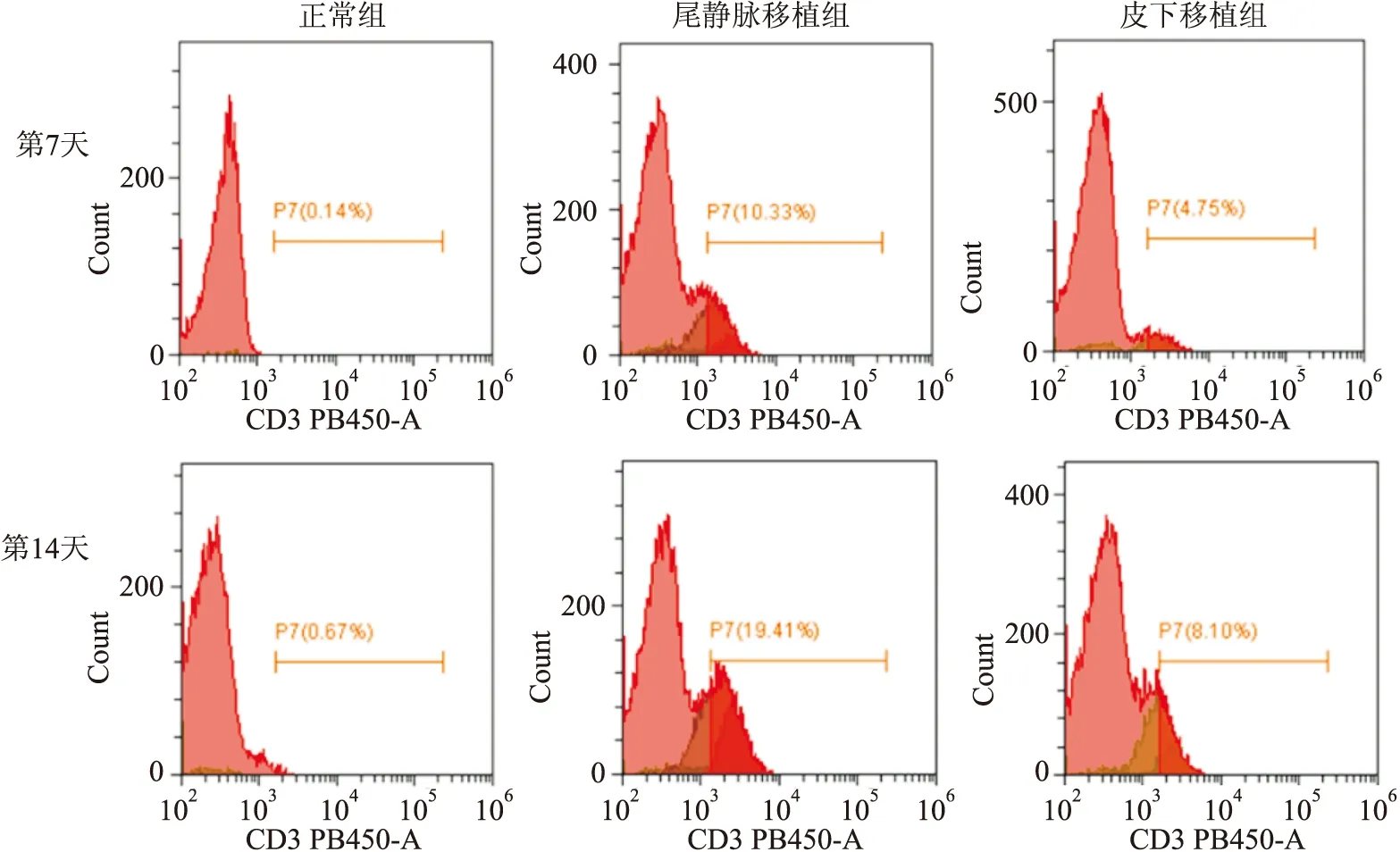
图2 流式细胞术检测第7天和第14天Jurkat细胞在裸鼠外周血中百分比
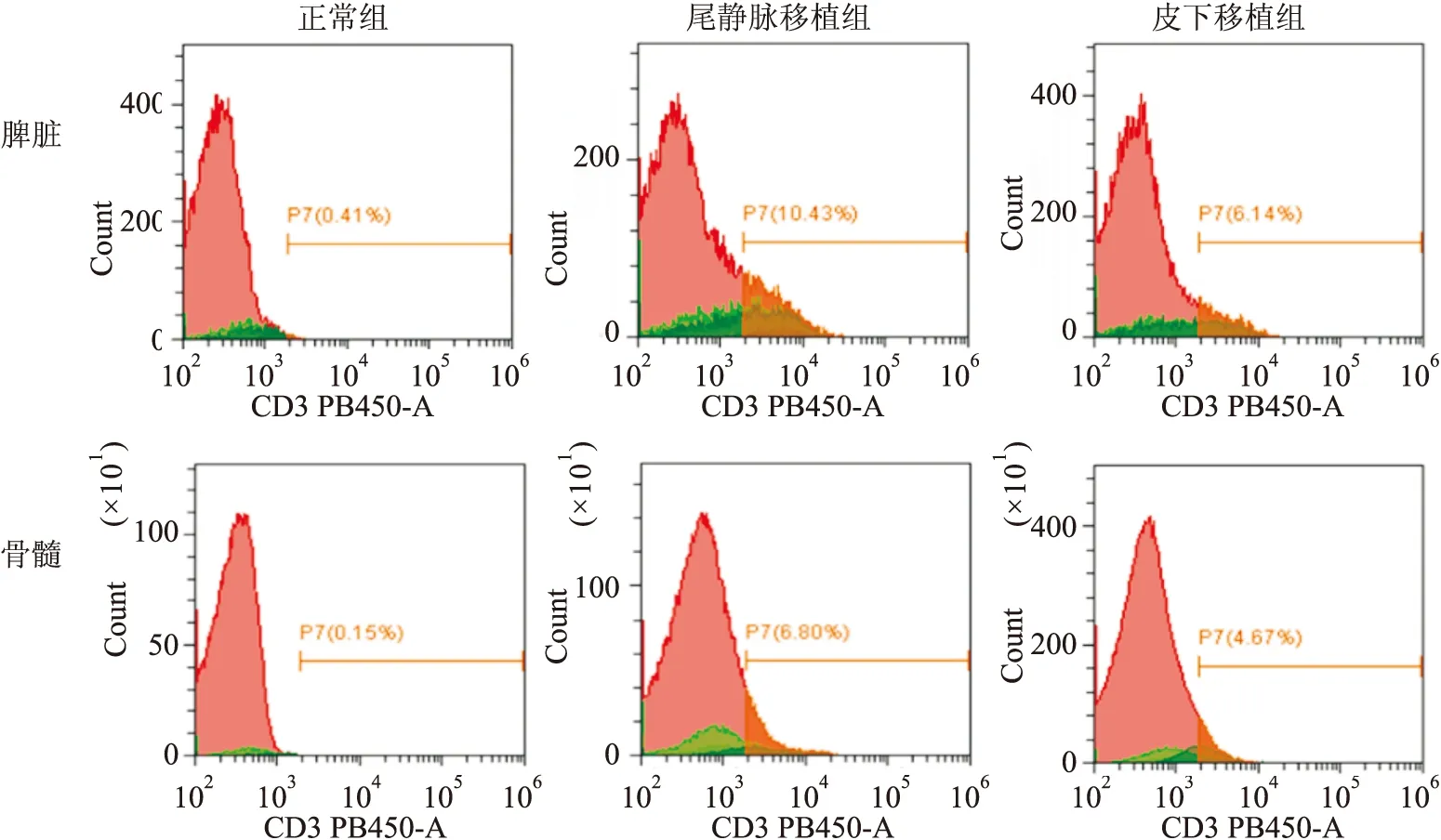
图3 流式细胞术检测脾脏和骨髓中Jurkat细胞百分比
2
.2
.2
体质量检测结果 细胞移植后每周记录各组裸鼠体质量变化,并绘制体质量变化曲线(图4)。与正常组相比,尾静脉移植组和皮下移植组体质量在第7天开始出现缓慢下降,并在第21天出现统计学差异(F
=20.211,P
<0.05)。尾静脉移植组和皮下移植组之间差异无统计学意义。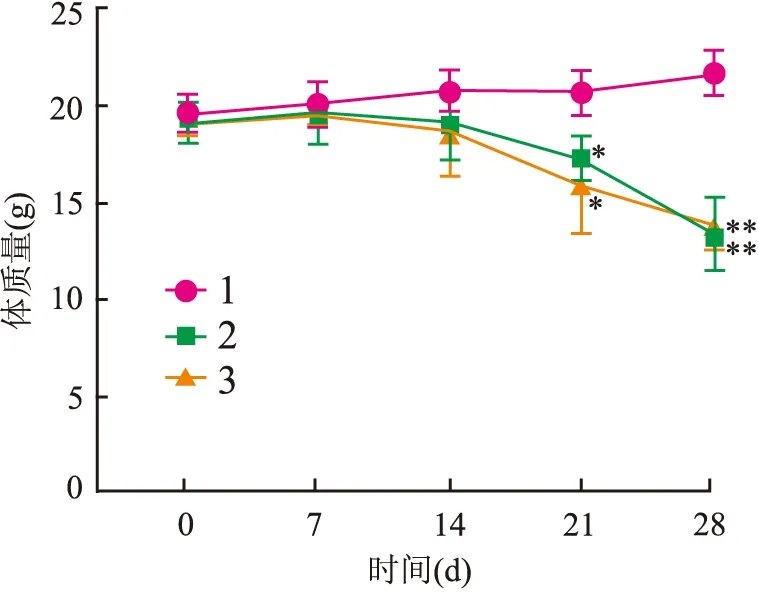
图4 裸鼠体质量变化曲线
2
.2
.3
外周血瑞氏-
吉姆萨染色情况 建模第28天,裸鼠处死后取外周血涂片进行瑞氏-吉姆萨染色,尾静脉移植组和皮下移植组裸鼠外周血中均可见Jurkat细胞,尾静脉移植组比例平均为9.11%,皮下移植组比例最高可达6.37%;尾静脉移植组和皮下移植组镜下Jurkat细胞胞体偏大,呈圆形,胞浆量丰富,染蓝色,胞核较大。正常组外周血中未见Jurkat细胞,以红细胞为主,有核细胞少见。见图5。2
.2
.4
骨髓瑞氏-
吉姆萨染色结果 尾静脉移植组和皮下移植组裸鼠处死后骨髓瑞氏-吉姆萨染色均可见Jurkat细胞,尾静脉移植组比例平均可达12%,皮下移植组比例平均为8%,胞体偏大,呈圆形,胞浆丰富。胞核圆形,只有一个明显的核仁。见图6。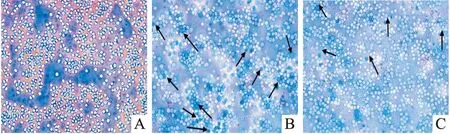
图5 T-ALL裸鼠外周血Jurkat细胞浸润 瑞氏-吉姆萨染色×400A:正常组;B:尾静脉移植组;C:皮下移植组
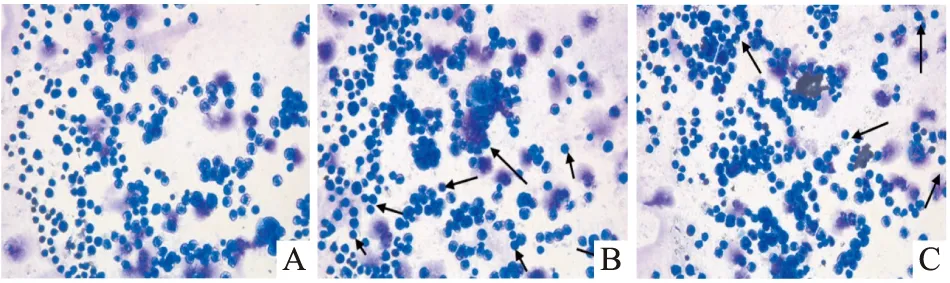
图6 T-ALL裸鼠骨髓Jurkat细胞浸润 瑞氏-吉姆萨染色×400A:正常组;B:尾静脉移植组;C:皮下移植组
2
.2
.5
病理组织学检查 裸鼠脾组织病理切片常规HE染色结果显示:正常组裸鼠脾组织结构完整,红髓和白髓界限明显;而尾静脉移植组和皮下移植组裸鼠脾组织红髓和白髓增生,界限模糊,并且出现Jurkat细胞浸润现象,呈弥漫性生长。肝脏组织HE染色结果显示:正常组裸鼠肝组织结构完整,肝细胞以中央静脉为中心向周围呈放射状排列,无组织病理学变化;移植了Jurkat细胞的裸鼠肝组织切片可见Jurkat肿瘤细胞浸润,尾静脉移植组裸鼠中Jurkat细胞浸润,且病变程度比皮下移植组裸鼠严重;尾静脉移植组和皮下移植组裸鼠肝脏均出现部分肝组织坏死,正常肝组织结构被破坏。见图7。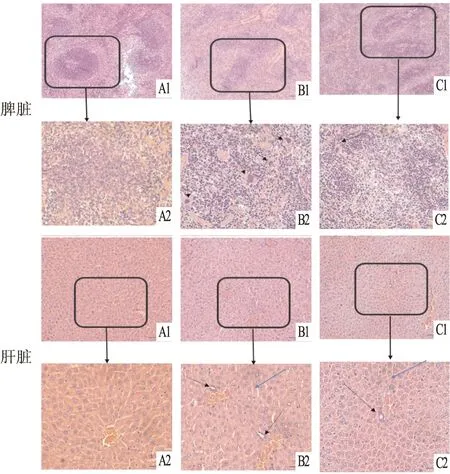
图7 T-ALL裸鼠脾脏和肝脏病理检查结果 HE染色
2
.2
.6
免疫组织化学法检测CD3的表达 CD3分子在Jurkat细胞表面广泛表达,采用免疫组织化学法检测肝脾组织中Jurkat肿瘤细胞侵袭情况。正常组裸鼠肝脾组织经免疫组织化学染色均无棕黄色阳性反应,尾静脉移植组和皮下移植组的肝脾组织则均有阳性反应,并且尾静脉移植组的阳性面积比皮下移植组要高。尾静脉移植组局部可见阳性细胞聚集。见图8。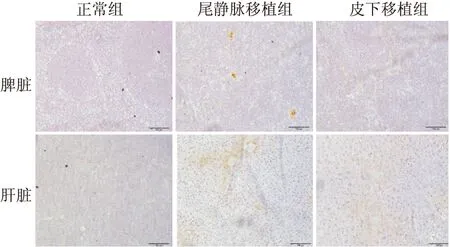
图8 裸鼠肝脾组织中CD3蛋白的表达 免疫组化法染色 ×100
2
.2
.7
ELISA检测血浆IL-2表达 正常对照组裸鼠血清中无IL-2表达,尾静脉移植组和皮下移植组裸鼠外周血血清中有Jurkat细胞分泌的IL-2表达,其中尾静脉移植组裸鼠血清IL-2水平高于皮下移植组,差异有统计学意义(t
=4.085,P
<0.001)(图9)。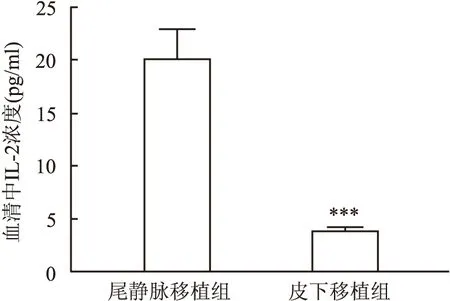
图9 各组裸鼠血清中IL-2水平
3 讨论
选择和建立合理的动物模型是探究T-ALL的病理机制及开发创新药物成功与否的关键。已有的动物实验模型包括异种移植性白血病、自发性白血病、诱发性白血病和转基因动物模型,可一定程度反映T-ALL的病理过程。其中异种移植性动物模型接种人T-ALL细胞更贴近临床T-ALL疾病,是目前较为常用的一种白血病动物模型。
异种移植性动物模型的建立需要考虑多种因素,包括免疫缺陷小鼠、免疫抑制剂和移植途径。免疫缺陷小鼠天生T、B淋巴细胞或NK细胞缺乏,对植入的肿瘤细胞排异反应较小,故成为研究血液学疾病的有力工具。免疫缺陷小鼠包括裸鼠、SCID、NOD/SCID和NSG,其中利用无胸腺免疫缺陷裸鼠是构建T-ALL动物模型中较为常用、经济和易获得的模型动物。裸鼠天生T细胞缺陷、为直接观察和肿瘤的可视化提供了极好的机会,但成年裸鼠(6~8周龄)具有较高的自然杀伤细胞活性,使得体内建立全身白血病模型存在一定难度,需要通过脾脏切除术、全身辐照或使用免疫抑制剂等方法来进一步抑制其免疫功能。脾脏切除术对裸鼠会造成较大的生理性伤害,不符合动物福利要求。全身辐照虽然有较高的造模成功率,但对实验室条件要求较高。免疫抑制剂就相对简单安全,且可操作性更强。免疫抑制剂常用的有环磷酰胺和白消安。移植途径的选择至关重要,常用的细胞移植方式有皮下移植和尾静脉移植,皮下移植即可用于实体瘤造模,也可用于白血病模型;尾静脉移植常用于白血病模型,因此,本文旨在通过比较两种移植方式的优缺点,建立操作简便、经济可靠、重复性好和观察指标明确的T-ALL模型建立方法。
本实验中尾静脉移植组和皮下移植组裸鼠均出现白血病表现,体质量呈现“增长-缓慢下降-明显下降”的变化趋势,第14天体质量出现减轻,并持续下降,伴随出现弓背、皮肤皱褶和精神萎靡等现象。本文利用流式细胞术动态监测裸鼠外周血中Jurkat细胞浸润变化情况:第7天,裸鼠外周血中已有Jurkat细胞浸润,且随病程逐渐升高;第14天,尾静脉移植组比皮下移植组Jurkat细胞浸润更显著;第28天,尾静脉移植组和皮下移植组裸鼠外周血、骨髓、脾脏和肝均有不同程度的Jurkat细胞浸润,肝脾组织已发生病理改变。通过裸鼠活体尾静脉取血并动态监测Jurkat细胞浸润变化是鉴定模型成功及确定给药时间的重要手段。传统的瑞氏-吉姆萨染色工作量大、主观性强、对样本要求高,本文采用流式细胞术检测Jurkat表面标志CD3,操作方便、检测准确,可作为瑞氏-吉姆萨染色的辅助观察指标。
本文比较了两种移植方式。皮下移植虽然操作简便,但是在T-ALL造模过程中不易观察到瘤体,成模率和细胞浸润率也较低;尾静脉注射移植方式具有成模率高、肿瘤细胞浸润快、浸润细胞多、更贴近临床T-ALL的转移特征等优点。因此,后者可作为异种移植T-ALL模型较理想的移植方式。
该文中建立的裸鼠尾静脉异种移植T-ALL模型相对于皮下移植方式是一种操作简便、经济可靠、重复性好和观察指标明确的T-ALL模型建立的方法,可为研究T-ALL的发病机制及其相关新药的研发提供实验基础,也为T淋巴细胞白血病、淋巴瘤等血液系统疾病的基础研究奠定动物实验基础。

