柚皮素预处理通过抑制NLRP3炎症小体通路减轻小鼠机械通气相关性肺损伤
王 萍,唐宋琪,农开旭,邢春蕊
机械通气作为一种治疗急性呼吸衰竭患者生命维持的重要干预手段,已广泛应用于临床,但机械通气所造成的应力损伤可破坏肺组织内细胞膜结构,导致肺部炎症因子大量释放,引发肺损伤。然而,机械通气相关性肺损伤(ventilation-induced lung injury,VILI)是一个潜在威胁患者生命安全的并发症,其早已受到许多医学学者的关注。NOD样受体蛋白3(NOD-like receptor pyrin domain 3,NLRP3)炎症小体是先天免疫系统的重要组成部分,在炎性相关疾病发生过程中起重要作用。研究已证实,NLRP3炎症小体通过介导Caspase-1的激活及促炎细胞因子IL-1β/IL-18的分泌,参与了急性肺损伤的发生发展过程,提示对NLRP3炎症小体干预可能成为治疗VILI的潜在靶点。柚皮素(naringenin,NAR)是一种主要存在于柚子等柑橘类水果中的二氢黄酮类化合物,具有抗氧化、抗炎、抗病毒、心脏保护等多种潜在生物活性。Zhao et al报道,NAR可通过抑制炎症反应、提高抗氧化能力,改善脂多糖诱导的小鼠急性肺损伤,但NAR是否对VILI具有改善作用目前还不明确。该研究拟通过机械大潮气量通气法建立VILI小鼠模型,探讨NAR干预对小鼠VILI的影响及其相关作用机制,以期为NAR的临床应用和VILI的防治提供新的思路和理论依据。
1 材料与方法
1
.1 实验动物
60只雄性C57BL/6小鼠为SPF级,6~7周龄,体质量18~22 g,购自湖南省实验动物中心,动物生产许可证号:SCXK(湘)2019-0015。适应性饲养1周后用于正式实验,维持12 h/12 h明暗交替照明,自由饮水、进食。1
.2 主要试剂与仪器
NAR标准品(纯度≥98%,批号:N107455)购自上海阿拉丁生化科技股份有限公司;TNF-α、IL-1β和IL-18 ELISA试剂盒购自上海酶联生物科技有限公司;NLRP3、半胱氨酸天冬氨酸蛋白水解酶-1(Caspase-1)、凋亡相关斑点样蛋白(apoptosis associated speckle-like protein,ASC)和GAPDH抗体购于武汉三鹰生物技术有限公司;荧光倒置显微镜购自日本Olympus公司;电子天平购自北京赛多利斯仪器系统有限公司;全自动酶标仪购自美国MD公司;i-STAT1型血气分析仪购自美国雅培公司;凝胶成像仪、实时荧光定量PCR仪购于美国BIO-RAD公司。1
.3 方法
1
.3
.1
动物造模、分组与给药 将60只C57BL/6小鼠随机分成4组,每组15只,分别为假手术组(sham组)、机械通气模型组(Model组)、NAR低剂量组(L-NAR组)和NAR高剂量组(H-NAR组)。于造模前7 d开始灌胃给药,L-NAR组小鼠给予15 mg/kgNAR灌胃,H-NAR组给予60 mg/kg NAR灌胃,Sham组和Model组给予等量0.9%氯化钠溶液灌胃,每天1次,连续7 d。随后采用机械大潮气量通气法建立VILI模型:腹腔注射3%的戊巴比妥钠40 mg/kg麻醉小鼠,采取仰卧位固定后,在颈部正中切口使气管暴露,切开气管,将24 G留置针缓缓置入并固定,接小动物呼吸机行机械通气(通气频率80次/min,VT 40 ml/kg,FiO21%,I ∶E=1 ∶2),持续机械通气4 h后处死小鼠,收集样本检测。1
.3
.2
动脉血液氧合指数(oxygenation index,OI)测定 各组小鼠机械通气插管即刻及机械通气4 h结束后采集颈内动脉血样,立即进行血气分析,记录动脉血氧分压(PaO),根据吸入气中的氧浓度分数(FiO)计算OI,OI=PaO/FiO。1
.3
.3
ELISA检测支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)中TNF-α、IL-1β和IL-18的含量 机械通气结束后,结扎各组小鼠右肺主支气管,用预冷的PBS灌洗支气管肺泡,反复灌洗3次并收集BALF,按照试剂盒说明书进行操作,采用ELISA法检测BALF中TNF-α、IL-1β和IL-18含量。1
.3
.4
肺组织湿重/干重比值(wet weight/dry weight,W/D)测定 取各组小鼠右肺称取湿重,置于70 ℃干燥箱中烘干至恒重,称取干重,计算W/D值。1
.3
.5
苏木精-伊红(hematoxylin-eosin,HE)染色观察肺组织病理变化并评分 收集各组小鼠左肺组织,经0.9%氯化钠溶液洗净后于4%多聚甲醛溶液固定48 h,常规石蜡包埋,石蜡切片(3~4 μm),行HE染色,光学显微镜下观察肺组织病理改变,并参照林新 等的方法对肺损伤程度进行评分:从肺泡水肿、肺间质水肿、中性粒细胞浸润、肺泡充血四个方面评定,损伤程度由轻到重依次标记为0、1、2、3、4分,累计总分为最终损伤评分。1
.3
.6
RT-PCR检测小鼠肺组织中Caspase
-1 等mRNA水平 取各组小鼠的适量左肺组织,按照TRIzol法提取各样本的总RNA,测定总RNA浓度和纯度。根据逆转录试剂盒将总RNA逆转录成cDNA,以cDNA为模板进行RT-PCR扩增反应。PCR反应条件为95 ℃预变性60 s,95 ℃变性15 s,60 ℃退火15 s,72 ℃延伸45 s,共40个循环。以GAPDH
为内参,采用2法计算NLRP
3、ASC
和Caspase
-1 mRNA相对表达量。引物序列见表1。
表1 引物序列
1
.3
.7
Western blot检测肺组织中NLRP3、ASC和Caspase-1的蛋白表达水平 取各组小鼠的适量左肺组织称量,BCA法测定蛋白浓度,取等量蛋白样品经10% SDS-PAGE凝胶电泳,随后转移至PVDF膜,室温下用5%脱脂牛奶封闭2 h,洗膜加入一抗(NLRP3、ASC、Caspase-1、GAPDH,1 ∶1 000),4 ℃过夜,次日洗膜后加入HRP标记的二抗(1 ∶1 000),室温孵育1 h, 洗膜后滴加ECL显色液,并置于凝胶成像仪中显影、拍照。利用Image J图像分析软件进行分析,以目的条带与GAPDH的灰度值比值,作为目的蛋白表达的相对水平。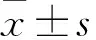
2 结果
2.1 NAR对VILI小鼠BALF中相关炎症因子含量的影响
与sham组比较,Model组小鼠BALF中TNF-α、IL-1β和IL-18含量增加,差异有统计学意义(t
=14.439、21.233、16.054,P
<0.01);与Model组比较,H-NAR组小鼠BALF中TNF-α、IL-1β和IL-18含量减少,差异有统计学意义(t
=12.394、10.771、13.495,P
<0.01),而L-NAR组差异无统计学意义。见图1。
图1 各组小鼠BALF中TNF-α、IL-1β和IL-18含量比较 与sham组比较:**P<0.01;与Model组比较:##P<0.01
2.2 NAR对VILI小鼠肺组织W/D以及血液OI的影响
与sham组比较,Model组小鼠肺组织W/D值增加,OI值较插管即刻降低,差异有统计学意义(t
=43.405、32.309,P
<0.01);与Model组比较,H-NAR组大鼠肺组织W/D值降低,OI值较插管即刻增加,差异有统计学意义(t
=28.334、25.459,P
<0.01),而L-NAR组差异无统计学意义。见表2。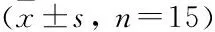
表2 各组小鼠肺组织W/D和血液OI比较
2.3 NAR对VILI小鼠肺组织病理学的影响
sham组小鼠肺组织结构完整,未见明显异常;Model组和L-NAR组小鼠肺组织结构严重破坏,肺泡及间质内可见明显的渗出性水肿,肺间质伴有大量炎症细胞浸润,部分肺泡腔伴有出血;H-NAR组小鼠肺组织结构相对完整,肺泡和间质肿胀程度明显减轻,较少炎症细胞出现,肺泡出血不明显。见图2。与sham组比较,Model组肺损伤评分增加,差异有统计学意义(t
=20.328,P
<0.01);与Model组比较,H-NAR组评分降低,差异有统计学意义(t
=14.954,P
<0.01),而L-NAR组差异无统计学意义。
图2 各组小鼠肺组织病理学观察 HE染色 ×200
2.4 NAR对VILI小鼠肺组织中NLRP3炎症小体通路的影响
与sham组比较,Model组小鼠肺组织中NLRP
3、ASC
、Caspase
-1的mRNA(t
=22.394、34.105、59.580,P
<0.01)和蛋白(t
=45.495、29.337、23.556,P
<0.01)表达水平增加,差异有统计学意义;与Model组比较,H-NAR组NLRP
3、ASC
、Caspase
-1的mRNA(t
=18.758、20.377、22.241,P
<0.01)和蛋白(t
=33.400、13.438、17.549,P
<0.01)表达水平降低,差异有统计学意义,而L-NAR组差异无统计学意义。见图3。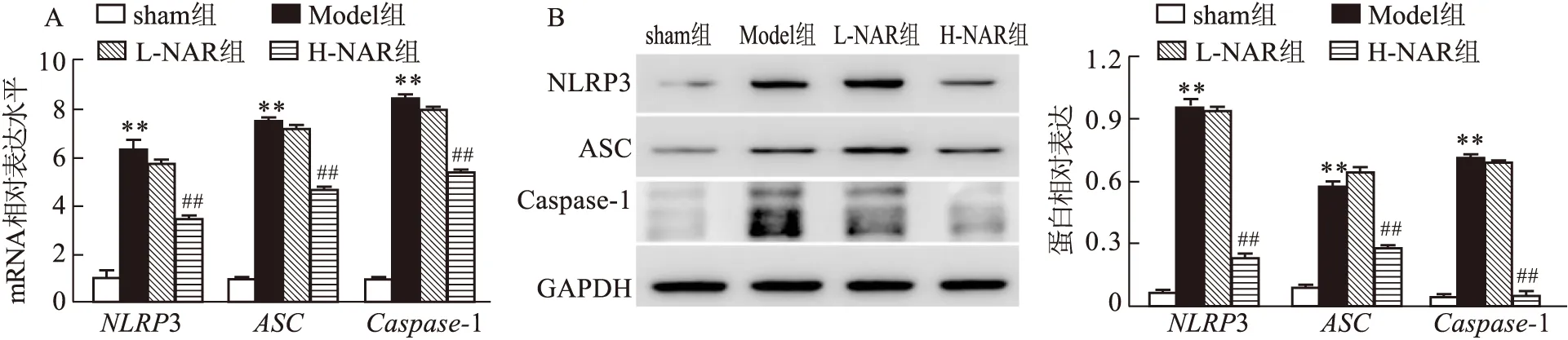
图3 各组小鼠肺组织中Caspase-1、ASC和NLRP3 mRNA和蛋白表达水平比较
3 讨论
机械通气是维持急性呼吸衰竭患者生存的重要干预手段,但也是导致相关肺损伤的重要原因。许多学者认为,VILI的发生机制主要是由于机械地过度刺激,导致肺细胞内炎症与相关信号转导通路被激活,引起肺组织水肿、肺泡断裂,炎性细胞、炎症介质及细菌通过受损屏障释放入血,导致全身炎症反应,形成肺损伤。目前,临床上治疗VILI的药物主要有抗感染细胞因子药物、抗氧化剂、环氧化酶抑制剂及肌肉松弛药等,关于使用中药预防VILI的相关研究还鲜有报道。有研究已证实,NAR对急性肺损伤具有保护作用,由此推测NAR可能对VILI具有一定的改善作用。本研究通过构建VILI小鼠模型,探讨NAR对VILI的影响及其可能机制。研究结果显示,NAR能有效改善VILI的肺损伤程度,减轻肺组织炎症反应,其作用机制可能是通过抑制NLRP3炎症小体通路的激活来实现的。
VILI的病理改变主要为肺泡间隔增厚、肺水肿、炎症细胞浸润等。本研究采用大潮气量(V=40 ml/kg)机械通气制备VILI小鼠模型,HE染色结果显示模型组小鼠肺组织发生明显病理学改变:肺组织结构紊乱,肺泡间隔增厚,肺间质水肿,肺血管旁、肺泡间隔和肺泡内都有大量炎性细胞浸润。同时肺组织W/D升高,而血液OI降低,与前人研究结果一致。HE染色结果提示小鼠VILI模型制备成功。采用高剂量NAR预处理后再进行VILI操作,可观察到小鼠肺组织病理损伤减轻,肺组织W/D比值下调,血液OI上升,这些研究结果提示NAR预处理可减轻小鼠VILI。
目前认为,失控性炎症反应是导致VILI的启动因素,而阻断炎症反应被认为是治疗VILI的潜在靶点。NLRP3炎症小体是由NLRP3蛋白、ASC和Caspase-1组成的大分子多蛋白复合体,通过诱导下游促炎性因子IL-1β和IL-18的成熟和释放,加剧炎症反应,参与VILI的发生发展。Wan et al通过基因敲除的方法证实,敲除VILI小鼠的香叶基香叶基二磷酸合酶1(GGPPS1),可显著降低小鼠BALF中IL-1β和IL-18表达水平,减轻肺组织病理损伤。为进一步探究NAR改善VILI的可能机制,本研究对各组小鼠BALF中炎性因子含量以及肺组织中NLRP3炎症小体通路相关蛋白表达水平进行了检测,研究结果显示,高剂量NAR可降低VILI小鼠BALF中TNF-α、IL-1β和IL-18含量,同时抑制NLRP
3、ASC
和Caspase
-1的mRNA及蛋白表达,该研究结果提示NAR可能通过抑制NLRP3炎症小体活化,减少TNF-α、IL-1β和IL-18的分泌,降低肺部炎症反应,从而发挥改善VILI的作用。综上所述,NAR预处理可减轻VILI,其作用机制可能与抑制肺组织炎症反应和NLRP3炎症小体活化有关。该研究结果可为VILI临床治疗药物的研发提供实验依据。

