AKT/mTOR信号通路介导神经病理性疼痛对大鼠心肌缺血再灌注损伤的保护作用
李玉为,张巧云,曹亚红,王家友,李 锐
心肌缺血是缺血性心脏病患者发病和死亡的主要原因之一,往往需要溶栓或经皮冠状动脉介入治疗,冠状动脉缺血一段时间后再灌注会进一步加重心肌损伤。缺血预处理可以有效减轻心肌缺血再灌注损伤,研究表明伤害性刺激也可以产生类似的保护效应。神经病理性疼痛是躯体感觉神经系统损伤或疾病引起的疼痛,但其对心肌缺血再灌注损伤是否有保护作用尚有争议。心肌缺血再灌注损伤后自噬增强,与蛋白激酶B(protein kinase B,AKT)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路有关。自噬细胞通过自身细胞器与溶酶体融合后降解,供新功能物质合成,对细胞存活有利,但过度自噬会加重心肌缺血再灌注损伤。该研究拟观察神经病理性疼痛对大鼠心肌缺血再灌注的影响,并从细胞自噬的角度初步探讨其机制。
1 材料与方法
1.1 实验动物与分组
42只雄性成年SD大鼠,体质量250~320 g(10周龄),由安徽医科大学实验动物中心提供。采用随机数字表法分为为三组(n
=14):对照组(Con组)、心肌缺血再灌注损伤组(I/R组)和神经病理性痛+心肌缺血再灌注损伤组(NP+I/R组)。动物饲养环境温度控制为(22±1)℃,湿度控制为(40±15)%,昼夜节律按12 h/12 h进行周期性调节饲养。1.2 主要试剂和仪器
2,2-联喹啉-4,4-二甲酸二钠(BCA) 蛋白定量试剂盒购自上海碧云天科技研究所;HE染色试剂盒购自南京建成生物研究所;AKT、p-AKT、p-mTOR、mTOR均购自美国Cell Signaling Technology公司;微管相关蛋白1轻链3(microtube-associated protein 1 light chain 3,LC3)、β-actin均购自美国Abcam公司;山羊抗兔和山羊抗鼠二抗均购自北京中杉金桥生物科技有限公司;ECL发光试剂盒购自美国Thermo Fisher公司;氯化三苯基四氮唑 ( 2,3,5-triphenyltetrazoliumchloride,TTC) 购自美国Sigma公司;von Frey触痛仪购自美国IITC公司;BME 410A热痛刺激仪购自中国医学科学院生物工程研究所;HX-300S型动物呼吸机购自成都泰盟科技有限公司;PowerLab系统购自澳大利亚AD公司;Tanon全自动凝胶成像系统购自上海天能科技有公司。1.3 模型制备
1
.3
.1
神经病理性疼痛模型建立 根据文献采用坐骨神经慢性缩窄损伤(chronic constriction injury, CCI)法制备大鼠神经病理性疼痛模型。腹膜注射戊巴比妥钠45 mg/kg,大鼠麻醉后,在左下肢股骨下方约1 cm处切开皮肤,于股二头肌间隙钝性肌肉分离,暴露坐骨神经。用4-0铬肠线结扎坐骨神经干,间隔约1 mm,结扎4道,结扎坐骨神经干时以见左下肢轻微震颤为度。NP+I/R组大鼠接受CCI术,Con组与I/R组仅暴露坐骨神经,不结扎。1
.3
.2
心肌缺血再灌注损伤模型建立 在CCI术后第14天,根据参考文献建立I/R损伤模型。加热垫将其温度保持在(37±1)℃,大鼠腹腔注射45 mg/kg的戊巴比妥钠麻醉后气管切开,连接动物呼吸机,设置呼吸频率70~80次/min,潮气量为20~30 ml/kg进行机械通气。右颈总动脉切开置管,通过压力换能器,连接PowerLab系统,记录有创平均动脉压(mean arterial pressure,MAP)和心电图。沿左锁骨中线切开皮肤2 cm,在第4、5肋间开胸,打开心包膜暴露心脏。将带有6-0 Prolene线的圆针在左耳下方2 mm处进针,深度为1.0~1.5 mm,宽度为2~3 mm,从肺动脉圆锥下出针。稳定15 min后,通过拉紧线结形成左冠状动脉前降支闭塞,形成心肌缺血。I/R组和NP+I/R组大鼠心肌缺血30 min,再灌注120 min;而Con组仅进行开胸、穿线。1.4 实验方法
1
.4
.1
疼痛行为学评估 在术前、术后第3、7、14天时测定大鼠机械缩足反应阈(mechanical withdrawal threshold,MWT)和热缩足反应潜伏期(thermal withdrawal latency,TWL)评价疼痛行为。将大鼠置于带金属网底的有机玻璃笼内,待其适应环境30 min后,手平持von Frey触痛仪的刺激针缓慢接触大鼠左侧足底,记录大鼠突然出现缩足反应时的数值。重复测量3次,间隔时间大于10 s,取其平均值作为MWT,评价机械痛阈。将大鼠置于底部为特制玻璃(2 mm厚度)的笼内,适应环境30 min后,采用BME 410A热痛刺激仪热辐射光源照射左侧足底,记录从照射开始至大鼠出现快速抬足反应的时间。重复测定3次,每次间隔10 min,取其平均值作为TWL,评价热痛阈。1.4.2
心律失常评分 连续记录心电图,于再灌注30 min内记录室性早搏(premature ventricular contraction, PVCs)及室性心动过速/心室颤动(ventricular tachycardia/ventricular fibrillation, VT/VF)发生次数。心律失常评分标准:记录时间内PVCs<50次为0分;记录时间内发生PVCs 50~499 次记1分;记录时间内发生PVCs≥500次和(或)短暂的自发性VT/VF记2分;记录时间内发生短暂的自发性VT/VF,总持续时间不到1 min记3分,1~2 min记4分,>2 min记5分。1
.4
.3
心肌梗死面积测定 在心肌缺血再灌注结束后,采用颈椎脱臼法处死大鼠,取出心脏用0.1 mmol/L磷酸盐缓冲液(PBS)灌注冲去血液,然后扎紧左冠状动脉处的线结,从主动脉逆行灌注0.25%伊文思蓝(evans blue)染料0.5 ml,置于-80 ℃冰箱冷冻。将冷冻心脏切成5~6片,厚2 mm,置于1%TTC,37 ℃下温孵10 min后用10%甲醛固定。使用Imaging J软件(Version 1.45,美国)分析左室(left ventricle, LV)、右心室(right ventricle, RV)、心脏缺血危险区(area at risk, AAR)和梗死区(infarct size, IS)面积和IS/AAR值。1
.4
.4
HE染色 取结扎部位以下心脏组织置于4%多聚甲醛中固定,梯度乙醇脱水,二甲苯透明,石蜡包埋、切片。切片经脱蜡后水洗,苏木精染色、95%乙醇分色、水洗、反蓝,然后0.5%伊红液中染色、梯度乙醇脱水、二甲苯透明、中性树胶封片。1
.4
.5
Western blot实验 取心脏标本加入RIPA细胞裂解液100 μl,冰上研磨至液态,12 000 r/min离心30 min,留取上清液提取总蛋白,使用BCA试剂盒按照说明书实验步骤测量总蛋白浓度。十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶上样30 μg蛋白,电泳、转膜、5%脱脂牛奶封闭,洗膜后分别加入p-AKT一抗(1 ∶1 000)、AKT一抗(1 ∶1 000)、p-mTOR一抗(1 ∶1 000)、mTOR一抗(1 ∶1 000)、LC3一抗(1 ∶1 000)和β-actin一抗(1 ∶2 000),4 ℃摇床孵育过夜。次日洗膜,二抗用山羊抗鼠IgG(1 ∶10 000)或山羊抗兔IgG(1 ∶10 000)室温孵育1 h。洗膜后暗室使用ECL发光试剂盒显影,在Tanon全自动凝胶成像系统中自动曝光采集图像。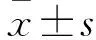
2 结果
实验流程如图1。在NP+I/R组中,2只大鼠未成功建立神经病理性疼痛模型,1只大鼠心肌缺血期间出现严重心律失常;I/R组中有3只大鼠在缺血再灌注期间死亡。此6只大鼠均予以剔除。
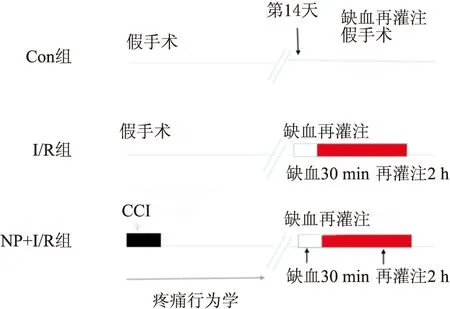
图1 实验示意图
2.1 大鼠的MWT和TWL数值变化
Con组、I/R组、NP+I/R组三组术前MWT和TWL基础值差异无统计学意义。与Con组和I/R组相比,NP+I/R组大鼠在CCI术后第3、7、14天的MWT和TWL降低,差异有统计学意义(P
<0.05)。Con组与I/R组各时点的MWT和TWL之间差异无统计学意义。见图2、表1。
表1 MWT和TWL数值
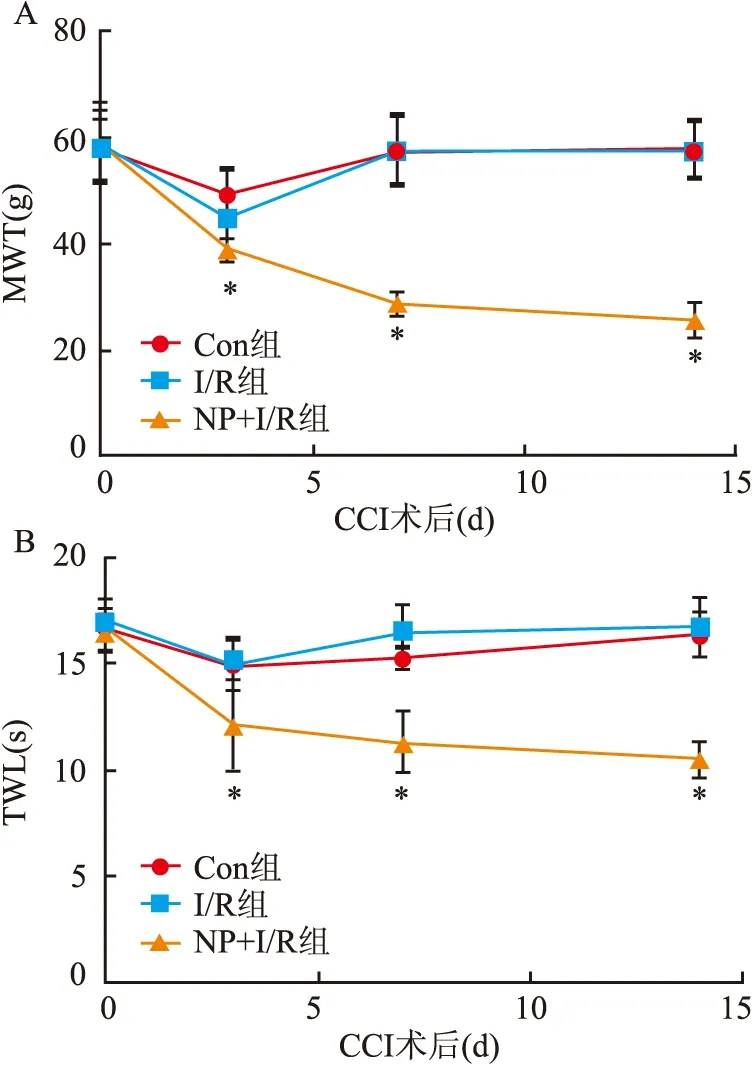
图2 大鼠的MWT和TWL数值A:MWT;B:TWL;与I/R组比较:*P<0.05
2.2 MAP及心率
三组MAP和心率(heart rate,HR)基础值之间差异无统计学意义。与Con组相比,I/R组和NP+I/R组MAP、HR在缺血30 min时刻和再灌注120 min时刻降低,差异有统计学意义(P
<0.05)。但I/R组与NP+I/R组之间MAP和HR差异无统计学意义。见表2。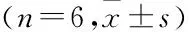
表2 各组大鼠各时间点血压及心率情况
2.3 心律失常评分
与Con组相比,I/R组和NP+ I/R组的心律失常评分增加,差异有统计学意义(P
<0.05),见图3。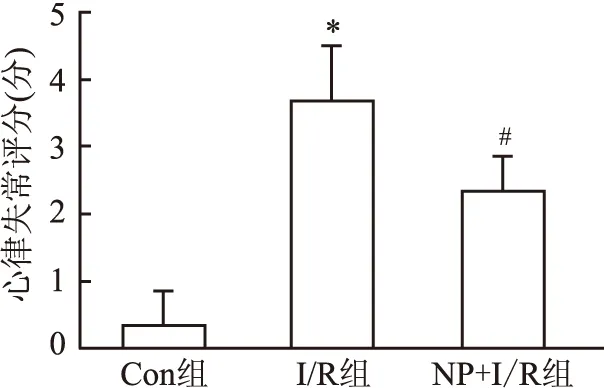
图3 心律失常评分
2.4 心肌梗死面积
三组之间AAR/(LV+RV)差异无统计学意义。与Con组相比,I/R组IS/AAR增加,差异有统计学意义(P
<0.05);与I/R组相比,NP+I/R组IS/AAR降低,差异有统计学意义(P
<0.05)。见图4及表3。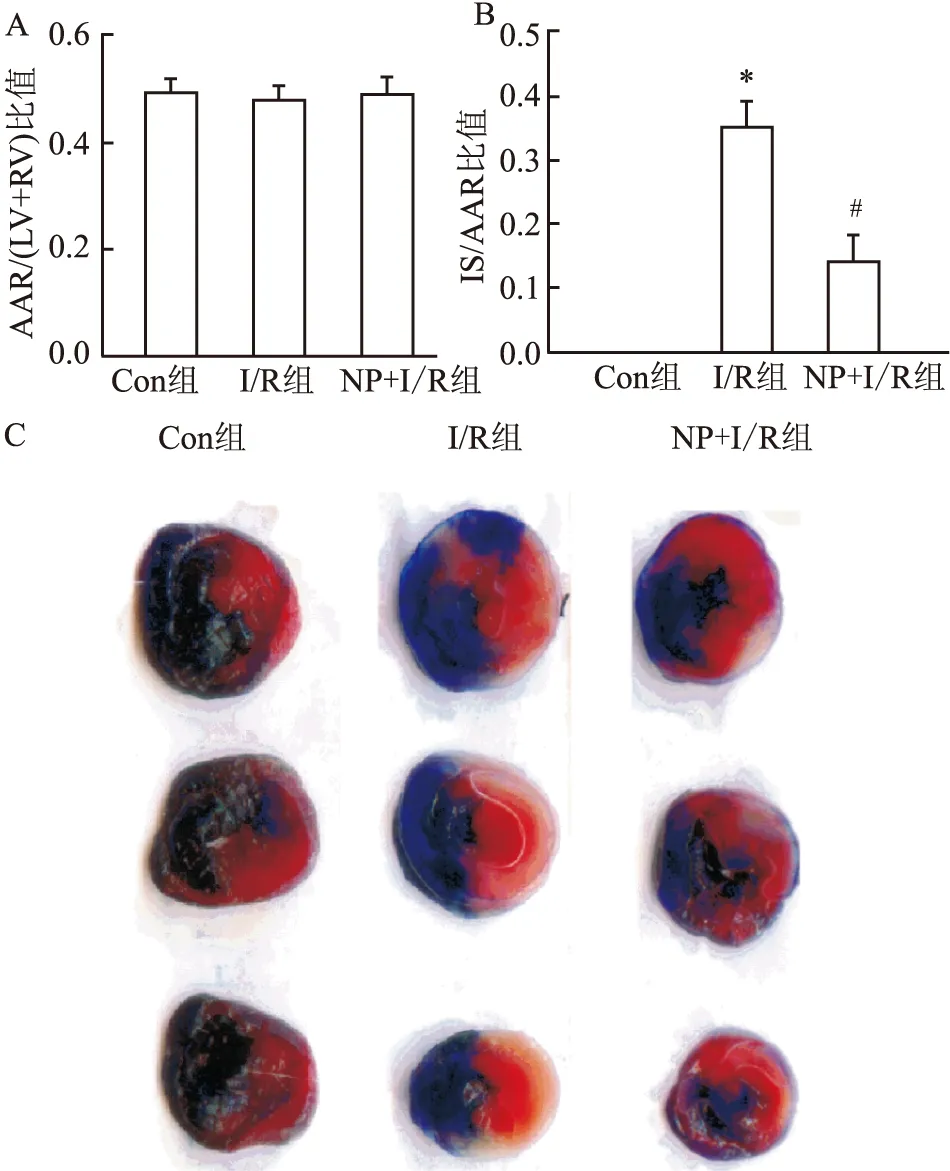
图4 三组大鼠心脏TTC染色结果
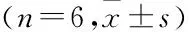
表3 各组大鼠心肌梗死面积比较
2.5 HE染色
Con组心尖部心肌纤维排列整齐;I/R组心尖部心肌纤维排列紊乱,可见坏死灶,水肿明显;NP+I/R组心尖部心肌纤维排列紊乱,坏死灶和水肿较I/R组轻。见图5。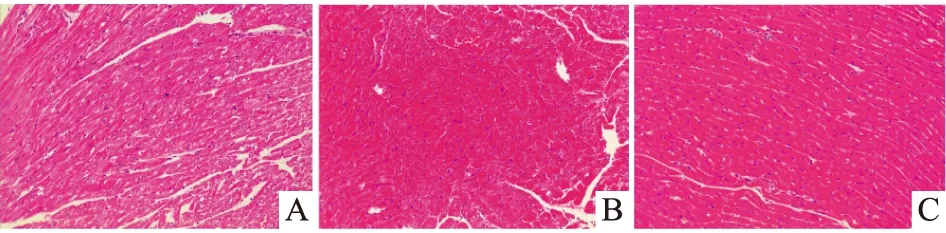
图5 三组心肌组织学比较 HE ×200A:Con组;B:I/R组;C:NP+I/R组
2.6 AKT、mTOR及LC3蛋白分子表达情况
与Con组相比,I/R组心尖部心肌组织的p-AKT/AKT和p-mTOR/mTOR表达下调,LC3-Ⅱ/Ⅰ表达上调,差异有统计学意义(P
<0.05)。与I/R组相比,NP+I/R组心尖部心肌组织的p-AKT/AKT和p-mTOR/mTOR比值上调,LC3-Ⅱ/Ⅰ比值下调,差异有统计学意义(P
<0.05)。见图6。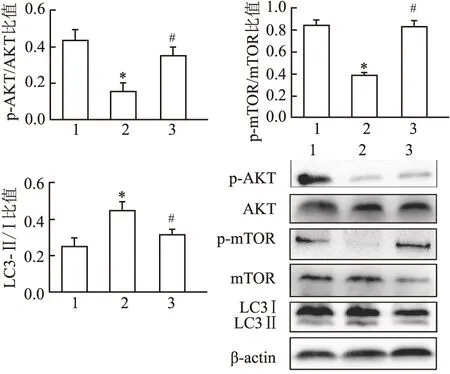
图6 Western blot检测AKT、mTOR及LC3等蛋白表达情况
3 讨论
坐骨神经CCI法是制备神经病理性疼痛模型的经典手术方式。CCI术后大鼠术侧的下肢会出现蜷缩、无法负重等表现。MWT和TWL值显著降低为神经病理性疼痛模型建立成功的标志。 在CCI术后第14天制备缺血再灌注模型,心脏结扎部位以下的组织明显发绀,HR、血压下降,心电图显示ST段抬高和QRS波宽大畸变,以上情况提示成功建立了心肌缺血再灌注损伤模型。
神经病理性疼痛产生可能与其外周和中枢敏化相关,另外胶质细胞的激活扩散也参与神经病理性疼痛的形成。一般情况下,末梢神经元受到诸如疼痛之类的有害刺激时,电信号将传导至一级神经元,即脊髓背根神经节(DRG),随后传递至脊髓、丘脑,产生痛觉。该研究显示病理性疼痛减轻大鼠心肌缺血再灌注损伤后心肌梗死面积,这与Cheng et al研究结果一致,其在小鼠脊神经损伤5 d后行心肌缺血再灌注损伤耐受实验,同样观察到神经损伤组心肌梗死面积减少,且认为其心肌保护作用与丘脑室旁前核的调节有关。
细胞自噬属于一种保守的分解代谢机制,在基础或应激情况下,细胞双层膜将胞内错误折叠的蛋白质、受损的细胞器吞噬,成为自噬小体,随后与溶酶体融合而被降解。故细胞自噬在循环利用营养物质、平衡细胞能量及促进细胞存活等方面起着重要作用,但细胞过度自噬也会加重心肌细胞损伤。在自噬发生过程中,胞质内的Ⅰ型 LC3 经过泛素样加工修饰后再与自噬膜上的磷脂酰乙醇胺结合并形成Ⅱ型 LC3,因此,检测LC3-Ⅱ/Ⅰ可以反应自噬发生的程度。自噬不但参与疼痛的调控,对缺血再灌注损伤也产生调控作用。Izumi et al在足底切口痛模型大鼠的DRG神经元上观察到p-mTOR表达增多,Liu et al在神经病理性疼痛模型的L4-L5脊髓上也观察到p-AKT、p-mTOR表达增多。另外,赵其宏 等发现吗啡后处理可致体外实验观察到缺血再灌注损伤心肌梗死面积减少,并且该心肌保护机制与抑制心肌过度自噬相关。该研究表明心肌缺血再灌注损伤引起心肌AKT和mTOR表达减少,LC3蛋白表达增加;而神经病理性疼痛大鼠心肌缺血再灌注损伤后AKT和mTOR表达增加,自噬相关蛋白LC3表达减少,即神经病理性疼痛的心肌保护作用可能与过度自噬的减轻有关。此外,该研究显示神经病理性疼痛大鼠心律失常评分降低,心肌组织形态学上心肌排列紊乱及坏死、水肿程度减轻。因此,神经病理性疼痛减轻大鼠心肌缺血再灌注损伤可能与神经病理性疼痛调控AKT/mTOR信号通路抑制细胞过度自噬有关。

