小檗碱调节AKT/NF-κB信号通路对高糖诱导的足细胞损伤、凋亡和迁移的影响
汪佳佳,胡亚琴,吴 昊,唐丽琴,2,魏 伟
糖尿病肾病(diabetic nephropathy, DN)是糖尿病的微血管并发症之一。DN的发生与炎症因子释放、脂糖代谢紊乱、氧化应激等因素相关。足细胞是肾小球的主要组成部分,可维持肾小球的滤过功能。足细胞损伤、凋亡和异常迁移是DN发展早期的一个重要标志,深入研究其损伤机制是研究DN发生发展的重要环节。核因子κB(nuclear factor κB,NF-κB)的激活与细胞凋亡、炎症免疫等密切相关,蛋白激酶B(protein kinase B,AKT)受环境刺激磷酸化时,可促进NF-κB p65的磷酸化入核、核因子抑制蛋白α(inhibitor of NF-κB α,IκBα)激酶活化、炎症反应的发生、细胞促凋亡蛋白(Bcl-2 interacting mediator of cell death,Bim)异常上升。AKT/NF-κB信号通路的激活可导致足细胞损伤,加重肾脏病变。小檗碱(berberine,BBR)又名黄连素,其药理作用广泛,包括降血糖、降血脂和抗炎等,对糖尿病具有一定的治疗作用。研究表明BBR能够缓解DN的足细胞损伤。该文研究了BBR对足细胞的保护作用及其与AKT/NF-κB信号通路的关系,为临床上对DN的防治提供新的思路。
1 材料与方法
1.1 材料
1
.1
.1
细胞株 小鼠肾小球足细胞株(货号:BNCC 337685)购自北京北纳创联生物技术研究院,由中国医学科学院基础医学研究所建系。1
.1
.2
药物 BBR(货号:BW 50137)购自北京北纳创联生物技术研究所,经高效液相色谱法检测其纯度为98.37%。精密称取BBR粉末55.08 g ,加入1.820 ml 0.9%氯化钠溶液混匀,加热、涡旋至完全溶解,配制成浓度为9×10μmol/L的BBR 储备液,0.22 μm无菌过滤器过滤后于冰箱-20 ℃保存。使用前加热溶解,稀释到所需浓度即可用于实验。1
.1
.3
试剂 Annexin FITC/PI apoptosis kit细胞凋亡试剂盒(货号:AP101-100-kit)购自杭州联科生物技术股份有限公司;StarSignal化学发光检测试剂盒(货号:E171-01)购自上海康朗生物科技有限公司;RPMI 1640液体培养基(货号:SH30809.1)购自上海江林生物科技有限公司;抗AKT抗体(货号:4691S)、抗p-AKT抗体(货号:4060S)、抗p-p65抗体(货号:3033S)、抗p65抗体(货号:8242S)、抗p-IκBα抗体(货号:2859S)、抗IκBα抗体(货号:9242S)、抗Bim抗体(货号:2933)购自美国Cell Signaling Technology公司;抗足细胞抑癌基因(Wilm′s tumor gene-1,WT-1)抗体(货号:sc-192)、抗肾小球足细胞裂隙膜蛋白(podocyte slid membrane protein,Podocin)抗体(货号:sc-21009)购自美国Santa Cruz Biotechnology公司。1
.1
.4
仪器 OLYMPUS CKX31型倒置显微镜为日本奥林巴斯有限公司产品;Image Xpress Micro4型高内涵细胞成像系统为美国Molecular Devecies公司产品;FC500型贝克曼流式细胞仪为美国贝克曼库尔特公司产品;Image Quant Las 4000 mini型化学发光成像分析仪为美国GEHealthcare Life Sciences公司产品。1.2 方法
1
.2
.1
细胞培养 取出-80 ℃冰箱或液氮中冷冻保存的细胞,于37 ℃水浴锅中解冻融化后离心,用配制好的细胞培养基(RPMI 1640基础培养基+ 10%血清+ 1%双抗+ 0.2%γ-干扰素)重悬后转移至细胞培养瓶,于5% CO、37 ℃细胞培养箱中培养。1
.2
.2
Annexin FITC/PI双染法检测细胞凋亡 取6孔板,每孔加入1×10个/ml足细胞的单细胞悬液2 ml,贴壁后将其设为五组,分别为正常组(葡萄糖浓度为11.1 mmol/L)、高糖组(葡萄糖浓度为30 mmol/L)和不同浓度BBR给药组(BBR 30、60、90 μmol/L组),按组分别加糖或给药后培养24 h,不含EDTA的胰酶消化离心,收集细胞后,采用Annexin V-FITC/PI凋亡检测试剂盒进行实验,于流式细胞仪上检测各组细胞凋亡率。1
.2
.3
高内涵细胞成像系统检测细胞增殖 取96孔板,将足细胞制备成单细胞悬液,计数后每孔种 3×10个/ml的细胞悬液100 μl,待细胞贴壁后分组加糖或给药,24 h后弃去上清液,预冷PBS洗去死细胞,经过4%多聚甲醛固定、DAPI染核等步骤后上机,高内涵细胞成像系统计算各组足细胞数量。1
.2
.4
细胞迁移(Transwell)实验 取出24孔板中的小室,下室分别加入500 μl的含15% FBS的RPMI 1640培养基,分组和加药同1.2.2,再将Transwell小室放入对应的孔中,上室每孔接种含5% FBS的RPMI 1640培养基、1×10个/ml的单个足细胞悬液200 μl,37 ℃培养箱培养24 h后取出小室,放入含0.1%结晶紫的0.9%氯化钠溶液中染色,0.9%氯化钠溶液清洗2次,仔细擦去黏附于小室内壁的细胞,使用倒置显微镜观察结果并拍摄留存。随机选取5个视野,分别计算细胞数。1
.2
.5
细胞迁移(划痕)实验 在6孔板背面水平划出6条平行的直线(每孔均匀地穿过两条直线),将细胞接种于6孔板中,待细胞长至孔板的80%以上时在孔中均匀地划出与背面直线垂直的两条直线,PBS洗去死细胞后,分别刺激和给药同1.2.2,于0、24 h在显微镜下观察、拍照并计算划痕的面积。1
.2
.6
Western blot检测相关蛋白表达水平 将足细胞消化制备成单细胞悬液,计数,以每孔约1×10个细胞种于6孔板,分组及加药同1.2.2,培养24 h后,用PBS洗去死细胞及杂质,将150 μl含1% PMSF和1%磷酸酶抑制剂的RIPA细胞裂解液加入孔板中,4 ℃裂解30 min,收集于1.5 ml EP管并离心,所提取的蛋白在上清液中,加入蛋白上样缓冲溶液煮沸后得到蛋白样本,进行聚丙烯酰胺凝胶电泳,分别孵育AKT、p-AKT、p65、p-p65、IκBα、p-IκBα、Bim、WT-1、Podocin、足细胞结蛋白(podocyte desmin,desmin)对应抗体,最后用化学发光成像分析仪进行检测。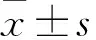
2 结果
2.1 BBR对足细胞凋亡的影响
与正常组相比,高糖组足细胞凋亡率上升,差异有统计学意义(F
=57.850,P
<0.01);与高糖组相比,BBR 30、60、90 μmol/L给药组能使足细胞的凋亡率下降,差异有统计学意义(F
=75.594,P
<0.05),且随着BBR浓度的增大,其降低凋亡率的能力也逐渐上升。见图1。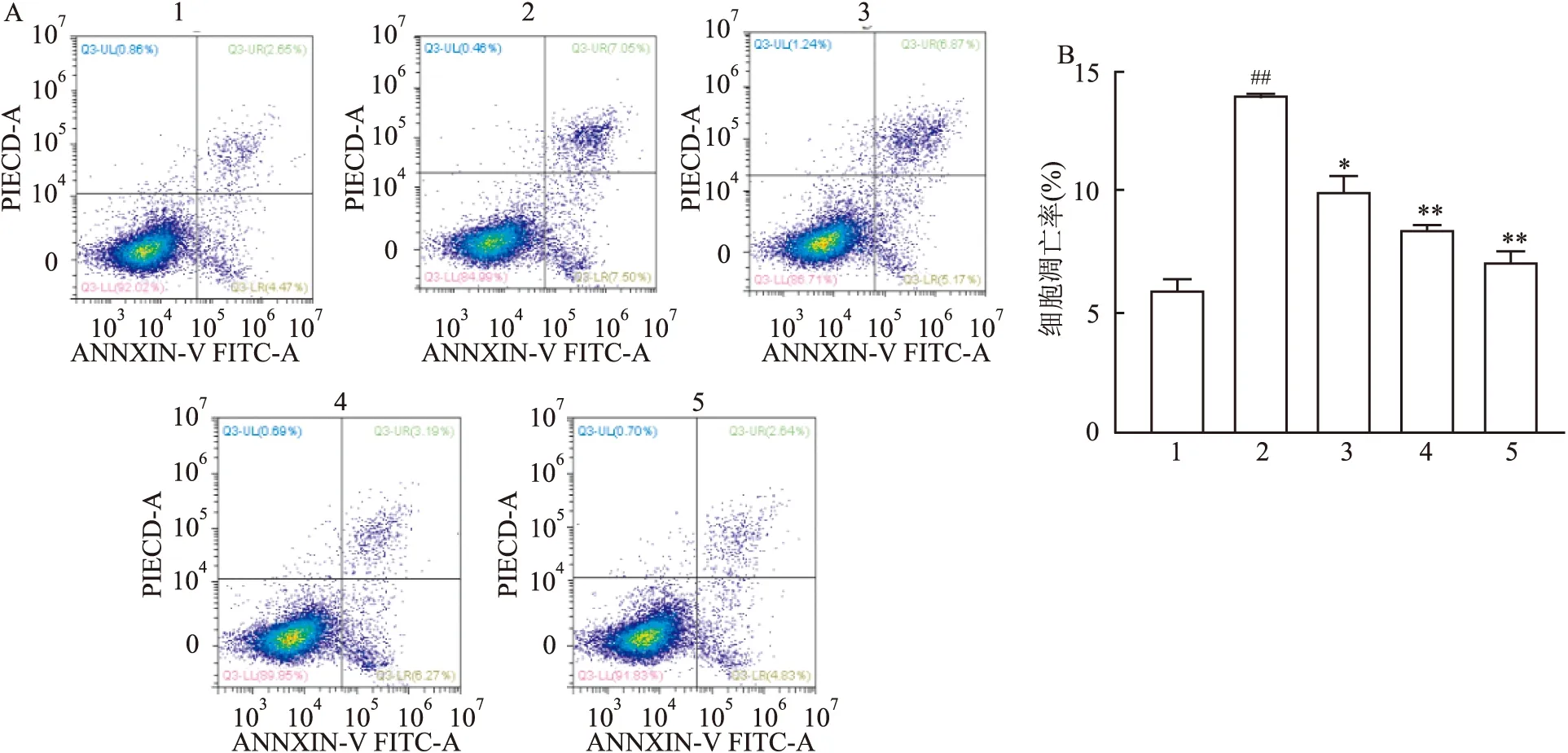
图1 BBR对足细胞凋亡率的影响
2.2 BBR对足细胞增殖数量的影响
与正常组相比,高糖组足细胞数量减少,差异有统计学意义(F
=267.701,P
<0.01);与高糖组相比,BBR 30、60、90 μmol/L组足细胞数量逐渐增加,差异有统计学意义(F
=349.779,P
<0.01)。见图2。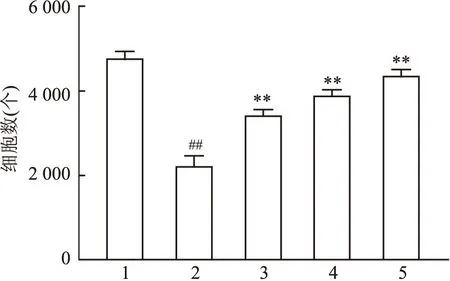
图2 BBR对足细胞生长的影响
2.3 BBR对足细胞迁移能力的影响
与正常组相比,高糖组迁移至下室的足细胞增多,差异有统计学意义(F
=116.326,P
<0.01);BBR 30、60、90 μmol/L组迁移至下室的细胞数逐渐下降,与高糖组相比,BBR给药组迁移至下室的细胞数明显减少,差异有统计学意义(F
=153.166,P
<0.05)。见图3A。与正常组相比,高糖组划痕愈合率有所增加,差异有统计学意义(F
=177.807,P
<0.01);BBR 30、60、90 μmol/L组划痕愈合率逐渐降低,与高糖组相比,BBR给药组划痕愈合率降低,异常迁移的足细胞数有所减少,差异有统计学意义(F
=231.058,P
<0.01)。见图3B。
图3 BBR对足细胞迁移能力的影响
2.4 BBR对高糖刺激后的足细胞相关蛋白表达的影响
Western blot结果显示,与正常组相比,高糖组足细胞中的 AKT、p65、IκBα磷酸化水平升高,Bim蛋白表达上升, p-AKT/AKT、p-p65/p-65、 p-IκBα/IκBα、Bim/β-actin上升,差异有统计学意义(F
=13.978、17.776、14.283、120.821,P
<0.01);与高糖组相比,不同浓度BBR给药组AKT、p65、IκBα磷酸化水平降低,Bim蛋白表达下降,差异有统计学意义(F
=14.971、23.701、15.500、82.618,P
<0.05)。见图4。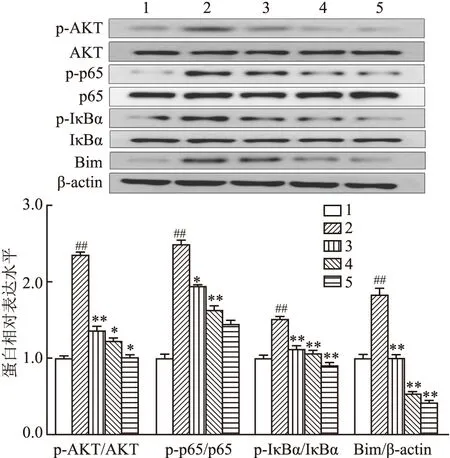
图4 Western blot 检测p-AKT/AKT、p-p65/p-65、p-IκBα/IκBα and Bim/β-actin蛋白表达
2.5 BBR对足细胞标志性蛋白的影响
与正常组相比,高糖组足细胞中的 WT-1、Podocin蛋白表达下降,desmin蛋白表达上升,差异有统计学意义(F
=123.743、21.447、172.166,P
<0.01);与高糖组相比,不同浓度BBR给药组WT-1、Podocin蛋白表达上升,desmin蛋白表达下降,差异有统计学意义(F
=164.146、18.717、210.587,P
<0.01)。见图5。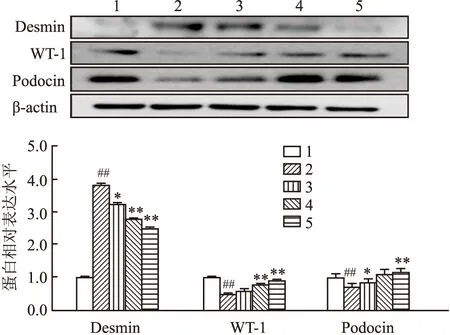
图5 Western blot检测desmin、WT-1、Podocin蛋白表达
3 讨论
足细胞是肾小球的主要组成部分,它与肾小球基底膜、内皮细胞共同构成了肾小球的滤过屏障,保证了肾小球的滤过功能。而高血糖环境会导致足细胞损伤、足突融合消退,足细胞异常迁移、从基底膜上脱落。足细胞的损伤、丢失又能进一步加重肾脏的病变。本研究是以足细胞为研究对象,高糖组的建立是借助于30 mmol/L的葡萄糖刺激24 h产生,该方法的可行性已有研究证实。本次研究结果显示,相比于高糖组,不同浓度的BBR给药组能够降低足细胞凋亡率,增强足细胞增殖能力,缓解足细胞异常迁移。说明BBR给药能有效抑制高糖刺激下的足细胞凋亡、减弱足细胞迁移能力、改善足细胞功能异常。刘青 等研究表明不同浓度(30、60、90 μmol/L)的BBR给药能不同程度地发挥足细胞保护作用,与本次实验的研究结果一致,且为本次实验BBR的浓度选择提供了理论依据。
Podocin、WT-1 和desmin都属于足细胞标志蛋白,Podocin 和 WT-1是细胞骨架的重要分子结构,在足细胞损伤时会发生缺失。而 desmin 是细胞骨架的中间丝蛋白,正常条件下不表达或低表达,但在足细胞功能受损时大量表达。本次研究结果显示,相比于模型组,BBR给药组能够升高Podocin、WT-1蛋白的表达,降低desmin蛋白的表达,说明BBR给药能够改善足细胞标志性蛋白的异常表达,缓解足细胞损伤。NF-κB家族有5个成员:RelA(p65)、RelB、c-Rel、p50和p52。正常情况下,NF-κB二聚体通过协同IκB定位于细胞质中,其包括3种经典的蛋白IκBα、 IκBβ和IκBε。当IκBα被免疫蛋白酶降解时会释放活化的p65,并促使其向细胞核内转化,有研究表明AKT的磷酸化会促进NF-κB信号通路的激活,进而促进细胞凋亡。Bim是一种细胞凋亡蛋白,会在凋亡的细胞中大量表达,激活NF-κB信号通路促细胞凋亡的同时Bim蛋白异常上升。本研究显示,相比于模型组,BBR给药组能有效降低高糖刺激下AKT、p65、IκBα的磷酸化水平,同时降低细胞凋亡蛋白Bim的表达水平,说明BBR可能通过AKT/NF-κB信号通路改善足细胞凋亡。Wang et al研究表明NF-κB信号通路与足细胞凋亡密切相关,与本次研究结果一致。
综上所述,高糖刺激可以通过调节AKT/NF-κB信号通路下调异常表达的Bim蛋白,从而抑制足细胞凋亡、改善足细胞损伤、减弱足细胞迁移能力以发挥足细胞保护作用。

