RB1-C磷酸化位点突变体与Sedlin的共定位研究
潘林鑫,徐 涛,范礼斌,钱 成
视网膜母细胞瘤蛋白1(retinoblastomal,RB1)是人类第一个成功克隆的抑癌基因,此发现是人类理解细胞周期调控和肿瘤遗传学的里程碑。人RB1基因定位在染色体13q14上,全长约18 kb,其中CDS序列全长2 787 bp,编码包含928个氨基酸残基的核内磷酸化蛋白pRb,其包含N-末端(1~379 aa)、A/B口袋结构域(380~785 aa)和C-末端(786~928 aa)三个结构域,其中RB1羧基端(RB1-C)含有高度保守的亮氨酸链,能促进蛋白与周期蛋白折叠的结合,在蛋白相互作用过程中扮演着重要角色,而RB1-C中丝氨酸和苏氨酸的磷酸化是RB1发挥生物学功能最重要的机制之一。人SEDL
基因定位在染色体Xp22.12-Xp22.31上,全长约20 kb,其中CDS序列全长420 bp,编码包含140个氨基酸残基的迟发性脊椎骨骺发育不良病蛋白(spondyloepiphyseal dysplasia tarda associated protein,Sedlin),该蛋白在骨骼正常发育、蛋白运输过程中发挥着重要作用。该研究首先探索了RB1-C和Sedlin在细胞中的共定位现象,然后通过构建一系列RB1-C磷酸化位点突变体,检测其蛋白表达和细胞定位情况,并进一步观察这些突变体与Sedlin的共定位情况,确定RB1-C中影响其与Sedlin共定位的磷酸化位点,为接下来研究二者相互作用的关键结合位点提供依据。1 材料与方法
1.1 质粒、菌株和细胞
pcDNA3.1空载体质粒、pcDNA3.1-FLAG-RB1-C和pcDGFP-Sedlin真核表达载体质粒,DH5α大肠埃希菌感受态菌株,HEK 293T和COS7细胞株均由安徽医科大学生命科学学院生物学实验室保存。1.2 主要试剂
DNA聚合酶购自日本TaKaRa公司;BamHⅠ、Xho Ⅰ和Dpn Ⅰ限制性内切酶购自上海生工生物公司;质粒小量抽提试剂盒购自美国Axygen公司;细胞裂解液、PMSF蛋白酶抑制剂、一抗稀释液购自上海碧云天公司;FLAG抗体购自德国Sigma公司;DMEM高糖培养基购自美国HyClone公司;胎牛血清购自美国CLARK公司;脂质体转染试剂盒、Opti-MEM®Medium购自美国Invitrogen公司;AL600RGB凝胶成像系统购自美国GE公司;Axio Observer 3倒置荧光显微镜购自德国卡尔蔡司公司。1.3 方法
1
.3
.1
质粒构建 设计并合成RB1-C磷酸化位点突变体引物,见表1,以质粒pcDNA3.1-FLAG-RB1-C为模板,利用高保真DNA聚合酶分别扩增出突变体pcDNA3.1-FLAG-RB1-C-S788A、S795A、S807A、T811A、T821 A、T826A,在PCR产物中加入Dpn Ⅰ酶消化模板,然后转化于DH5a感受态中培养至单克隆生成,挑取单克隆继续扩大培养后进行质粒小量抽提,并对质粒进行双酶切鉴定(BamHⅠ和Xho Ⅰ),6 h后进行琼脂糖电泳,选择鉴定正确的质粒对目的片段进行测序,并分析磷酸化位点是否成功突变。
表1 RB1-C磷酸化位点突变体引物表
1
.3
.2
细胞培养 复苏HEK 293T和COS7细胞系,并用完全培养基(90%DMEM高糖 + 10% FBS+青链霉素)在5%CO的恒温培养箱中进行培养,并及时进行细胞换液和传代。1
.3
.3
质粒转染 本研究采用的转染方法为脂质体(Lipo8000)转染法,具体步骤以6孔板为例:在进行转染前,把培养有细胞的6孔板每孔换成2 ml新鲜的完全培养液,然后取一个洁净无菌的离心管,加入125 μl不含抗生素和血清的DMEM培养液或Opti-MEM® Medium,加入2.5 μg质粒后轻轻混匀,再加入4 μl Lipo8000转染试剂后轻轻混匀,并将混合液滴加至6孔板中,继续培养24~48 h,用于后续的细胞定位和蛋白表达实验。1
.3
.4
Western blot检测 转染各RB1-C磷酸化位点突变体至HEK 293T细胞中,约48 h后收集细胞,加入裂解缓冲液(含蛋白酶抑制剂)进行裂解(4 ℃、30 min),超声破碎后收集细胞裂解液进行高速离心(4 ℃、10 min),收集部分上清液,加入适量的5×SDS上样缓冲液,充分混匀后沸水浴5 min,冰浴后取适量蛋白样品先后进行SDS-PAGE电泳(100 V、2 h)和恒流湿转(200 mA、1 h),取出PVDF膜后先后进行封闭(5% 牛血清白蛋白、1 h)、清洗(TBST缓冲液、30 min)、FLAG一抗溶液孵育(1 ∶500、4 ℃、过夜)、HRP-IgG二抗溶液孵育(1 ∶5 000、室温、1 h)、清洗(TBST缓冲液、30 min)等操作,最后利用ECL化学发光试剂盒对PVDF膜进行显色,在蛋白成像仪上进行显影和拍摄。1
.3
.5
免疫荧光观察 单独转染各RB1-C磷酸化位点突变体或与Sedlin共同转染至COS7细胞中,约24 h后取出细胞爬片,用PBS缓冲液清洗3次后进行细胞固定(-20 ℃预冷甲醇2 min 、70%乙醇5 min),用PBS缓冲液清洗3次后进行细胞封闭(1% BSA、30 min),加入FLAG一抗溶液进行孵育(1 ∶100、室温、2 h),用封闭液清洗3次后加入TRITC标记的荧光二抗进行避光孵育(1 ∶200、室温、1 h),用PBS缓冲液清洗3次后加入0.15 g/L DAPI溶液进行细胞核染色(室温、2 min)用PBS缓冲液清洗3次后用滤纸尽可能吸去盖玻片上的溶液,用荧光封片胶将盖玻片封于洁净的载玻片上,在荧光显微镜下观察并拍摄。1.4 统计学处理
采用SPSS 22.0软件进行统计学分析,两个独立样本间采用χ检验,数据以频数表示,P
<0.05为差异有统计学意义。2 结果
2.1 RB1-C与Sedlin的细胞内定位及共定位情况
分别将FLAG-RB1-C和GFP-Sedlin转染至COS7细胞中,进行免疫荧光实验观察它们各自的细胞定位情况,结果显示RB1-C主要定位在细胞核中,而Sedlin在细胞核和细胞质中均有显著定位,见图1A。将二者共同转染至COS7细胞中,并观察它们在细胞内的共定位情况,结果表明RB1-C和Sedlin在细胞核内明显存在共定位现象,见图1B。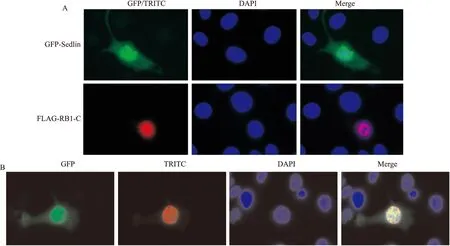
图1 RB1-C与Sedlin的细胞内定位及共定位
2.2 RB1-C磷酸化位点突变体的构建
酶切鉴定结果显示所有质粒均出现两条带,与DNA Marker的比较,一条带与目的片段RB1-C(432 bp)的大小基本一致,另一条带与pcDNA3.1载体(5 400 bp)的大小基本一致。结果表明RB1-C磷酸化位点突变体扩增成功,见图2A。将各质粒送生物公司进行测序,且将测序结果与RB1-C的CDS序列进行比对,显示各磷酸化位点均突变成功,即丝氨酸或苏氨酸均成功突变为丙氨酸,见图2B。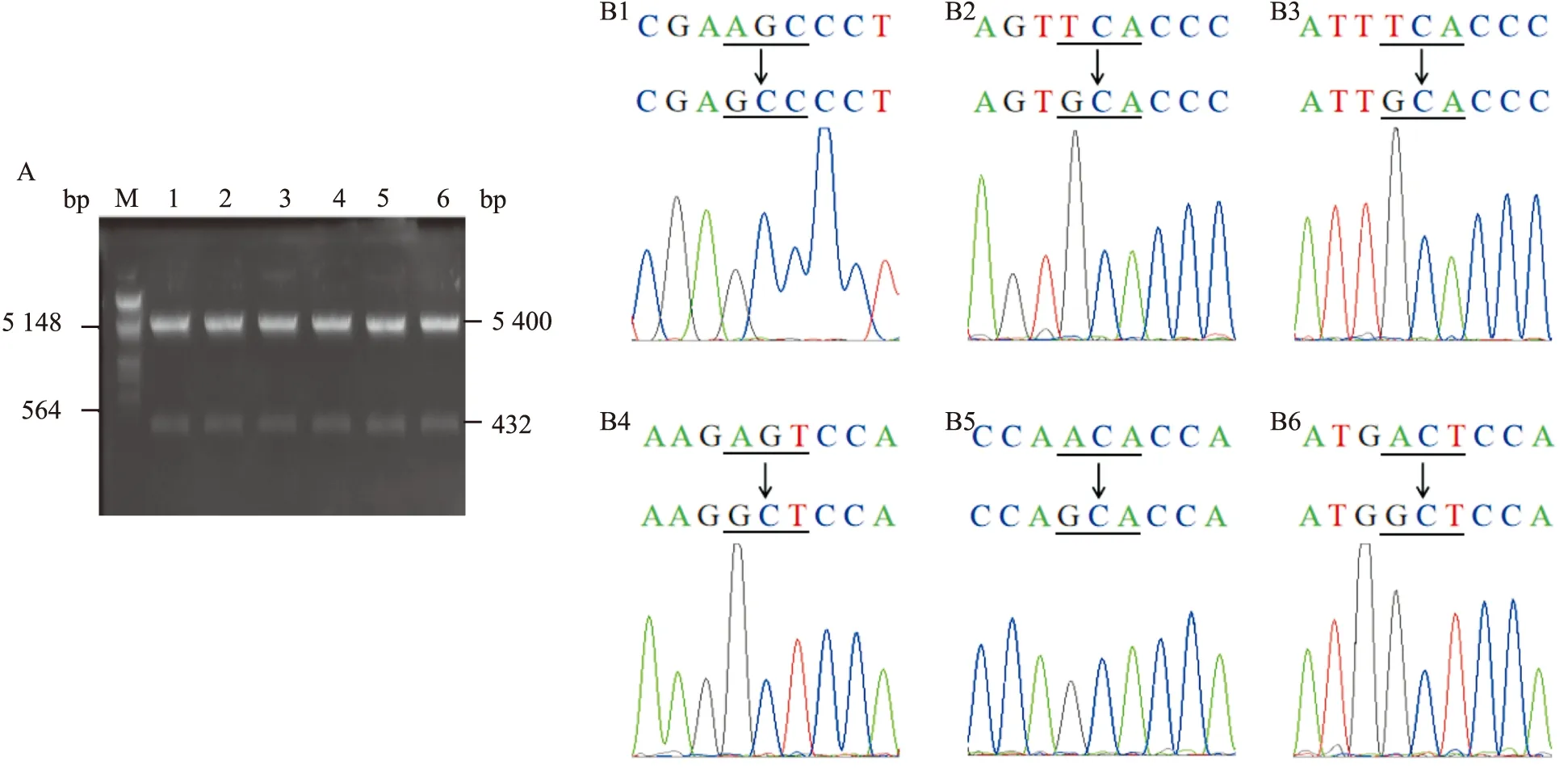
图2 RB1-C磷酸化位点突变体的酶切鉴定与测序结果
2.3 RB1-C磷酸化位点突变体的表达与细胞定位情况
Western blot结果显示用FLAG抗体免疫印迹时,转染了RB1-C磷酸化位点突变体的各组样品在约15 ku左右的位置均出现蛋白条带,且分子量大小与RB1-C野生型基本一致,见图3A,这一结果表明RB1-C磷酸化位点突变体能够在真核细胞内正常表达。分别将上述质粒转染至COS7细胞中,并进行免疫荧光实验观察它们各自的细胞定位情况,结果显示这些RB1-C磷酸化位点突变体主要定位在细胞核中,与野生型RB1-C的定位情况基本一致,见图3B,这一结果表明RB1-C磷酸化位点的突变并不会影响其表达和定位。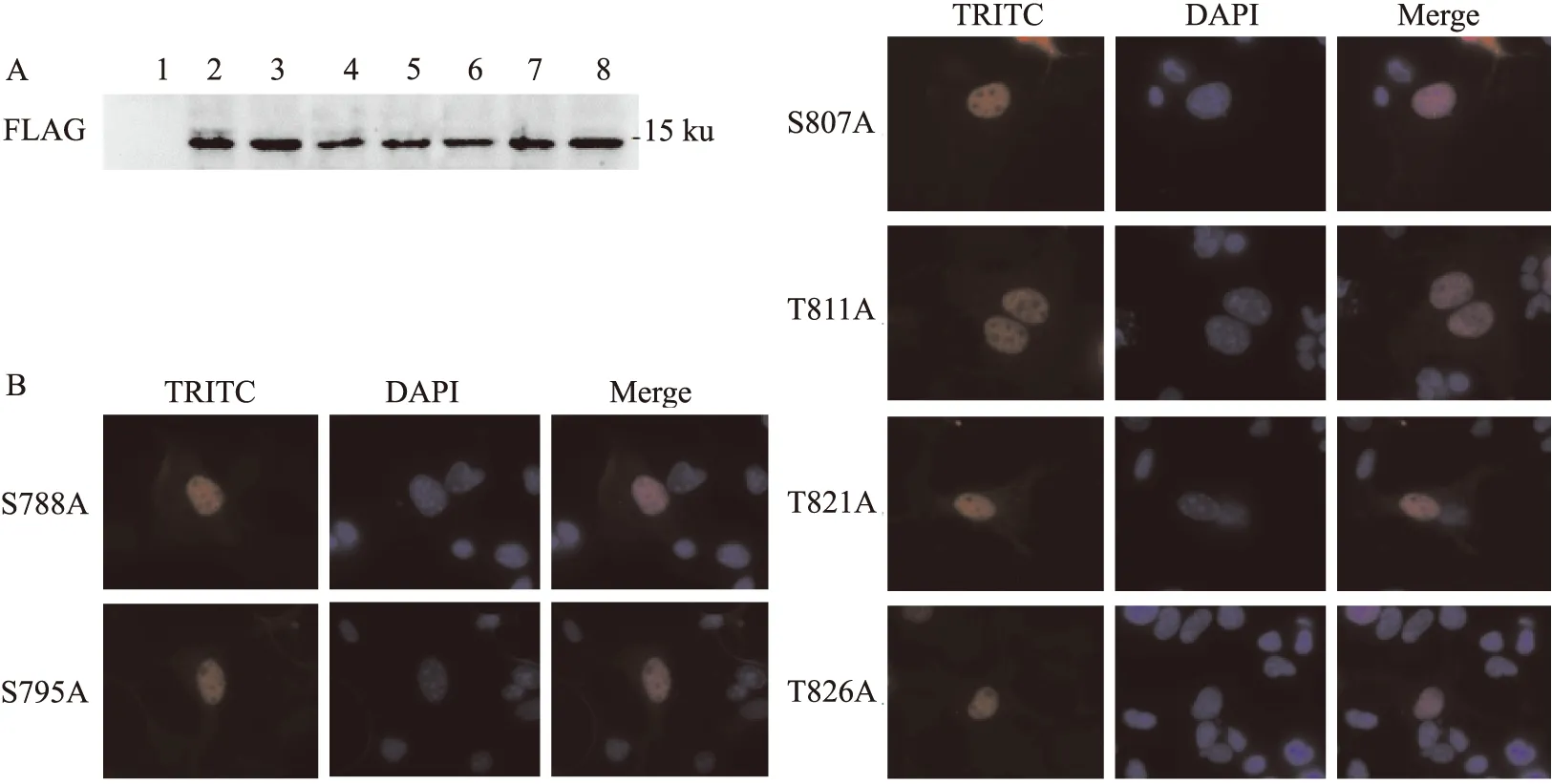
图3 RB1-C磷酸化位点突变体的表达与细胞定位图
2.4 RB1-C磷酸化位点突变体与Sedlin的共定位情况
与野生型RB1-C相比,RB1-C-S788A、S795A、T821A、T826A与Sedlin的共定位未发生明显改变,主要还是共定位于细胞核内,但RB1-C-S807A、T811A与Sedlin的共定位结果发生了很大变化。在各拍摄的30余组结果中,RB1-C-T811A与Sedlin有19组共定位于细胞核内,另有13组共定位于细胞质中;而RB1-C-S807A与Sedlin变化则更大,有29组共定位于细胞质中,仅有4组定位在细胞核中,见图4和表2;这一结果表明807、811位点的突变对RB1-C与Sedlin的共定位产生了影响。
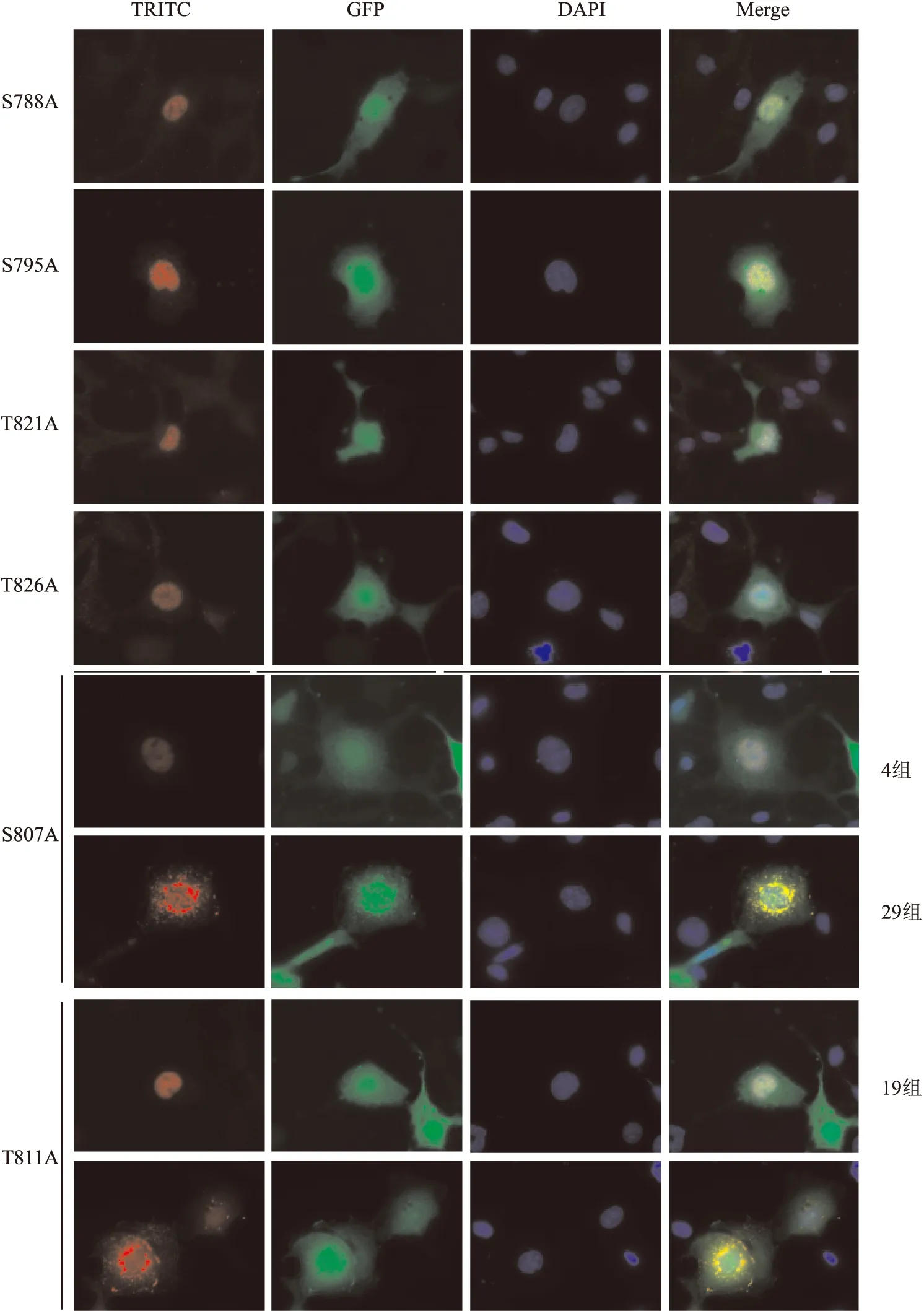
图4 RB1-C磷酸化位点突变体与Sedlin的细胞共定位图

表2 RB1-C磷酸化位点突变体与Sedlin的细胞共定位情况(组数)
3 讨论
RB1在哺乳动物的组织细胞中广泛表达,预示着其功能上的多样性,而磷酸化是RB1最基本、最普遍和最重要的功能机制,其磷酸化水平的变化能够对细胞周期产生调控作用,进而影响细胞增殖、分化、衰老、凋亡等生物学功能,而其抑癌作用与这些功能的正常发挥密切相关。RB1功能的发挥依赖于其口袋结构域,能够通过该结构域与许多重要蛋白相互作用,如E2F转录因子;RB1-C磷酸化位点的研究对进一步探索其生物学功能有重要意义。另外,Sedlin是一个高度保守的蛋白,广泛分布于心脏、肝脏、肾脏、骨骼肌等组织,且在酵母、果蝇和脊椎动物中都存在着同源物,它是转运蛋白颗粒复合物中的一员,也可能是ERGIC/VTC复合物的一部分,在蛋白运输过程即内质网-高尔基复合体之间的膜泡运输中发挥着重要作用。
本研究首先对RB1-C与Sedlin的共定位进行了探索,结果表明二者在细胞核内明显存在共定位现象,但二者结合的具体位点尚不明确,需进行进一步的点突变研究。RB1的磷酸化对其功能的发挥有重要作用,其磷酸化位点的突变可能引起蛋白结构变化进而影响相互作用功能,磷酸化位点一般有丝氨酸(serine,S)、苏氨酸(thr-eonine,T)、酪氨酸(tyrosine,Y),其中S和T最常见,因为其结构末端含有活泼的羟基,更容易与磷酸基团结合促进磷酸化发生。另外,丙氨酸(alanine,A)是氨基酸中侧链最短的手性氨基酸,通过将某氨基酸残基突变为A,可以通过考察该突变蛋白的功能是否因此突变而失去或改变,从而可以定位对该蛋白功能有关键影响的氨基酸残基,这种方法被称作“丙氨酸扫描”,是丝氨酸/苏氨酸的磷酸化功能研究的一种手段。本研究即通过将S/T突变为A来构建RB1-C中6个重要的磷酸化位点突变体。
虽然点突变构建已经是成熟的基因修饰技术,但与普通质粒构建相比,其在实际操作过程中还存在着一些难点。本研究中点突变构建采用了一步法,即以pcDNA3.1-FLAG-RB1-C为模板将整个环状质粒扩增出来。该目的片段较长,将近6 000 bp,所以扩增的成功率和保真率有所下降,即便扩增成功,后期的模板消化操作也很关键。如果模板消化不完全,将会在质粒转化过程混入野生型RB1-C,导致假阳性。克隆中存在大量野生型RB1-C,增加了测序成本,影响实验进程。本研究首先成功构建了6个RB1-C磷酸化位点突变体,即pcDNA3.1-FLAG-RB1-C-S788A、S795A、S807A、T811A、T821A、T826A,并对其定位和表达情况进行了研究,结果表明它们的细胞亚定位和野生型RB1-C基本一致,即主要定位在细胞核内,且蛋白表达的分子量也与野生型RB1-C的基本一致。与野生型RB1-C相比,RB1-C-S788A、S795A、T821A、T826A和Sedlin的共定位未发生改变,依旧主要集中在细胞核内,但RB1-C-S807A、T811A和Sedlin共定位的位置发生了很大变化,除了有共定位于细胞核,在细胞质中也存在共定位,而且根据位置推测可能存在于内质网和(或)高尔基体上,表明它们可能是RB1-C和Sedlin相互作用的关键位点,且这两个位点的突变很可能会降低Sedlin与RB1的结合效率,进而影响Sedlin对RB1蛋白入核的运输功能。该研究为进一步了解RB1-C的生物学功能及其与Sedlin相互作用的具体位点奠定了细胞学基础。

