临床药师参与1例儿童慢性活动性EB病毒感染治疗的临床实践
袁勇,付燕,赵梦茹,何大方
(1.昆明市妇幼保健院,云南昆明 650000;2.昆明医科大学第二附属医院,云南昆明 650000)
EB病毒(Epstein-Barr virus,EBV)是一种人类常见的γ疱疹病毒,全球至少90%的成年人血清EBV抗体阳性[1],它也是一种人类癌症病毒,包括伯基特淋巴瘤、霍奇金淋巴瘤、鼻咽癌、T/NK细胞淋巴瘤等[2]。慢性活动性EBV感染(chronic active Epstein-Barr virus infection,CAEBV)是EBV持续性感染引起的一种严重致死性疾病,该病在中国和日本等东亚国家儿童中常见,预后极差,已受到广泛关注[3],2016年世界卫生组织已将其归为淋巴瘤分类淋巴组织增生性疾病[4]。本研究通过临床药师对1例儿童慢性活动性EBV感染患儿的药学监护实践,探讨临床药师参与儿童CAEBV的个体化治疗方案制定、药物使用安全性及不良反应监测方面的切入点,以期为儿童CAEBV的诊治提供参考。
1 病例资料
患儿,男,14岁,体质量36 kg,体表面积1.17 m2,因“间断发热4 d”于2019年2月18日入院。2018年8月11日患儿因为蚊子叮咬后出现面部丘疹样皮疹、发热,在当地医院住院治疗。给予阿昔洛韦0.18 g,q8h治疗15 d后,患儿体温平稳、皮疹结痂后出院。出院数日后再次出现发热,返院继续输注阿昔洛韦0.18 g,q8h治疗10 d,体温降至正常出院。2019年2月15日患儿再次被蚊子叮咬后出现发热,最高达39.3 ℃,左手腕部可见一个丘疹水疱样皮疹,腹股沟区可见一包块突起。当地医院EB病毒DNA定量测定提示EB病毒感染,腹部B超提示脾脏轻度肿大,给予输注头孢唑肟1.8 g,q8h治疗 4 d,更昔洛韦0.18 g,bid,治疗1 d,患儿仍有发热,转入我院。入院查体:体温36.5 ℃,脉搏96次/分,呼吸19次/分,一般情况可,无贫血貌,全身未见出血点。左颈后可触及1个大小约1 cm×1 cm肿大淋巴结,质硬,轻压痛,左手腕部可见1个大小约1 cm×1 cm结痂创面,局部有黑色痂皮覆盖。左侧腹股沟区可见1个大小约4 cm×5 cm向外突起包块,包块质硬,无波动感,无压痛,活动度差。脾脏在肋下三横指处可触及,质地软,边缘锐利,未触及包块。既往史:否认传染病、肝炎、疟疾及进食生肉病史。家族史:母亲堂妹的儿子2017年确诊“EB病毒感染并噬血细胞综合征”。否认药物、食物过敏史。入院诊断:慢性活动性EBV感染?
2 临床治疗及药学监护
2.1 治疗经过
患儿入院当日查血常规示:白细胞11.61×109/L,中性粒细胞百分率23.10%,淋巴细胞百分率69.90%,C反应蛋白(CRP)12.80 mg/L。入院体温变化见图1,主要实验室检查见表1。给予更昔洛韦0.18 g,q12h,抗病毒治疗,同时完善相关检查。

表1 患儿住院治疗期间实验室检查结果
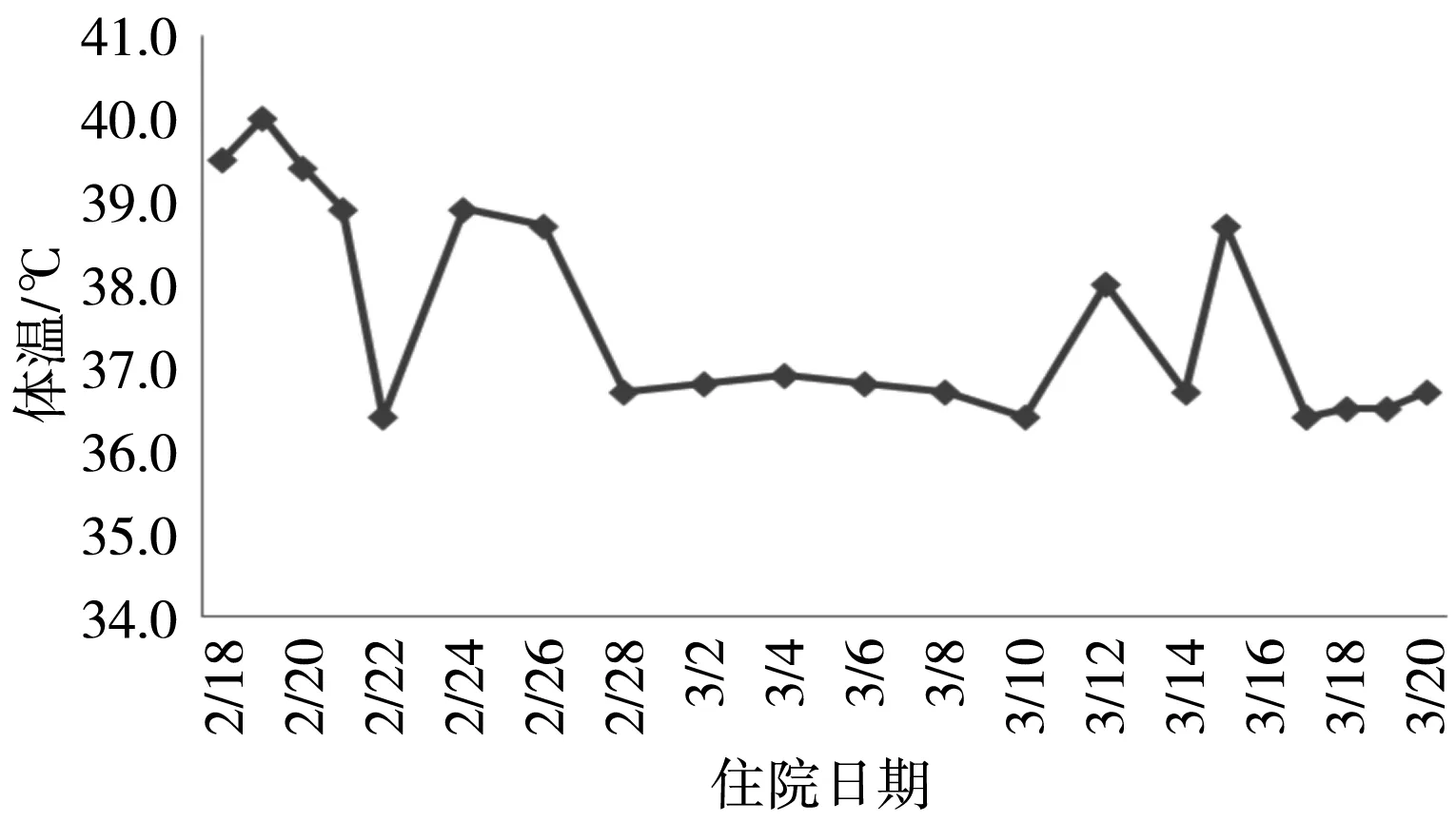
图1 患儿住院期间体温变化趋势
住院第3天,患儿双侧面部出现两处新发蚊虫叮咬皮疹,丘疹水泡样。淋巴细胞亚群检测示:总T淋巴细胞百分率12.70%,T4淋巴细胞百分率8.80%,T8淋巴细胞百分率3.90%,B淋巴细胞百分率30.30%,自然杀伤(NK)细胞百分率33.8%,HLA-DR+T淋巴细胞百分率0.10%。血脂+贫血三项:甘油三酯1.81 mmol/L,血清铁蛋白110.80 ng/mL。
住院第9天,可溶性白介素2受体示:1 155 U/mL;肝胆胰脾双肾彩超示:脾大声像;全身浅表淋巴结彩超示:双侧颈部、腋窝及腹股沟多发肿大淋巴结声像;骨髓细胞学检查示:髓像粒、红、巨细胞增生,淋巴细胞比例及形态异常。予地塞米松磷酸钠6 mg,q12h,静脉注射调节免疫及减轻炎症治疗。
住院第13天,患儿双侧面部水疱部分结痂,皮肤病理活检示:先天性大疱性表皮松懈症。患儿骨髓活检未见三系下降及嗜血细胞,血清铁蛋白正常,暂不考虑噬血细胞性淋巴组织细胞增多症,因考虑更昔洛韦对潜伏感染为主的EBV效果不佳,加用重组人干扰素α2b注射液300万U,qd,肌肉注射调节免疫治疗。
住院第19天,血清总IgE测定:3 440 IU/mL。血液科会诊建议完善噬血细胞综合征(HLH)基因检测,患儿体温已平稳3 d,皮疹已结痂,无新出皮疹,病情平稳,地塞米松减量为6 mg,qd,静脉注射。复查白细胞升高,需警惕患儿出现感染,给予阿莫西林/克拉维酸钾1.2 g,q12h静脉滴注抗感染治疗。
住院第23天,患儿再次出现发热,最高体温38.0 ℃,左手背出现一个新发丘疹水泡样皮疹。淋巴细胞亚群检测:淋巴细胞百分率69.80%,T4淋巴细胞百分率8.30%,T8淋巴细胞百分率65.30%,B淋巴细胞百分率4.20%,NK淋巴细胞百分率4.10%;HLA-DR+T淋巴细胞百分率1.0%。EBV抗体检测:EBV-CA-IgG(+),EBV-NA-IgG(+);颈部淋巴结病理活检会诊意见:EBV感染相关淋巴增殖性疾病。考虑糖皮质激素减量后药效减弱导致患儿体温控制不佳,CAEBV诊断明确,继续给予地塞米松磷酸钠6 mg,q12h,静脉注射治疗,待排除化疗禁忌后计划给予化疗诱导及免疫球蛋白0.5 g/kg,qd,冲击治疗。
住院第25天,查阅国内外该病治疗进展及相关指南,临床医师与临床药师讨论后决定给予静脉注射人免疫球蛋白20 g,qd,静脉冲击治疗,注射用依托泊苷(VP-16)150 mg/m2,qd,免疫抑制治疗,同时加用泮托拉唑钠胶囊40 mg,qd,口服抑酸及盐酸昂丹司琼8 mg,q12h,静脉滴注止吐治疗。
住院第26天,患儿化疗顺利,无不良反应发生,更昔洛韦抗感染治疗疗程已足,停用更昔洛韦,患儿无发热及新出皮疹,地塞米松调整为12 mg,qd,静脉注射治疗。
住院第29天,继续免疫抑制治疗,医师建议加用环孢素,100 mg,bid,口服治疗。患儿血小板下降,但无皮下出血点,凝血功能正常,暂不予特殊处理。
住院第31天,上海复旦大学附属儿童医院会诊建议:造血干细胞移植。患儿经2次免疫抑制后,无发热及新出皮疹,家属要求转院进一步治疗,给予出院。
2.2 患儿初始治疗方案分析
EBV通过CD21受体以裂解和潜伏方式主要感染B细胞,也可感染T或NK细胞。EBV在上皮细胞中经历裂解复制,并在循环记忆B淋巴细胞中建立终生潜伏期,从潜伏期定期重新激活,从而继发CAEBV形成。《儿童主要非肿瘤性EB病毒感染相关疾病的诊断和治疗原则建议》[5]认为CAEBV初始抗病毒治疗无效,CAEBV症状和体征不是病毒复制的结果,而是对EBV感染的B细胞的过度免疫反应。患儿入院后以异型淋巴细胞升高为主,EBV拷贝数增加,由于CAEBV目前尚无统一治疗方案,且大多数EBV患者初始感染时均为传染性单核细胞增多症表现[6],医师认为先经验性给予更昔洛韦对症治疗。临床药师查阅文献后发现, EBV感染后机体后可通过上调基因表达重新激活病毒裂解周期,且病毒可逃逸机体免疫[7],及时给予糖皮质激素及免疫调节剂治疗可以抑制裂解蛋白表达,糖皮质激素可减轻细胞炎症因子的释放,免疫调节剂干扰素一方面可抑制激活的CTL、NK及巨噬细胞免疫应答;另一方面可促进宿主B细胞分化,增强CTL及NK细胞的活性[8-9]。该患儿淋巴细胞亚群检测结果CD3+、CD4+及CD8+细胞水平明显下降,免疫功能处于紊乱及缺陷状态。临床药师建议加用糖皮质激素抑制巨噬细胞活性,减轻细胞因子释放毒素。医师同意待排除自身免疫性疾病及肿瘤后再给予糖皮质激素治疗。目前已有α干扰素治疗CAEBV有效的个案报道[10-11],医师同意使用糖皮质激素及α干扰素调节免疫治疗。
患儿入院抗病毒治疗9 d,持续发热,临床药师通过文献及指南回顾,CAEBV与EBV相关的噬血细胞性淋巴组织细胞增生症(EBV-HLH)存在相似临床过程[12],医师与临床药师一致同意参照目前国际组织细胞学会提出的HLH-2004治疗方案[13]。
住院治疗13 d,加用干扰素治疗。由于该患儿静脉使用糖皮质激素时间长,临床药师建议对患儿血糖、血压及肝肾功能进行监护,同时口服维生素D及钙制剂,避免交叉感染。经过监护,该患儿住院期间未见血压、血糖异常及胃肠道不良反应。糖皮质激素治疗第2天,患儿未再出现发热,加用干扰素后,患儿无特殊不适,双侧面部皮疹已逐渐结痂。
2.3 患儿诱导期治疗方案选择与药学监护
患儿入院第25天,左手背再次出现2处新发丘疹水泡样皮疹,糖皮质激素减量后出现再次发热,复查EBV拷贝数及异型淋巴细胞百分率未出现下降,且淋巴细胞亚群检测提示免疫功能紊乱,骨髓及淋巴组织活检也确诊该患儿为EBV相关淋巴增殖性疾病,医师考虑EBV尚处于活跃期,建议采用化疗诱导控制病情,并让临床药师给出化疗建议。临床药师回顾文献发现CAEBV与EBV-HLH诱导治疗相同[14],目前多采用国际组织细胞学会HLH-2004诱导期方案治疗,EBV相关的淋巴组织增生症可造成细胞因子风暴产生过度炎症反应,使用依托泊苷、甲氨蝶呤及环孢素诱导治疗已在HLH-2004方案中证实有效。另外一个来自中国19例CAEBV儿童感染病例报道中,采用HLH-2004方案病例治疗后病情得到完全缓解[15]。HLH-2004方案诱导期采用“三步治疗”,即第一步:免疫抑制,依托泊苷(VP-16)与地塞米松静脉给药,同时口服环孢素治疗;第二步:多药化疗,如果EBV拷贝数下降小于1 log数量级,可重复第一步或采用新的化疗;第三步:异体造血干细胞移植。有研究证实,VP-16的引入是治疗EBV的第一个重大进展。包括前8周的诱导治疗和随后的继续治疗,VP-16可抑制EB核衣壳合成并具有抗EBV作用,同时选择性灭活活化的T细胞和抑制炎性细胞因子的产生[16],大剂量丙种球蛋白可增加抑制性T细胞的激活,降低辅助性T细胞的活性,减弱组织细胞的吞噬活性,丙种球蛋白联合糖皮质激素治疗对EBV相关淋巴增殖性疾病效果较好[17],医师与临床药师讨论后同意参照方案,先给予丙种球蛋白及地塞米松磷酸钠注射液静脉冲击,排除化疗禁忌后每周给予VP-16两次治疗。
入院第25天进行第一次化疗,VP-16说明书提示该药静脉滴注过速可导致低血压、喉痉挛等过敏反应,临床药师建议参照说明书输注时浓度不超过0.25 mg/mL,持续静脉滴注时间4 h以上,化疗期间密切监测患儿血常规、肝肾功能、血压、血糖及凝血功能,未发生不良反应。
入院第29天进行第二次化疗,同时加用环孢素口服治疗。嘱患儿化疗期间避免进食坚硬不宜消化食物,注意口腔清洁护理。环孢素为一种强效的免疫抑制剂,其不良反应与用量相关,用药期间建议监测血药浓度,使其血药浓度维持在200 μg/L。诱导期治疗还需综合评估患儿体温、肝脾功能、神经系统及血清铁蛋白、血小板、粒细胞等血液系统变化,如果出现进行性下降,需重新考虑重复诱导期治疗[18]。
2.4 患儿化疗不良反应监护
临床药师在化疗前查询药品说明书及相关文献,VP-16为细胞周期特异性抗肿瘤药,主要不良反应为过敏反应、胃肠道反应、口腔黏膜反应及骨髓抑制。HLH-2004治疗方案使用VP-16治疗时间久,其药品说明书示最常见的不良反应为胃肠道反应,医师让临床药师给出预防化疗不良反应用药建议,临床药师参考美国国立综合癌症网络(NCCN)止吐临床实践指南及中国肿瘤治疗相关呕吐防止指南[19]。VP-16为低致吐风险(呕吐发生率10%~30%)。需警惕给药数分钟或数小时后发生的急性恶心呕吐,推荐单独使用5-HT3受体拮抗剂昂丹司琼即可,临床药师建议给予昂丹司琼,于化疗前30 min及化疗后6 h使用。医师采纳建议,并预防性加用质子泵抑制剂泮托拉唑(40 mg,qd,口服)抑制胃酸,保护胃黏膜,2次化疗前后患儿均未出现明显的胃部不适。
骨髓抑制为化疗另一个常见的不良反应,虽然多为可逆反应,为避免长时间化疗诱发患儿骨髓不可逆抑制。临床药师建议每次化疗前后对患儿血常规、白蛋白及肌酐进行监测。VP-16说明书示,当中性粒细胞绝对值<1×109/L或血小板计数<50×109/L时需立即停止治疗,直到血细胞计数恢复到安全范围后才可继续使用。临床药师查阅HLH建议:骨髓抑制或肝功能异常不是开始使用VP-16化疗的禁忌证,因为疾病本身导致的骨髓和肝功能异常通常会通过规范的治疗而得到改善,如果在使用依托泊苷2周后出现血细胞计数进行性下降,才需考虑药物不可逆骨髓抑制;其次VP-16血浆清除率与肌酐清除率之间存在显着相关性,在VP-16治疗期间必须监测血肌酐值,如果升高需要重新考虑调整剂量[20]。2次化疗复查该患儿白细胞计数正常,血小板下降至50×109/L,肝酶未见严重下降,复查凝血功能正常,医师认为未出现严重不良反应,可以继续下一次化疗。临床药师建议同时监测患儿白蛋白,因低蛋白血症可能会增加依托泊苷毒性,且长期使用免疫抑制剂及糖皮质激素易诱发真菌感染,需完善G试验等真菌检测,医师采纳。
3 讨论
儿童CAEBV自发现至今仅有30 多年历史,目前缺乏规范有效的诊治指南,免疫抑制及细胞毒药物化疗暂时有效,而同种异体造血干细胞移植是该病治愈的唯一选择[21]。儿童属于特殊群体,其肝肾功能敏感脆弱,由于CAEBV化疗诱导治疗阶段疗程长,同时需长期使用糖皮质激素及免疫抑制剂,在治疗过程中由于免疫系统再次免疫激活可能导致继发性HLH发生,极易出现诱导期治疗反复,导致该病治疗复杂,临床药师通过文献回顾及查阅相关治疗指南,协助医师对儿童CAEBV治疗提供更优治疗方案,同时避免药物不良反应的发生,保证了儿童用药的有效性及安全性。

