微波-快速冻融耦合鱼皮明胶理化性质分析
杜 杰,刘廷薇,马 良,王洪霞,戴宏杰,余 永,朱翰昆,张宇昊
(西南大学食品科学学院,重庆 400715)
明胶是水溶性的热可逆多功能天然高分子聚合物,由母体胶原蛋白部分水解得到。明胶具有可逆转变的良好特性,被广泛用于药物控制释放、生物组织工程、食品和化妆品行业[1]。明胶提取通常需要经过两个步骤——明胶化和热提取[2]。明胶化过程破坏共价交联和非共价键(主要是氢键),从而使胶原蛋白的三螺旋结构松散,产生充分的溶胀和胶原蛋白增溶作用[3]。热处理会进一步裂解氢键和共价键,破坏三螺旋的稳定性,使螺旋结构过渡到线圈结构,转化为可溶性明胶,此转化常通过45 ℃以上的水浴加热来实现[4]。
酸碱法是我国明胶生产中采用的主要方法[5],使用酸碱处理可以破坏胶原蛋白中的共价键和一些次级键,以便原料在热水提胶过程中释放出胶原蛋白的亚基成分,从而形成明胶。酸和碱工艺都需要消耗大量的淡水,同时排放大量的废水污染物,严重危害环境[6]。同时,热水提胶过程通常为传统水浴提取,时间在数小时至数十小时不等,这是明胶生产周期长的主要原因。
目前,诱导胶原明胶化的新方法以酶法为主。从20世纪90年代以来,已有采用酶法生产明胶的报道。酶法提取明胶主要利用胃蛋白酶[7]、胰蛋白酶[8]、木瓜蛋白酶[9]等破坏原料中杂蛋白和胶原蛋白的非螺旋区,使三螺旋结构松散,从而使亚基组分在后期热水提胶过程中可以被释放。但该方法几乎不能破坏维持胶原纤维稳定的分子间共价键,因此提取的明胶得率较低[10-11],且小分子成分含量高,明胶凝冻强度低,这使得酶法所制明胶的市场价值低且竞争力差。本课题组曾尝试超高压法制备明胶,发现超高压会破坏原料胶原中的氢键平衡,使胶原分子的三螺旋结构松散[12]。此外,本课题组还探索了快速冻融协同稀酸诱导胶原明胶化法[13],发现该法可以有效打破氢键平衡,使胶原三螺旋结构松散,从而显著缩短猪皮胶原的明胶化时间。但这些方法因设备无法实现连续化生产,或因未能完全脱离酸的使用而无法真正达到明胶绿色清洁制备的要求。
微波除了加热作用外,对蛋白质也有一定作用。Zhang Jinwei等[14]将微波应用于清洗皮革时发现,微波会使胶原蛋白中的极性基团以相同的电荷趋势形成平行排列。Guan Junjun等[15]发现,微波首先可以破坏蛋白质与巯基的二硫键,导致蛋白质亚基的分解。Piątkowski等[16]发现在微波辐射下生物聚合物会发生降解。由此可知,微波可以打断蛋白质的共价键,破坏蛋白质的部分结构。冻融过程是冷冻和解冻融化的统称,冻融循环会引起蛋白质的变化,尤其是次级键的变化。而疏水相互作用、氢键、二硫键和离子相互作用等次级键的形成会导致蛋白质溶解度降低,肌球蛋白头部聚集[17]。
基于微波对蛋白质共价键的破坏和冻融对蛋白质次级键的影响,本实验创新性地提出微波-快速冻融耦合明胶化的方式,即胶原原料经微波预处理后进行快速冻融,然后再采用微波辅助提取。整个制备过程没有酸碱的使用,提取时间短,绿色清洁。本研究拟通过明胶等电点、透射比、分子质量分布、凝冻强度测定以及流变学特性、氨基酸组成和傅里叶变换红外光谱分析对微波-快速冻融耦合鱼皮明胶进行理化性质表征,并与传统的酸法制备明胶相比较,以期对此种新型明胶的基本性质、凝胶性能和明胶结构进行全面的认识。
1 材料与方法
1.1 材料与试剂
大目金枪鱼皮 山东省中鲁远洋(烟台)食品有限公司。
液氮 沙坪坝区双流液氮经营部;盐酸、十二烷基苯磺酸钠(sodium dodecyl benzene sulfonate,SDBS)、溴化钾(光谱纯) 成都市科龙试剂厂;L-羟脯氨酸合肥博美生物科技有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
MAS-II plus微波合成萃取反应工作站 上海新仪微波化学科技有限公司;SHZ-B水浴恒温振荡器 上海龙跃仪器设备有限公司;TA.XT2i物性测定仪 英国Stable Micro Systems公司;Spectrum 100傅里叶变换红外光谱仪美国PerkinElmer公司;L-8900型全自动氨基酸分析仪日本日立公司;DHR-1流变仪 美国TA公司;UV-2450紫外-可见分光光度计 日本岛津公司。
1.3 方法
1.3.1 微波-快速冻融耦合鱼皮明胶提取工艺及提取率的计算
鱼皮→室温解冻→去鳞去脂肪→剪碎脱脂、去杂蛋白→清洗→微波预处理→快速冻融→微波辅助提取→过滤、烘干→成品明胶
去鳞去脂肪:鱼皮解冻后,刮去表面鳞片、脂肪和多余的肉,清洗干净。剪碎脱脂、去杂蛋白:鱼皮剪成4 mm×4 mm片状,加入SDBS溶液(0.75 g/100 mL),超声脱脂2 h,每1 h更换一次脱脂液,超声功率120 W、温度25 ℃。将脱脂后清洗沥干的鱼皮按照料液比1∶5加入NaCl溶液(1.0 g/100 mL),磁力搅拌6 h,每2 h更换一次NaCl溶液。微波预处理:鱼皮与去离子水按料液比1∶6混合,55 ℃、350 W条件下微波预处理15 min。快速冻融:将鱼皮滤出,滤液备用,用液氮快速冷冻鱼皮,之后放入滤液中,在30 ℃水浴条件下搅拌解冻。微波辅助提取:将鱼皮与滤液混合物转移至微波提取容器中,按体积比50∶1加入质量浓度为6 g/100 mL的硅藻土溶液,55 ℃、350 W条件下微波加热提取60 min。过滤、烘干:微波提取后,滤去鱼皮,提取液经中速滤纸抽滤后,在60 ℃热风干燥箱内烘干。明胶提取率按照下式计算。

1.3.2 传统酸法鱼皮明胶提取工艺
鱼皮→室温解冻→去鳞去脂肪→剪碎脱脂、去杂蛋白→清洗→碱处理→水洗→酸处理、水洗→水浴提取→过滤、烘干→成品明胶
按1.3.1节方法对鱼皮进行前处理。碱处理:用NaOH溶液(0.8 g/100 mL)处理鱼皮1 h,料液比1∶6,碱处理完成后使用流动水冲洗鱼皮至中性。酸处理、水洗:按1∶6料液比,用体积分数2.2%的乙酸溶液处理鱼皮2 h后,流动水冲洗至pH 4.5左右。水浴提取:55 ℃下水浴摇床中提取6 h,料液比1∶6。按1.3.1节方法对提取液进行过滤烘干。
1.3.3 等电点测定
将明胶配制成pH 3~12质量浓度为1 g/100 mL的溶液,用HCl和NaOH溶液调节pH值,在660 nm波长处测定溶液透光率。明胶的等电点可以用溶液透光率最低时对应的pH值表示。
1.3.4 透射比测定
配制质量浓度为6.67 g/100 mL的明胶溶液,在450 nm和620 nm波长处测定透射比。
1.3.5 明胶样品的分子质量分布测定
通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)观察明胶样品的分子质量分布。在60 ℃水浴条件下,将干明胶溶解到蒸馏水中,使最终明胶溶液质量浓度为2 mg/mL。按照样品和上样缓冲液体积比3∶1添加还原性上样缓冲液,混匀后煮沸5 min,立即冷却上样,上样量为15 μL,Marker上样量10 μL。电泳分离胶和浓缩胶质量分数分别为6%和5%,初始电流设置为15 mA,当蓝色指示条带迁移至分离胶时将电流调至25 mA,待指示条带迁移凝胶底部即停止电泳。流动水下取出电泳凝胶,加入考马斯亮蓝R-250染色2 h后脱色至条带清晰,在凝胶成像仪中观察明胶分子质量分布并拍照记录。
1.3.6 凝冻强度测定
参考Chen Liqing等[18]的方法测定样品凝冻强度。在60 ℃水浴条件下,将干明胶溶解在蒸馏水中,使溶液最终质量浓度为6.67 g/100 mL。将明胶溶液转移至一次性胶冻杯中,于4 ℃条件下冷藏16~18 h后即可进行测量。选用探头TA 10,设置下压位移4 mm、测试速率1 mm/s,读数即为明胶的凝冻强度,单位为Bloom g。
1.3.7 流变学特性分析
1.3.7 .1 温度扫描
使用DHR-1流变仪对质量浓度为6.67 g/100 mL的明胶溶液进行温度扫描测试。夹具为40 mm的平板,间隙1 000 μm。设置温度范围5~40 ℃、温度变化速率1 ℃/min、频率1 Hz、应变5%,首先进行降温过程,然后进行升温过程。胶凝/融化温度用降温过程或升温过程中储能模量G’和损耗模量G”的交叉点温度表示。
1.3.7 .2 剪切黏度扫描
配制质量浓度为6.67 g/100 mL的明胶溶液,用DHR-1流变仪进行剪切黏度扫描,设置温度40 ℃、剪切速率变化范围0~100 s-1。
1.3.8 氨基酸组成测定
称取明胶粉末20 mg置于水解管中,加入10 mL浓度为6 mol/L的盐酸溶液,振荡混匀,抽真空密封,放入热风干燥箱内,110 ℃下沙浴水解24 h。水解完成后取出,冷却至室温,过滤到250 mL容量瓶中,加蒸馏水定容。取1 mL水解液,氮吹至溶剂完全蒸发,再加入1 mL柠檬酸钠缓冲液,振荡混匀后,过0.22 μm的滤膜,送入全自动氨基酸分析仪中测定各氨基酸含量。其中羟脯氨酸含量参照GB/T 9695.23—2008《肉与肉制品 羟脯氨酸含量测定》进行测定。
1.3.9 傅里叶变换红外光谱分析
将明胶粉末和溴化钾粉末按照质量比1∶400在玛瑙研钵中充分研磨,至混合粉末无颗粒感,于40 ℃热风干燥箱中烘干12 h后压成薄片,使用Spectrum 100傅里叶变换红外光谱仪在4 000~400 cm-1波数范围内以4 cm-1的分辨率扫描32 次[19]。
1.4 数据处理与统计分析
每组实验重复3 次,结果以平均值±标准差的形式表示,使用SPSS 19.0软件进行数据分析,通过Duncan检验分析各组数据的差异显著性(P<0.05),并使用Origin 9.5软件绘图。
2 结果与分析
2.1 鱼皮明胶的提取率
微波-快速冻融耦合提取法和传统酸法提取的鱼皮明胶提取率分别为13.68%和22.01%,本课题组以往的工作中针对相同原料采取传统酸法得到的鱼皮明胶提取率为22.15%[20]。微波-快速冻融耦合提取鱼皮明胶时,微波处理以及液氮冻融对鱼皮中共价键的破坏力不如酸碱处理的破坏力强,提取过程中酸、碱液处理时间也远比微波处理和液氮冻融时间长,这可能是造成微波-快速冻融耦合提取法提取率较低的原因。与传统酸法相比,微波-快速冻融耦合提取方法提取率较低,但不会产生大量废水,提取效率更高,在绿色提取方向有较好的应用前景。
2.2 鱼皮明胶的等电点
鱼皮明胶的等电点如图1所示。蛋白质是两性物质,当正负电荷数相等即净电荷为零时溶液的pH值为蛋白质的等电点。当溶液pH值处于等电点时,蛋白质分子间的静电排斥作用最弱,溶解度最低,所以明胶的等电点可以用溶液透光率最低时对应的pH值表示。通常,根据明胶化方式的不同,明胶分为A型明胶和B型明胶两种,A型明胶由酸法预处理后热提取得到,等电点为pH 6~9;B型明胶由碱法预处理后热提取得到,等电点为pH 5左右[21]。不同于A型和B型明胶,微波-快速冻融鱼皮明胶等电点为7.0。预处理方式的不同导致明胶等电点存在差异的原因可能是,碱处理可使谷氨酰胺脱氨为谷氨酸,天冬酰胺脱氨为天冬氨酸[22],使明胶等电点降低,而酸处理因保留了酰胺而使明胶带更多的正电荷。现有研究表明,在微波场作用下,微波的极化效应使蛋白质分子结构中的酰胺键发生松弛、断裂或重组[23],这可能与微波-快速冻融耦合鱼皮明胶的等电点低于传统酸法鱼皮明胶有关。
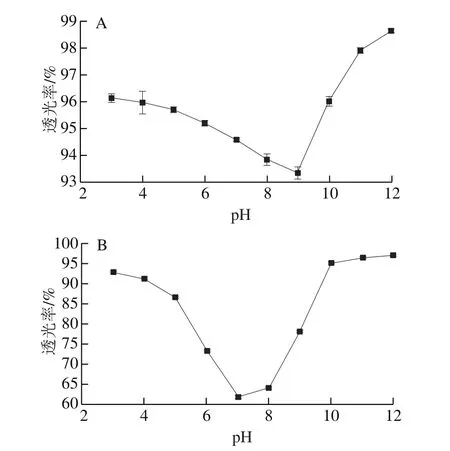
图1 传统酸法(A)和微波-快速冻融耦合(B)鱼皮明胶的等电点Fig.1 Isoelectric points of gelatins prepared by the traditional acid method (A) and the sequential microwave and rapid freezing-thawing method (B)
2.3 鱼皮明胶的透射比
鱼皮明胶透射比如表1所示。透射比越大,样品的透明度越高。GB 6783—2013《食品安全国家标准 食品添加剂 明胶》中规定,明胶的透射比应满足在450 nm波长处不低于30%;在620 nm波长处不低于50%。由表1可知,微波-快速冻融耦合提取的明胶满足GB 6783—2013要求。同时,无论是450 nm波长处还是620 nm波长处均显示微波-快速冻融耦合鱼皮明胶比传统酸法鱼皮明胶的透明度更低。两种明胶化方式出现透明度差异的原因可能是,使用传统酸法进行明胶化时鱼皮先经过碱处理后再进行酸处理,使胶原原料中影响明胶品质的有机物杂质溶出,在后续的水洗过程中随流动水除去[24],而微波-快速冻融耦合明胶化不使用酸和碱,也不经过水洗,明胶中可溶性杂质难以除去。为了解决这个问题,本实验中,采用多次多级过滤的方式,去除明胶中影响品质的可溶性有机物。即在微波-快速冻融耦合处理过程中,热提取后的明胶溶液先用中速滤纸过滤,再依次过0.45 μm和0.22 μm的滤膜,使透明度得到很大程度的提高,但仍低于传统酸法鱼皮明胶。

表1 鱼皮明胶透射比Table 1 Transmittance of fish skin gelatins
2.4 鱼皮明胶的分子质量分布
鱼皮明胶的分子质量分布如图2所示。明胶中高分子亚基主要是指分子质量超过100 kDa的组分,主要是γ、β、α亚基,其中γ组分为α亚基的三聚体,β组分为α亚基的二聚体,高分子亚基的存在是影响明胶凝胶强度的主要因素之一,高凝胶强度的明胶往往具有更多的高分子亚基。SDS-PAGE图清晰地展示出了两种明胶化方式亚基组成的差异。微波-快速冻融耦合鱼皮明胶的高分子亚基组分明显少于传统酸法鱼皮明胶,这可能会导致前者凝胶特性更低。
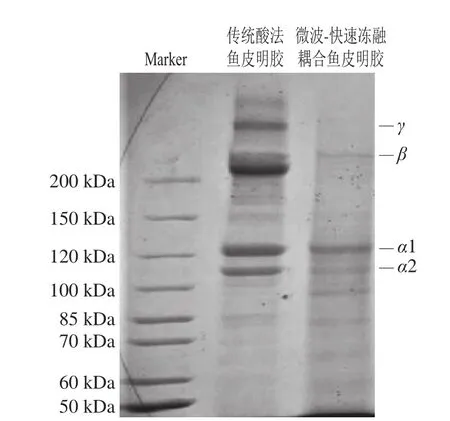
图2 鱼皮明胶的SDS-PAGE图Fig.2 SDS-PAGE patterns of fish skin gelatins
2.5 鱼皮明胶的凝冻强度
GB 6783—2013中规定,明胶的凝冻强度应不低于50 Bloom g。由图3可知,本研究所提取的明胶(传统酸法鱼皮明胶凝冻强度620.54 Bloom g、微波-快速冻融耦合鱼皮明胶凝冻强度524.40 Bloom g)均达到GB 6783—2013要求。传统酸法鱼皮明胶凝冻强度显著高于微波-快速冻融耦合鱼皮明胶(P<0.05)。
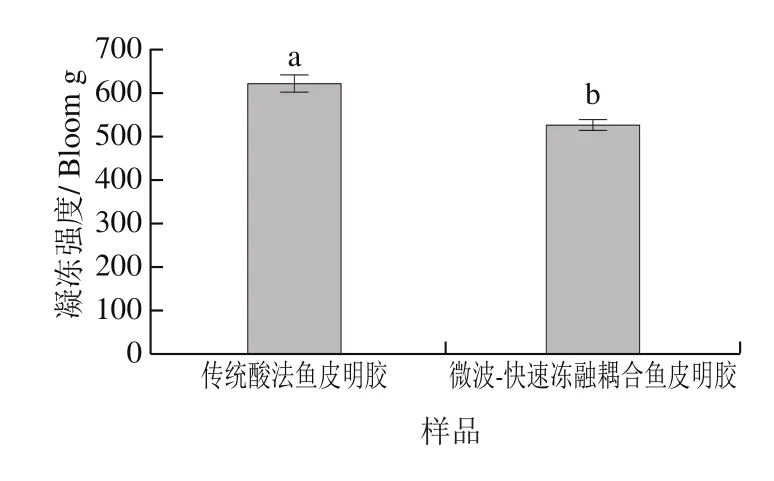
图3 鱼皮明胶的凝冻强度Fig.3 Gel strength of fish skin gelatins
明胶中高分子亚基和亚氨基酸含量是影响凝冻强度的两个主要因素。从2.4节明胶分子质量分布结果可知,传统酸法鱼皮明胶化的明胶中α、β、γ等高分子亚基组分更多,而微波-快速冻融耦合明胶化的明胶在提取过程中更容易降解,高分子亚基含量少,小分子组分含量高。这是微波-快速冻融耦合鱼皮明胶凝冻强度低于传统酸法鱼皮明胶的重要原因。
2.6 鱼皮明胶的流变学特性分析结果
2.6.1 温度扫描分析结果
评价温度对明胶黏弹性影响的指标包括G’、G”以及tanδ。G’为储能模量,其越大,样品体系内储存的能量越高,样品弹性越大;G”为损耗模量,其越大,样品由内部摩擦而损耗的能量越高,体系黏性越大[25];损耗角正切tanδ=G”/G’,是衡量体系黏弹性的指标,反映了高聚物的内耗性,tanδ越大意味着分子链段运动越难,内耗越多,体系偏向黏性;tanδ越小说明体系偏向弹性,固性增强。当tanδ>1时,体系中黏性占主导;当tanδ<1时,体系中弹性占主导[26];当tanδ=1时G”=G’,所对应的温度即为胶凝/融化温度,通常情况下,明胶的融化温度高于胶凝温度,这个现象是凝胶融化时吸收能量而导致的[27]。
由图4、5可知,初始降温过程中,所有明胶tanδ均大于1,G”>G’,表明降温的初始状态为黏性占主导的明胶溶液。当下降到一定温度时,G’和G”迅速上升,tanδ快速下降,说明此时体系弹性增加,固性增强,值得注意的是,G’开始迅速上升的温度低于G”,当温度降低到G’开始快速上升的温度时,tanδ到达最高值,温度继续下降到低于胶凝温度后,tanδ<1并继续减小,整个体系转化为以弹性为主的凝胶体系。升温过程中,所有明胶初始tanδ均小于1,接近0,G”<G’,表明升温的初始状态为弹性占主导的弹性凝胶体系。当上升到一定温度时,G’和G”迅速下降,tanδ快速上升,说明此时体系黏性增加,流动性增强。当温度升高超过凝胶熔化温度后,tanδ>1并继续增大,整个体系已经转化为黏性为主的溶液体系。同样地,由于G”趋于稳定时对应的温度高于G’趋于稳定时对应的温度,所以当G’刚开始稳定时,tanδ达到峰值,温度继续上升,tanδ逐渐下降,待温度上升至G”稳定后,tanδ也趋于平稳,最终均大于1,说明体系最终以黏性为主。
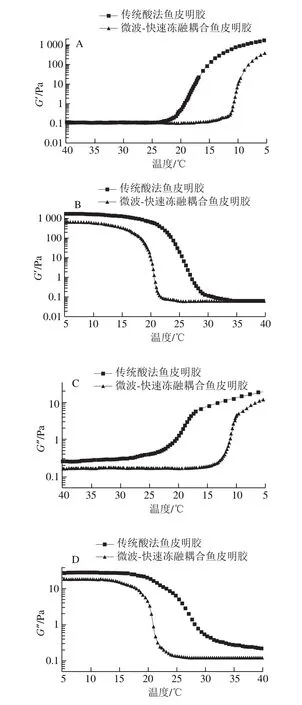
图4 鱼皮明胶的储能模量(G’)和损耗模量(G”)Fig.4 Elastic modulus (G’) and loss modulus (G”) of fish skin gelatins
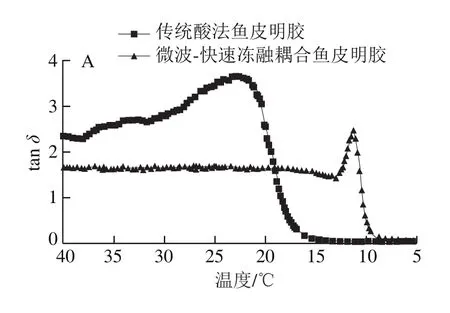
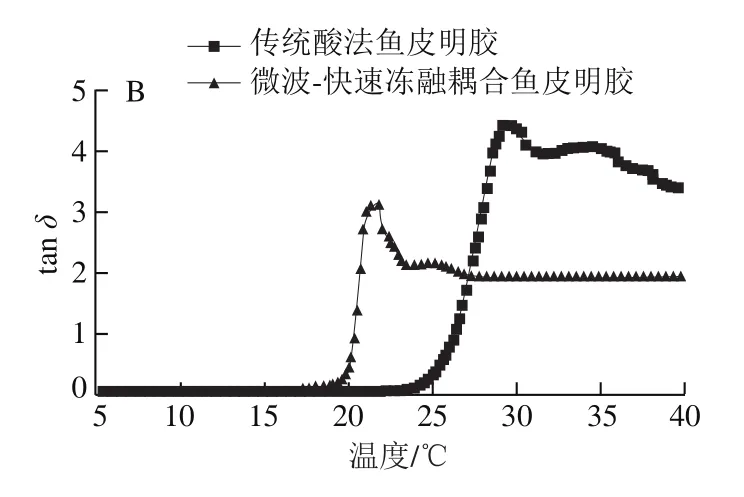
图5 鱼皮明胶的损耗角正切(tan δ)Fig.5 Loss tangent (tan δ) of fish skin gelatins
在温度扫描过程中,微波-快速冻融耦合鱼皮明胶的储能模量G’和损耗模量G”均低于传统酸法鱼皮明胶。由图6可知,温度降低时,传统酸法鱼皮明胶、微波-快速冻融耦合鱼皮明胶由溶液体系转化为凝胶体系(tanδ=1)的温度依次为18.44 ℃和10.30 ℃;温度升高时,明胶由凝胶体系转化为溶液体系的温度(tanδ=1)分别为20.64 ℃(微波-快速冻融耦合鱼皮明胶)和25.56 ℃(传统酸法鱼皮明胶)。上述结果表明传统酸法鱼皮明胶体系中储存的能量更大,网络结构更稳固,类三螺旋含量更高[28],微波-快速冻融耦合法明胶更易融化。在此基础上,本研究做了进一步的溶解实验,结果表明,微波-快速冻融耦合明胶化所制明胶在冷水中轻轻摇晃约10 min即可溶解,对于明胶应用的拓展具有一定的意义。市场上,明胶为粉末状时被称为吉利丁粉,为片状时又被称为吉利丁片,常用于制作慕斯、果冻和奶酪等各种需在低温下保存的甜点。在使用吉利丁粉或吉利丁片时需先用冷水浸泡后加热才能将其融化[29],而微波-快速冻融耦合明胶化制备的明胶省略了加热的步骤,可直接在冷水中溶解后混入慕斯浆,与打发的奶油混合均匀后即可冷藏,为甜品制作提供了方便。

图6 鱼皮明胶的胶凝/融化温度Fig.6 Gelling and melting temperatures of fish skin gelatins
2.6.2 剪切黏度扫描分析结果
鱼皮明胶的剪切黏度扫描分析结果如图7所示。在剪切速率从0 s-1增大到100 s-1的过程中,原本在溶液中相互缠结碰撞的明胶分子随着剪切应力的增加而发生解缠,黏度下降,直至解缠速率等于缠结速率时,明胶溶液的黏度不再发生变化,表现为假塑性流体。微波-快速冻融耦合鱼皮明胶黏度低于传统酸法鱼皮明胶。通常流体中高分子成分越多,越容易在流动时产生分子链间的缠结,从宏观上看表现为黏度上升。这说明微波-快速冻融耦合鱼皮明胶溶液中分子链更短,链间的缠结更少,因而黏度更低,流动性更好。
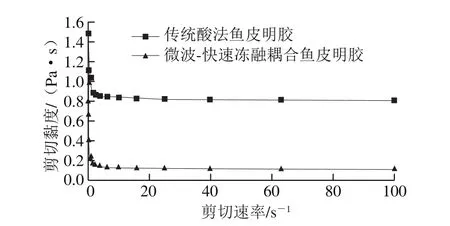
图7 鱼皮明胶的剪切黏度扫描Fig.7 Viscosity versus shear rate curves of fish skin gelatins
2.7 鱼皮明胶的氨基酸组成分析结果
鱼皮明胶的氨基酸组成分布如表2所示。胶原蛋白中重复着Gly-X-Y序列[30],其中X和Y位置分别被脯氨酸(Pro)和羟脯氨酸(Hyp)占据,由胶原部分水解得到的明胶也保持着这样的氨基酸组成和排列方式。在胶原蛋白的氨基酸组成中,甘氨酸(Gly)含量最高,约占全部氨基酸残基含量的1/3,由表2可知,Gly是两种明胶中含量最高的氨基酸,传统酸法鱼皮明胶、微波-快速冻融耦合鱼皮明胶的甘氨酸含量分别为238、241 g/kg,彼此间相差不明显。Pro和Hyp又称为亚氨基酸,富含Pro和Hyp的区域可能参与成核区的形成,亚氨基酸的吡咯环对三螺旋结构的稳定性具有重要作用,在宏观上表现为影响明胶的凝胶强度等凝胶性能。由表2可知,两种明胶的亚氨基酸含量仅次于甘氨酸,传统酸法鱼皮明胶和微波-快速冻融耦合鱼皮明胶的亚氨基酸含量分别为194、182 g/kg,两种明胶其余的氨基酸含量同样没有太大差别。可以看出,两种明胶制备方式均不会影响亚氨基酸所占比例,也不会因此而影响明胶性质。综上,因提取方法不同而产生的明胶性质差异与氨基酸组成基本无关。
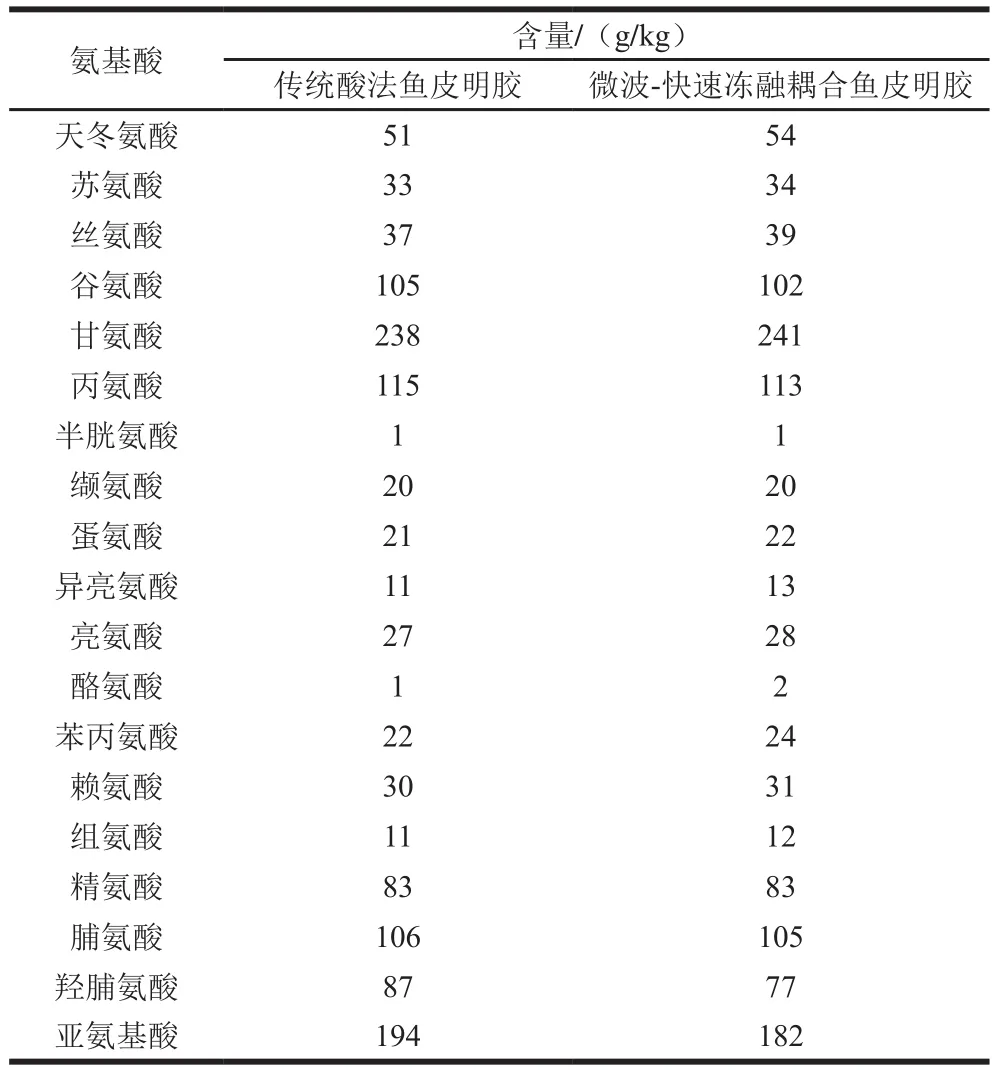
表2 鱼皮明胶氨基酸组成Table 2 Amino acid compositions of fish skin gelatins
2.8 鱼皮明胶的傅里叶变换红外光谱分析结果
鱼皮明胶的傅里叶变换红外光谱结果如图8所示。其特征谱带信息如表3所示。酰胺A带代表N—H基团的伸缩振动,当其向低波数移动时,表明N—H基团参与的氢键含量增加[31]。由表3可知,微波-快速冻融鱼皮明胶中,酰胺A带波数为3 444.79 cm-1,低于传统酸法明胶(3 466.37 cm-1)。这表明微波-快速冻融明胶中N—H参与形成的氢键含量更高,而传统酸法鱼皮明胶使明胶分子内部氢键破坏更为严重。通常使用酰胺III带的吸收峰强度与1 454 cm-1波数处的吸收峰强度的比值(AamideIII/A1454cm-1)衡量胶原蛋白三螺旋的完整性。由于明胶是胶原蛋白的部分水解产物,故其AamideIII/A1454cm-1都要小于1,AamideIII/A1454cm-1越接近1,表明三螺旋结构保留越完整[32],传统酸法鱼皮明胶AamideIII/A1454cm-1为0.75,微波-快速冻融耦合鱼皮明胶AamideIII/A1454cm-1为0.72,说明两种明胶三螺旋结构都相对完整,但微波-快速冻融耦合鱼皮明胶的三螺旋结构保留更少,与2.6.1节中水溶性实验结果相印证。

表3 鱼皮明胶傅里叶变换红外光谱图的特征谱带信息Table 3 FTIR spectra major band information of fish skin gelatins
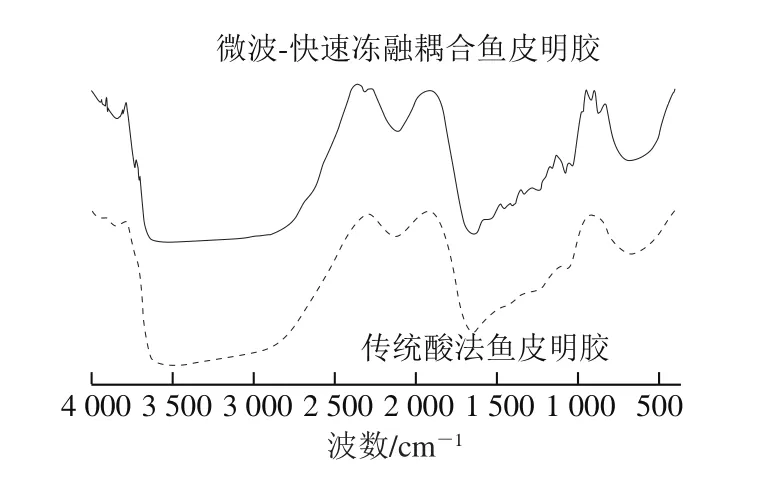
图8 鱼皮明胶的傅里叶变换红外光谱图Fig.8 FTIR spectra of fish skin gelatins
结合2.5节凝冻强度和2.6.1节温度扫描结果来看,尽管微波-快速冻融耦合鱼皮明胶的氢键较多,但其高分子亚基的含量明显低于传统酸法鱼皮明胶,因此,微波-快速冻融耦合鱼皮明胶的凝冻强度和G’、G”均较低。
3 结 论
本研究结果表明,微波-快速冻融耦合鱼皮明胶等电点为7,凝冻强度为524.40 Bloom g,透明度较好,以上指标均符合GB 6783—2013要求。微波-快速冻融耦合鱼皮明胶的模量(储能模量G’和损耗模量G”)、胶凝/融化温度和黏度均低于传统酸法鱼皮明胶。微波-快速冻融耦合鱼皮明胶比传统酸法鱼皮明胶中氢键含量更高,但由于高分子亚基含量低,故凝胶性能低于传统酸法鱼皮明胶。微波-快速冻融耦合鱼皮明胶与传统酸法鱼皮明胶氨基酸组成相似,说明两种明胶制备方式不影响明胶的氨基酸组成。微波-快速冻融耦合提取鱼皮明胶的方式不涉及到大量酸、碱的使用,对环境绿色友好,且得到的明胶具有较好的性质,其较低的胶凝/融化温度可实现冷水搅拌融化,省略了加热步骤,为实际生产提供了方便。

