油茶籽油不同形态酚类化合物的抗氧化互作关系
刘国艳,李思童,梁 丽,朱雯绮,周婉丽,徐 鑫
(扬州大学食品科学与工程学院,江苏 扬州 225009)
油茶籽油被誉为“东方橄榄油”与“食用油之王”,含有多种脂质伴随物,其中酚类化合物具有较强的抗氧化能力,是油茶籽油重要的活性成分[1-2]。天然存在的酚类化合物根据其与基质中其他物质结合与否分为游离酚(free phenolics,FP)与结合酚(bound phenolics,BP),而结合酚又因其结合对象或价键不同分为酯化酚(esterified phenolics,EP)及不溶性结合酚(insoluble-bound phenolics,ISP),其中EP又称为可溶性结合酚[3-4]。研究表明,酚类化合物的形态与其抗氧化活性相关,然而这些研究大多集中于果蔬及谷物,在油脂体系中研究较少[5-6]。Wang Yukun等[7]研究发现豆类BP的抗氧化能力强于FP,但不同种类大豆中ISP与EP的物质组成不同导致其抗氧化能力存在差异;裘芳成等[8]研究发现山茶油中糖苷态酚类化合物抗氧化能力最强,其次为ISP、EP及FP;Thiyam等[9]研究表明油菜籽中芥子酸及FP表现出较强的抗氧化作用,BP与总酚则因芥子碱的存在表现出一定的促氧化作用;Alu'datt等[10]利用亚油酸氧化法研究橄榄油中酚类化合物的抗氧化活性,结果表明相较于BP,FP抗氧化活性更强。现有研究发现,不同原料中酚类化合物形态与抗氧化活性相关性不一致,因此有必要对油茶籽油中不同形态酚类化合物的抗氧化能力进行研究。
油脂的氧化稳定性是多种天然抗氧化成分共同作用的结果,而抗氧化成分之间常存在相加、协同及拮抗等互作关系[11]。油茶籽油中发挥重要抗氧化作用的酚类化合物种类多样,如Wang Xiaoqin等[12]在油茶籽油中鉴定出24 种酚类化合物,其间存在的抗氧化互作关系错综复杂,因此基于酚类化合物单体研究其互作关系难度较大。故本实验对油茶籽油酚类化合物进行形态区分,在不同形态下对其抗氧化互作关系进行初步研究。
本实验以油茶籽油为研究对象,分析其中FP、EP及ISP的含量及主要物质组成,并测定铁离子还原能力(ferric ion reducing antioxidant power,FRAP)、2,2'-联氮双(3-乙基苯并噻唑啉-6-磺酸)(2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonicacid),ABTS)阳离子自由基清除能力、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力及β-胡萝卜素漂白能力,对比不同形态酚类化合物单独作用及混合作用下的抗氧化效果,初步探究其互作关系类型,为阐明脂质伴随物中酚类物质的抗氧化机理提供参考。
1 材料与方法
1.1 材料与试剂
长林系列油茶籽 采购于江西。
甲醇、无水碳酸钠、氢氧化钠、乙酸乙酯、福林酚、过硫酸钾、氯化铁、氯仿、吐温20、醋酸钠、冰乙酸、DPPH、ABTS、2,3,5-三苯基氯化四氮唑(2,3,5-triphenyltetrazolium chloride,TPTZ)、β-胡萝卜素、亚油酸 国药集团化学试剂有限公司;没食子酸阿拉丁试剂有限公司;乙腈、超纯水 默克化工技术有限公司;甲酸 上海安谱实验科技股份有限公司;2-氯苯丙氨酸 吉尔生化有限公司。
1.2 仪器与设备
PHG-9070电热恒温鼓风干燥箱 上海精宏试验设备有限公司;DF-15连续投料粉碎机 温岭市林大机械有限公司;QYZ-230型自动液压榨油机 山东省泰安市良君益友机械有限公司;SHJ-A6数显恒温搅拌水浴锅上海比朗仪器有限公司;SHB-III真空泵 郑州长城科工贸有限公司;RV-10 basic旋转蒸发仪 德国IKA公司;UV1000紫外分光光度计 上海天美科学仪器有限公司;Acquity UPLC-I级超高效液相色谱仪、Vevo G2-S质谱仪 美国Waters公司。
1.3 方法
1.3.1 油茶籽油的制备
采用冷榨法制备油茶籽油。油茶籽脱壳,于60 ℃烘干后粉碎,用榨油布包裹放于榨油机中常温加压压榨,压力40~60 MPa,收集油茶籽油,用纱布过滤除去不溶性杂质,得到油茶籽油。
1.3.2 油茶籽油不同形态酚类化合物的提取
油茶籽油不同形态酚类化合物提取工艺参考Ayouba[13]、Kang[14]等的方法并优化后得到。
FP、EP提取及FP提取液制备:称取5 g油茶籽油按照料液比1∶15(m/V)加入体积分数60%甲醇溶液,45 ℃下提取1.5 h后离心,取甲醇层(上层),重复提取3 次,合并甲醇层;收集油相(下层)进行ISP提取。于40 ℃下将合并的甲醇层真空浓缩至20 mL后用正己烷萃取除去残余油相,水相按照1∶1体积比添加乙酸乙酯重复萃取3 次,合并乙酸乙酯层于40 ℃下真空蒸干得到FP,使用5 mL无水甲醇溶解以获得FP甲醇提取液;乙酸乙酯萃取后的水相用于EP甲醇提取液制备。
EP甲醇提取液制备:向上述乙酸乙酯萃取后的水相按照1∶3体积比加入0.25 mol/L NaOH溶液,于45 ℃下避光碱解6 h,所得碱解液调节pH值至2后适量浓缩至20 mL,再用正己烷萃取除去残余油相,水相按照体积比1∶1加入乙酸乙酯重复萃取3 次,合并乙酸乙酯层于40 ℃下真空蒸干,使用5 mL无水甲醇溶解以获得EP甲醇提取液。
ISP提取及其甲醇提取液制备:向提取FP后的油相中按照料液比1∶3(m/V)加入0.25 mol/L NaOH溶液,于45 ℃下避光碱解6 h后调节pH值至2,分离油相和水相,收集水相(下层),并用正己烷萃取除去残余油相,再按照体积比1∶1加入乙酸乙酯重复萃取3 次,合并乙酸乙酯层于40 ℃下真空蒸干,使用5 mL无水甲醇溶解以获得ISP甲醇提取液。
FP、EP、ISP甲醇提取液用于后续指标测定。
1.3.3 酚类化合物含量及纯度测定
采用Folin-Ciocalteu法[15]。以没食子酸为标准品绘制标准曲线:y=0.012 1x-0.000 6,R2=0.999;其中y为吸光度,x为酚类化合物质量浓度/(mg/mL)。
不同形态酚类化合物的纯度测定参考文献[16]。
1.3.4 油茶籽油不同形态酚类化合物的组成分析
参考文献[16],使用超高效液相串联二级质谱法对油茶籽油不同形态酚类化合物进行分析鉴定。
色谱条件:色谱柱:ACQUITY UPLC HSS T3 C18柱(2.1 mm×100 mm,1.8 μm);流动相:A为0.05%(体积分数,后同)甲酸溶液,B为乙腈。梯度洗脱:0.0~1.0 min,95% A;1.0~12.0 min,95% A~5% A;12.0~13.5 min,5% A;13.5~13.6 min,5% A~95% A;13.6~16.0 min,95% A。柱温:40 ℃;流速:0.3 mL/min;进样量:3 μL;自动进样器温度:4 ℃。
质谱条件:加热器温度300 °C;鞘气流速:45 arb;辅助气流速:15 arb;尾气流速:1 arb;电喷雾离子源(electrospray ionization,ESI)电压:3.0 kV(ESI+)及3.2 kV(ESI-);毛细管温度:350 ℃;S-Lens RF Level:30%(ESI+)及60%(ESI-)。扫描模式:一级全扫描,离子扫描范围70~1050m/z;数据依赖性二级质谱扫描(dd-MS2, TopN=10);一级质谱与二级质谱分辨率分别为70 000与17 500。碰撞模式:高能量碰撞解离。
1.3.5 油茶籽油不同形态酚类化合物的抗氧化能力测定
分别测定1.3.2节提取所得不同形态酚类化合物甲醇提取液的FRAP、ABTS阳离子自由基清除能力、DPPH自由基清除能力及β-胡萝卜素漂白能力,并计算其半数抑制质量浓度(half-maximal inhibitory concentration,IC50),单位为mg/mL。
FRAP测定:参考王俐娟[17]的方法并加以修改。FRAP试剂配制:将300 mmol/L pH 3.6醋酸缓冲液、20 mmol/L FeCl3、10 mmol/L TPTZ(溶剂为4 mmol/L HCl)按体积比10∶1∶1混合。取上述FRAP试剂2.7 mL与0.3 mL不同质量浓度梯度样品混合均匀,室温下反应8 min后,于593 nm波长处测定吸光度A,用甲醇替代样品按照相同方法测定吸光度A0,FRAP按式(1)计算。

ABTS阳离子自由基清除能力测定:参考文献[17]。
DPPH自由基清除能力测定:参考文献[18]。
β-胡萝卜素漂白能力测定:参考文献[10]。
1.3.6 油茶籽油不同形态酚类化合物的抗氧化互作关系分析
以1.3.2节提取所得FP、EP、ISP甲醇提取液为对象,将其两两或3 种形态酚复配(复配比(质量浓度比)为1∶1或1∶1∶1),测定其不同质量浓度下的抗氧化能力,计算IC50实验值,两两复配分别按照公式(2)、(3)计算复配的IC50理论值及相互作用指数(γ)[19],3 种形态酚复配分别按照公式(4)、(5)计算复配的IC50理论值及γ。采用t检验对IC50实验值与IC50理论值进行统计比较,IC50实验值<IC50理论值,即为协同作用。γ评价协同作用及拮抗作用的程度,γ=1表示为相加作用;γ<1表示为协同作用,γ值越小表明协同作用越强;γ>1表示为拮抗作用。

式中,IC50实验值是根据酚类化合物在不同质量浓度下的抗氧化能力绘制标准曲线后计算得到,IC50A、IC50B及IC50C为FP、EP和ISP单独作用时的IC50实验值;IC50Amix、IC50Bmix及IC50Cmix为复配组中FP、EP和ISP的IC50实验值,即复配组实验下得到IC50实验值与酚类化合物在复配组中所占比例的乘积(两两复配与3 种形态复配样中酚类化合物在复配组中所占比例分别为1/2与1/3)。
1.4 数据处理与分析
实验中所有数据均为3 次重复实验的平均值,实验所得结果采用平均值±标准偏差表示。采用Origin软件绘图,采用Excel 2016、SPSS 23.0软件对数据进行分析,通过单因素方差分析Student-Newman-Keuls检验进行多重比较(P<0.05)。
2 结果与分析
2.1 油茶籽油中不同形态酚类化合物的含量及主要物质组成
对油茶籽油FP、EP及ISP进行提取,有机溶剂可直接提取的为可溶性酚类化合物(FP及EP),含水有机溶剂会破坏酚类化合物分子间的氢键,有利于酚类化合物的溶出,故采用体积分数60%甲醇溶液对可溶性酚类化合物(FP及EP)进行提取[18,20]。另外,而ISP的释放则需要经过酸解或碱解,相较于酸解的高温条件,碱解条件下酚类化合物损失较小,并且碱解会破坏酯键更有利于释放出与酯类化合物结合的酚类化合物,故采用碱解方式对ISP进行提取[21-22]。油茶籽油不同形态酚类化合物的含量及纯度如图1所示。油茶籽油总酚含量为(137.97±5.14)mg/kg,其中油茶籽油中ISP含量显著高于FP及EP(P<0.05),约为总酚含量的47.74%;EP含量最低,约为总酚含量的20.78%。ISP的纯度显著低于其他两种形态的酚类化合物(P<0.05),EP纯度最高。

图1 油茶籽油中不同形态酚类化合物的含量及其在提取物中的纯度Fig.1 Contents of different forms of phenolic compounds in camellia seed oil and purities of phenolic compounds extracted from the oil
表1列出了超高效液相串联二级质谱法鉴定所得主要存在于油茶籽油中的12 种酚类化合物,由此可知,不同形态酚类化合物的主要物质组成仅在含量上存在差异。油茶籽油酚类化合物主要以酚酸衍生物存在,约占总酚的82%左右,其余为类黄酮。FP中含量较高为苯甲酸衍生物(主要为异香兰素及甲基香兰素),类黄酮中则主要为橙皮苷;EP则以水杨酸含量最高,约占总EP的62%;ISP中3,4-二羟基扁桃酸含量最高,约占总ISP的53%,其次为熊果酸甲酯(约15%)。

表1 油茶籽油中不同形态酚类化合物的主要物质组成Table 1 Major components of phenolic compounds in different forms extracted from camellia seed oil
2.2 油茶籽油不同形态酚类化合物的抗氧化能力及其互作关系
2.2.1 油茶籽油不同形态酚类化合物的抗氧化能力
FRAP及ABTS阳离子自由基清除能力均基于单电子转移(single electron transfer,SET)机制,酚类化合物给出电子将氧自由基转化为阴离子,达到抗氧化作用[14,23]。如图2A~B所示,各样品均具有一定的电子转移能力及自由基清除能力,且与质量浓度呈正相关。油茶籽油酚类化合物的FRAP及ABTS阳离子自由基清除能力排序分别为:FP>EP>ISP、ISP>FP>EP。SET机制下物质的抗氧化能力取决于其活性基团的电离势,不同形态酚类化合物的电离势存在差异,从而导致酚类化合物抗氧化能力存在差异[18,24]。
DPPH自由基清除能力基于氢原子转移(hydrogen atom transfer,HAT)机制及SET机制结合作用,酚类化合物给出氢原子或电子与氧自由基结合以清除自由基[25-26]。如图2C所示,酚类化合物的DPPH自由基清除能力与其质量浓度呈正相关,不同形态酚类化合物DPPH自由基清除能力由高到低排序为:EP>ISP>FP。可能是由于碱解破坏了EP的酯键,释放出与基质相结合的酚类化合物,暴露的羟基更容易与自由基结合。Wang Yukun[7]、王俐娟[17]等研究表明大豆及茶叶籽油中BP的DPPH自由基清除能力强于FP,Kaisoon[27]、Chandrasekara[28]等发现可食用花卉及谷物中ISP的DPPH自由基清除能力显著低于EP(P<0.05),与本研究结果相似。
β-胡萝卜素漂白法通过测定亚油酸氧化程度反映待测物抗氧化活性,因此适于评价油脂提取物[29]。如图2D所示,油茶籽油不同形态酚类化合物均具有抑制脂质氧化的能力,且与其质量浓度相关,其根据表2中β-胡萝卜素漂白能力实验中的IC50实验值比较β-胡萝卜素漂白能力,不同形态酚类化合物的β-胡萝卜素漂白能力由高到低排序为:EP>ISP>FP,与DPPH自由基清除能力趋势相同。但Alu'datt等[10]研究发现,橄榄油中FP的β-胡萝卜素漂白能力高于BP,与本研究结果不一致。可能是橄榄油和油茶籽油中酚类化合物组成也有所区别,因而其活性基团组成及排列不同,影响其抗氧化活性,导致其研究结果存在一定差异[17,20]。

图2 不同形态酚类化合物的抗氧化能力Fig.2 Antioxidant activity of extracted phenolic compounds in different forms at different concentrations

2.2.2 油茶籽油不同形态酚类化合物的抗氧化互作关系
分析FP、EP及ISP复配后在不同评价方法下的IC50及其相互作用指数,其抗氧化互作关系如表2所示。FP+ISP组合及EP+ISP组合在不同抗氧化机制下均表现出一定的相加或协同作用,且后者的抗氧化活性更强,可能是由于两种组合中的强抗氧化剂相互再生或弱抗氧化剂再生强抗氧化剂,提高了整体的抗氧化强度从而表现出相加或协同效应[11,17]。另一方面,FP+EP组合在ABTS阳离子自由基清除能力及β-胡萝卜素漂白能力测定方法下,FP+EP+ISP组合在DPPH自由基清除能力及β-胡萝卜素漂白能力测定方法下均表现出明显的拮抗作用,可能是由于体系中强抗氧化剂也可再生弱抗氧化剂,使整体抗氧化活性降低,产生拮抗效应[11,30]。FP+EP组合在FRAP及DPPH自由基清除能力测定方法下,FP+EP+ISP组合在FRAP及ABTS阳离子自由基清除能力测定方法下均表现出相加作用。有研究发现,酚类化合物的还原电位越低,其给电子能力越强,与过氧自由基结合能力就越强,因此含较高质量浓度低还原电位物质的组合表现出较强的抗氧化作用[11,23]。此外,油脂中不同形态酚类化合物的物质组成及含量均有区别,其所包含的活性基团存在差异,影响了酚类化合物的氢原子及电子转移能力,导致复配组合在不同机制下表现出不同的抗氧化互作关系[5,20]。如,ISP中含量较高的3,4-二羟基扁桃酸、熊果酸甲酯及高车前素分子中,苯邻位、间位羟基与基质结合形成分子间氢键,并降低其酚羟基及碳碳双键的解离能及电离势,发挥出更强的抗氧化能力,因此含ISP的两两复配组合主要呈协同作用。
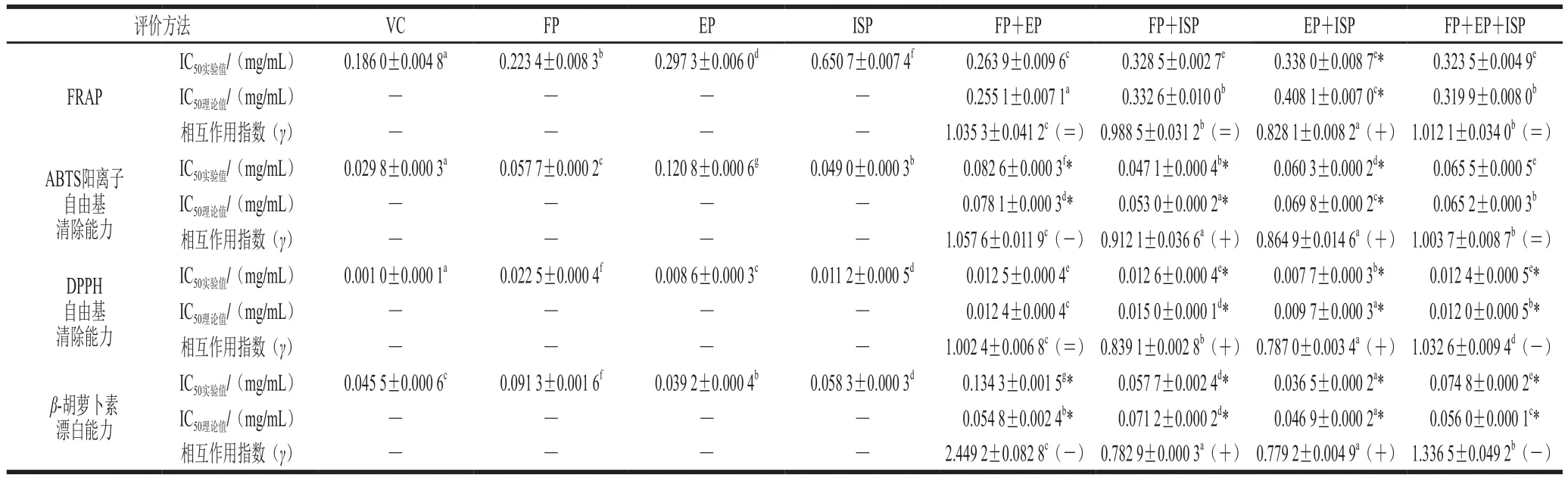
表2 不同形态酚类化合物的抗氧化能力Table 2 Antioxidant interaction of phenolic compounds in different forms
油脂自动氧化过程中,氢过氧化物分解形成大量自由基,抗氧化剂提供氢原子与氧自由基结合形成非自由基产物或更稳定的抗氧化剂自由基,终止自由基链式反应以达到延缓脂质氧化的作用,这一机理与酚类化合物在HAT机制下清除DPPH自由基相似。另外,在SET机制中发现酚类化合物具有较强的电子转移能力,表明其具有较低的还原电位及在链式反应中将氢原子提供给过氧自由基的能力[31]。由此可以推断酚类化合物可增强油脂稳定性,且EP+ISP组合可能发挥明显的协同作用。
3 结 论
本研究以油茶籽油为原料,分析其中FP、EP及ISP的含量及其主要物质组成,结果表明,油茶籽油FP、EP及ISP含量分别为(43.43±2.05)、(28.67±1.51)mg/kg及(65.87±1.34)mg/kg,其中ISP含量显著高于FP及EP(P<0.05),为油茶籽油总酚的47.74%,而EP含量最低,约为总酚含量的20.78%。另外,FP中以苯甲酸衍生物含量较高(主要为异香兰素及甲基香兰素),EP中主要为水杨酸,ISP中主要为3,4-二羟基扁桃酸。通过测定DPPH自由基清除能力、ABTS阳离子自由基清除能力、FRAP及β-胡萝卜素漂白能力,对油茶籽油中不同形态酚类化合物的抗氧化活性及其互作关系进行研究。结果表明,不同形态酚类化合物在不同机制下的抗氧化能力存在差异。不同形态酚类化合物的抗氧化互作关系结果显示,FP+ISP组合及EP+ISP组合在不同抗氧化机制下均表现出一定的协同或相加作用,且后者的抗氧化活性更强;而FP+EP组合及FP+EP+ISP组合则表现出拮抗或相加作用。本研究揭示了油茶籽油中3 种形态酚类化合物的互作关系,有助于阐明脂质伴随物的抗氧化机理,同时为具有协同增效作用酚类化合物的应用提供理论依据。

