热处理对采后琯溪蜜柚果实汁胞粒化的影响及其与细胞壁代谢的关系
张 珅,张翼翔,叶 洪,聂 珂,吴光斌,倪 辉,3,,张宗成,陈发河,
(1.集美大学食品与生物工程学院,福建 厦门 361021;2.福州海关,福建 福州 350001;3.福建省食品微生物与酶工程重点实验室,福建 厦门 361021;4.漳州平和东湖农产品有限公司,福建 漳州 363705)
琯溪蜜柚(Citrus grandis (L.) Osbeck cv.Guanximiyou)是原产于福建省平和县的名优亚热带水果,是国家地理标志保护产品。琯溪蜜柚种植加工是平和县农业支柱产业,近年来已推广至广西、广东、浙江等柑橘主产区,成为当地果农新的收入增长点[1-2]。琯溪蜜柚外观饱满鲜亮、皮薄瓤厚、果肉甘甜多汁,具有祛痰润肺、降火利尿等功效,深受消费者喜爱。琯溪蜜柚消费以鲜食为主,鲜果主产期为9月至11月,因其较耐贮藏,销售期可延至次年春节后,素有“天然水果罐头”之称。然而,琯溪蜜柚果实在成熟后期和采后贮藏期间极易发生以汁胞粒化为主的生理性病害,尤以树龄老、晚熟或留树期较长的果实为甚[3-4]。汁胞粒化的主要表现为汁胞异常膨大、硬化、汁少味淡,导致果实食用品质下降,商品价值丧失,常给果农和经销商造成很大的经济损失[5]。因此,研究琯溪蜜柚果实汁胞粒化的控制技术,对果农增收和蜜柚产业发展具有重要意义。
目前,针对柚类果实汁胞粒化的研究多聚焦于果实生长过程中的粒化机理和调控技术[4,6-7],关于采后粒化机制和控制的报道较少。研究认为,采后琯溪蜜柚果实汁胞粒化过程中细胞壁增厚,该现象与次生壁木质素累积以及细胞壁多糖代谢活动导致的细胞壁组分变化有关[3,5,8]。木质素是植物细胞主要结构性物质之一,木质素大量合成与积累导致的木质化是采后果实衰老的重要表现[9-10]。纤维素、半纤维素和果胶是细胞壁中主要的多糖类物质,对果实质构特性起关键作用,在采后果实中易在细胞壁多糖降解酶作用下发生解聚和转化,导致细胞壁结构变化,影响果实质地[11]。因此,通过适当的采后处理延缓琯溪蜜柚果实汁胞细胞壁组分的变化,有助于控制果实汁胞粒化,维持商品价值。采后水杨酸处理[12]、钙处理[13]、涂膜[14]、真空预冷结合臭氧处理[15]等技术可在不同程度上延缓柚类果实贮藏期间的汁胞粒化。但是,琯溪蜜柚果实体积大,采用化学方法处理,存在保鲜剂消耗量大、成本高、易造成环境污染等问题,并且受产地条件限制,在推广应用方面存在不足。因此,探究安全有效、便于生产操作且低成本的采后保鲜处理技术及其作用机制,依然是采后琯溪蜜柚果实汁胞粒化控制研究的重点。
热处理是常见的采后物理处理技术,对多种水果具有良好的保鲜效果,具有可循环利用、无化学药剂残留、无污染、操作方便等优点。采用35~55 ℃左右的热水、热空气、热蒸汽等方式进行贮藏前预处理,不仅能够杀灭或清除果实表面附着的病原菌和寄生虫(卵),改变果皮表面蜡质结构和组织通透性,减少果实贮藏期间的病害和失水,还能诱导果实细胞内细胞壁物质代谢相关酶活性发生变化,从而减缓果实衰老和腐烂,延长贮藏期和货架期[16-19]。采用38 ℃热空气处理枇杷果实,能有效抑制冷藏期间果肉苯丙氨酸解氨酶(phenylalanine ammonia-lyase,PAL)和过氧化物酶(peroxidase,POD)活性,维持多聚半乳糖醛酸酶(polygalacturonase,PG)活性,减少原果胶和木质素积累,延缓果实硬度升高和出汁率下降,使果实保持较好的食用品质[20]。经50 ℃热水处理的葡萄柚果实,果肉中共价结合态果胶(covalently bound pectin,CBP)和半纤维素含量能得到较好的维持,离子结合态果胶(ion-soluble pectin,ISP)和水溶性果胶(water-soluble pectin,WSP)含量相对较低,从而延缓了果实软化和质量损失[21]。但是,目前有关热处理影响采后琯溪蜜柚品质的研究鲜见报道,也鲜有研究涉及热处理对琯溪蜜柚汁胞粒化潜在的控制作用及其生理机制。
因此,本研究对采后琯溪蜜柚果实进行不同温度热处理,探究热处理对其贮藏过程中品质变化的影响,并进一步研究较优处理温度下琯溪蜜柚汁胞木质素合成和细胞壁多糖降解的响应机制,以期筛选出适宜的热处理条件,并阐明热处理对采后琯溪蜜柚汁胞粒化的影响及其与细胞壁物质代谢的关系,为控制琯溪蜜柚果实汁胞粒化劣变提供理论依据和技术参考。
1 材料与方法
1.1 材料与试剂
琯溪蜜柚(Citrus grandis (L.) Osbeck cv.Guanximiyou)果实采收自漳州平和县坂仔镇,选取树龄15 年左右,大小、形状、成熟度一致,无病虫害和机械伤的果实为原料,于采收当天运至集美大学食品与生物工程学院实验室。
氢氧化钠、苯丙氨酸、反式肉桂酸和愈创木酚国药集团化学试剂有限公司;咔唑、蒽酮、葡萄糖、半乳糖醛酸、对硝基苯酚和牛血清白蛋白 阿拉丁(上海)试剂有限公司;其余试剂均为分析纯。
1.2 仪器与设备
LE204E托盘电子分析天平 瑞士Mettler Toledo公司;高速冷冻离心机 德国Eppendorf公司;SYG-1220数显恒温水浴锅 美国精骐有限公司;RIOS 8超纯水系统美国Millipore公司;KQ数控超声波清洗机 昆山市超声波仪器有限公司;PSX-330H智能恒温恒湿箱 宁波莱福科技有限公司;DW-86L388J-80 ℃超低温冰箱 青岛海尔特种电器有限公司;DZF-Z36电加热蒸汽加热器张家港市威孚热能科技有限公司;T6新世纪紫外-可见分光光度计 北京普析通用仪器有限公司;WYT-4型手持式折光仪 绍兴市亿纳仪器制造有限公司。
1.3 方法
1.3.1 果实热处理
分别用35、42、49 ℃和56 ℃热水喷淋处理蜜柚果实15 min,以常温水(20 ℃)喷淋15 min为对照处理(热水温度以喷口处水温为准)。处理用热水采用实验室型电加热蒸汽加热器(260 L)制备,经由打孔后的聚氯乙烯管喷出,喷淋流量约为200 L/min,喷淋后的热水立即回收,重复利用。处理后的果实经自然通风晾干,于室温(20 ℃)下预贮藏5 d,然后转入(6±1)℃、相对湿度(85±5)%条件下贮藏。每隔20 d测定果实汁胞粒化指数、果肉水分质量分数、可溶性固形物(total soluble solids,TSS)质量分数和可滴定酸(titratable acid,TA)质量分数等指标,筛选较优处理温度,并以该温度处理的果实为处理组,以常温水处理果实为对照组,按上述步骤进行处理和贮藏。在贮藏期内,每隔20 d取果实样品进行细胞壁物质代谢相关指标的测定。
1.3.2 琯溪蜜柚汁胞粒化指数测定
参考佘文琴[3]的方法,以汁胞粒化指数表示粒化程度。取15 个果实,按照粒化面积将汁胞粒化分为4 个级别。0级:汁胞柔软有弹性,没有粒化的瓣;1级:汁胞粒化范围<1/3瓣长;2级:1/3瓣长≤汁胞粒化范围<1/2瓣长;3级:1/2瓣长≤汁胞粒化范围<2/3瓣长;4级:汁胞粒化范围≥2/3瓣长。汁胞粒化指数按式(1)计算。

1.3.3 汁胞水分质量分数、TSS和TA质量分数的测定
汁胞水分质量分数的测定参考杨雪梅等[22]的方法,以果心部位汁胞样品鲜质量与干质量之差占鲜质量的比例表示;TSS和TA质量分数的测定参考Jiang Xuanjing等[23]的方法,用手持式折光仪测定TSS质量分数,采用NaOH中和滴定法测定TA质量分数,按式(2)计算。
式中:V为样品提取液总体积/mL;VS为滴定时所取滤液体积/mL;c为NaOH滴定液浓度/(mol/L);V1为滴定滤液消耗的NaOH溶液体积/mL;V0为滴定蒸馏水消耗的NaOH溶液体积/mL;m为样品质量/g;f为折算系数/(g/mmol)。
1.3.4 汁胞木质素质量分数的测定
参照Hao Yuqi等[24]的方法,以Klason法测定木质素质量分数,具体按式(3)计算。
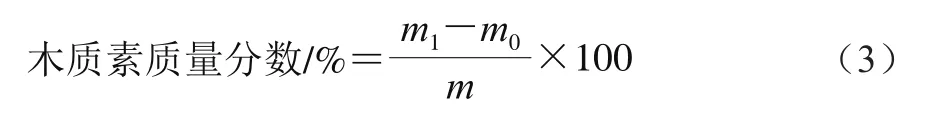
式中:m为每次取样的果肉质量/g;m0为滤纸烘干后的恒质量/g;m1为滤纸同滤渣烘干后的恒质量/g。
1.3.5 木质素合成酶提取和酶活力测定
PAL、肉桂醇脱氢酶(cinnamyl alcohol dehydrogenase,CAD)和POD粗酶液的提取和活力测定参照Hao Yuqi等[24]的方法。PAL活力测定以苯丙氨酸为底物,以每分钟吸光度变化0.01为一个酶活力单位(U);CAD活力测定以反式肉桂酸为底物,以每分钟吸光度变化0.001为一个酶活力单位(U);POD活力测定以愈创木酚为底物,以每分钟吸光度变化0.01为一个酶活力单位(U)。酶活力结果均以蛋白质量计,单位为U/mg。
1.3.6 汁胞细胞壁多糖的提取及含量测定
细胞壁多糖的提取和测定参考Zhang Chunhong[25]和Chen Yihui[26]等的方法,从细胞壁总物质中依次提取WSP、ISP、CBP、半纤维素和纤维素。果胶含量采用咔唑法测定(标准曲线方程:y=0.004 5x+0.023 4,R2=0.998 7),半纤维素和纤维素含量采用蒽酮法测定(标准曲线方程:y=0.011 8x-0.050 6,R2=0.999 1),结果以细胞壁总物质的干基质量计,以mg/g为单位。
1.3.7 汁胞细胞壁多糖降解酶提取和酶活力测定
参照宋丹丹[27]和高维亚[28]等的方法提取细胞壁多糖降解酶并测定酶活力。纤维素酶(cellulase,CEL)活力测定以纤维素为底物,以每小时生成的葡萄糖质量为一个酶活力单位(U)(标准曲线方程:y=0.558 88x-0.03,R2=0.997 3)。果胶甲酯酶(pectin methylesterase,PME)活力测定采用NaOH滴定法,以每小时消耗1 mmol NaOH的酶用量为一个酶活力单位(U);多聚半乳糖醛酸酶(polygalacturonase,PG)活力测定以多聚半乳糖醛酸为底物,以每小时生成的半乳糖醛酸质量为一个酶活力单位(U)(标准曲线方程:y=0.004 5x+0.023 4,R2=0.998 7);β-半乳糖苷酶(β-galactosidase,β-Gal)活力测定以对硝基苯-β-D-吡喃半乳糖苷为底物,以每小时生成的对硝基苯酚质量为一个酶活力单位(U)(标准曲线方程:y=0.006 2x-0.000 2,R2=0.999 6)。以上酶活力均以蛋白质量计,单位为U/mg。
1.3.8 果肉可溶性蛋白含量的测定
参考Bradford[29]的方法,采用考马斯亮蓝G-250染色法测定,以牛血清白蛋白作标准曲线(y=0.008 2x+0.013 9,R2=0.999 2)。
1.4 数据统计与分析
实验均重复测定3 次,采用Microsoft Excel 2016软件计算平均值±标准误差,采用SPSS 21.0软件进行Duncan多重显著性差异分析(P<0.01或P<0.05)。
2 结果与分析
2.1 不同温度处理对琯溪蜜柚果实贮藏期间品质的影响
如图1A所示,在贮藏期间,对照组和不同温度处理的果实汁胞粒化指数均升高。与对照组相比,56 ℃处理的果实汁胞粒化指数在贮藏前期(0~40 d)较低,而在贮藏中后期(60~120 d)较高;49 ℃处理组果实汁胞粒化指数在贮藏0~100 d期间较低,而在120 d时高于对照组果实;35 ℃和42 ℃处理的蜜柚果实汁胞粒化指数在贮藏期间缓慢上升,在相同贮藏时间点均低于对照组果实和其他温度处理组果实。统计分析表明,42 ℃处理的果实汁胞粒化指数在贮藏60~120 d内显著低于对照组果实(P<0.05)。由图1B可知,琯溪蜜柚果实汁胞水分质量分数在贮藏期内不断降低,不同处理的果实汁胞水分质量分数减少速率不同。与对照组果实相比,经49 ℃和56 ℃处理的果实汁胞水分质量分数在贮藏期间下降较快,而经35 ℃和42 ℃处理的果实汁胞水分质量分数下降较缓慢。与对照组果实和其他热处理组果实相比,经42 ℃处理的果实汁胞水分质量分数在贮藏期内相对较高。42 ℃处理组果实汁胞水分质量分数在贮藏40~60 d和100~120 d时显著高于对照组果实(P<0.05)。
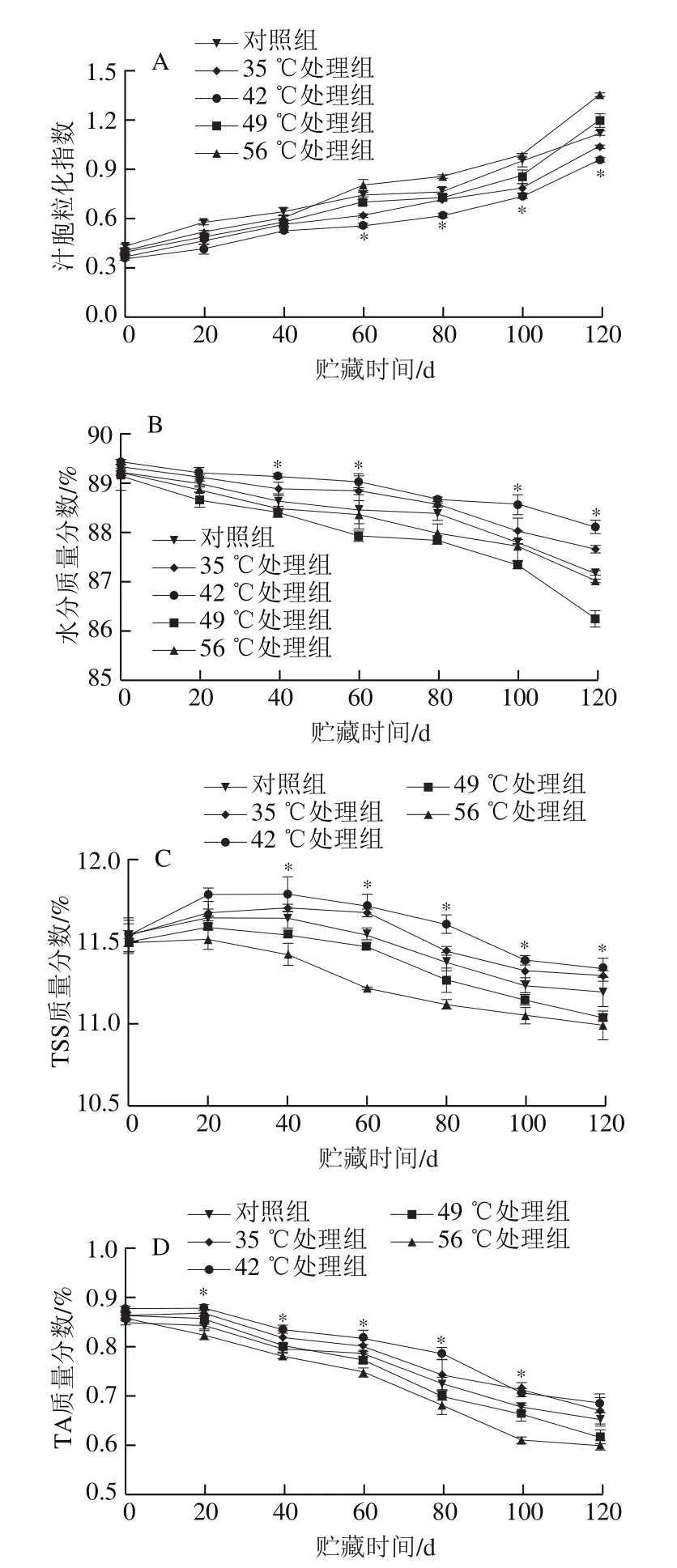
图1 不同温度处理对琯溪蜜柚果实贮藏期间汁胞粒化指数(A)、水分质量分数(B)、TSS质量分数(C)和TA质量分数(D)的影响Fig.1 Effect of heat treatment on juice sac granulation index (A) and the contents of water (B), total soluble solids (C) and titratable acid (D) in Guanxi honey pumelo fruit during storage
由图1C可知,不同温度处理的琯溪蜜柚果实汁胞TSS质量分数在贮藏期间均呈先上升后下降的变化趋势。对照组果实汁胞TSS质量分数在贮藏前期(0~40 d)略有上升,随后快速下降。经49 ℃和56 ℃处理的果实汁胞TSS质量分数在贮藏0~20 d升高,随后快速下降,且在相同贮藏时间内均低于对照组果实;而35 ℃和42 ℃处理果实汁胞的TSS质量分数在贮藏初期(0~40 d)增加较快,随后逐渐降低,并且42 ℃处理组果实的TSS质量分数在贮藏0~120 d内均高于对照组和其他热处理组果实。42 ℃处理果实汁胞的TSS质量分数在贮藏40~120 d内皆显著高于对照组果实(P<0.05)。由图1D可知,琯溪蜜柚果实汁胞TA质量分数在贮藏期内总体呈降低趋势。与对照果实相比,56 ℃处理果实的汁胞TA质量分数在贮藏期内均较低,49 ℃处理果实的汁胞TA质量分数在贮藏0~40 d略高,在随后的贮藏期内较低;而35 ℃和42 ℃处理果实的汁胞TA质量分数在贮藏期内降低较少,其中42 ℃处理果实的汁胞TA质量分数在贮藏0~80 d和120 d相对较高,并且在整个贮藏期内均高于对照组以及49 ℃和56 ℃处理组果实。42 ℃处理果实的汁胞TA质量分数在贮藏20~100 d显著高于对照组果实(P<0.05)。
综上,42 ℃热水喷淋处理能够抑制琯溪蜜柚果实贮藏期间汁胞粒化指数升高和水分质量分数下降,维持较高的汁胞TSS和TA质量分数,对采后琯溪蜜柚果实在贮藏期间的品质维持,尤其在延缓汁胞粒化和失水方面,具有较好的效果,因此在后续实验中,以42 ℃为处理温度,进一步研究热处理延缓汁胞粒化与细胞壁物质代谢的关系。
2.2 热处理对琯溪蜜柚果实贮藏期间汁胞木质素质量分数及其相关合成酶活力的影响
如图2A所示,琯溪蜜柚汁胞木质素质量分数在贮藏期间逐渐增加。对照组果实汁胞的木质素质量分数在0~20 d期间上升的趋势较为平缓,在20~120 d升高较快。42 ℃处理的果实汁胞木质素质量分数增加趋势与对照果实相似,但在贮藏40~120 d内均相对较低。42 ℃处理组果实的汁胞木质素质量分数在贮藏80 d和120 d时显著低于对照组果实(P<0.05),表明42 ℃处理能延缓贮藏期间琯溪蜜柚果实汁胞木质素质量分数的增加。

图2 热处理对琯溪蜜柚果实贮藏期间汁胞木质素质量分数(A)及PAL(B)、CAD(C)和POD(D)等木质素合成酶活力的影响Fig.2 Effect of heat treatment on lignin content (A) and the activities of phenylalanine ammonia-lyase (B), cinnamyl alcohol dehydrogenase (C) and peroxidase (D) in the juice sac of Guanxi honey pumelo fruit during storage
由图2B可知,在贮藏0~40 d期间,琯溪蜜柚果实汁胞PAL活力迅速增加,随后逐渐降低。与对照果实相比,经42 ℃处理的果实汁胞PAL活力在贮藏0~120 d内均较低,且在贮藏40~60 d和100 d时显著低于对照果实(P<0.05)。如图2C、D所示,琯溪蜜柚果实汁胞CAD和POD活力在贮藏期间呈相似的变化趋势,均在贮藏0~80 d快速上升,在80~120 d维持在较高水平,并且在贮藏时间内,42 ℃处理组的蜜柚果实汁胞CAD和POD活力均低于对照果实。经42 ℃处理果实的CAD活力在贮藏20 d和80~100 d时显著低于对照果实(P<0.05),POD活力在贮藏20~40 d和80~100 d时显著低于对照组(P<0.05)。由此可见,42 ℃处理延缓了琯溪蜜柚果实在贮藏期间汁胞CAD和POD活力的上升,并抑制了PAL活力贮藏前期的上升和贮藏后期的下降。
2.3 热处理对琯溪蜜柚果实贮藏期间汁胞细胞壁多糖含量的影响
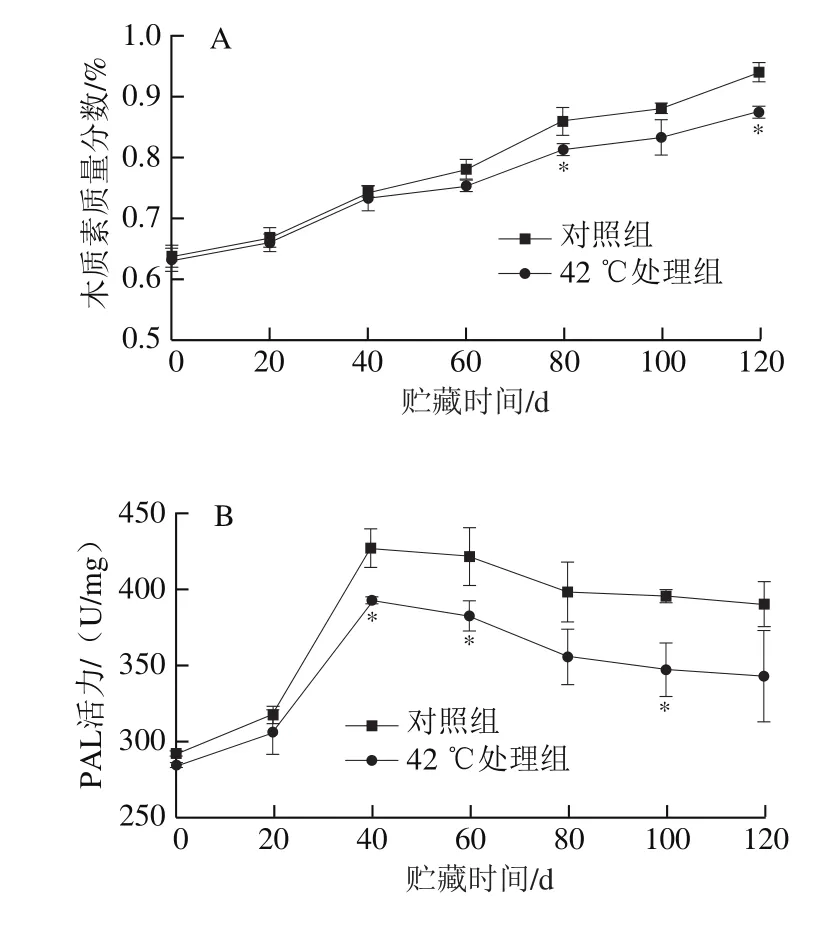
由图3A、B可知,随着贮藏时间的延长,琯溪蜜柚果实汁胞的纤维素和半纤维素含量整体呈上升趋势。对照果实的汁胞纤维素含量在贮藏初期(0~20 d)增加较缓慢,在20~60 d迅速增加,随后继续升高;其半纤维素含量在贮藏0~80 d期间缓慢增加,但在贮藏末期(80~120 d)快速上升。与对照果实相比,经42 ℃处理的果实汁胞纤维素和半纤维素含量在贮藏期内均较低。相较于对照组果实,42 ℃处理组果实汁胞纤维素含量在贮藏20~100 d期间显著较低(P<0.05),在120 d极显著较低(P<0.01),而半纤维素含量在贮藏60 d和120 d时显著较低(P<0.05)。
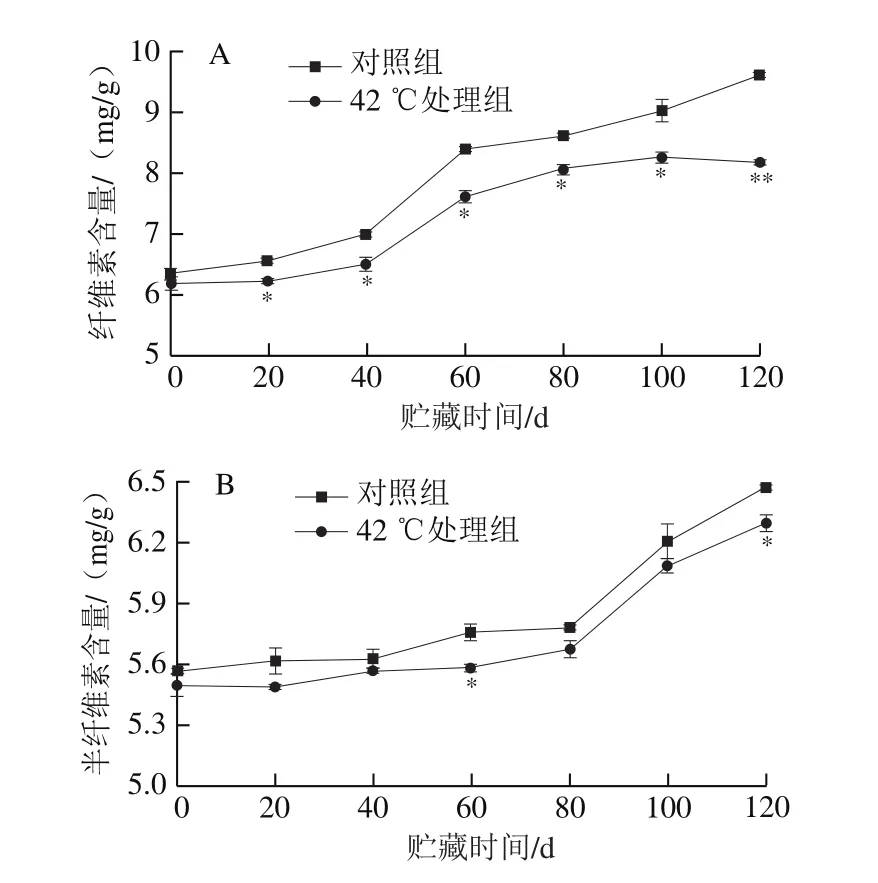
图3 热处理对琯溪蜜柚果实贮藏期间汁胞细胞壁纤维素(A)和半纤维素(B)含量的影响Fig.3 Effect of heat treatment on the contents of cell wall cellulose (A)and hemicellulose (B) in the juice sac of Guanxi honey pumelo fruit during storage
如图4A~C所示,随着贮藏时间延长,对照组和42 ℃处理组琯溪蜜柚果实汁胞内CBP含量不断降低,而ISP和WSP含量在贮藏0~80 d上升,在80~100 d下降。其中,对照组果实的汁胞CBP含量在0~20 d缓慢降低,同期ISP和WSP含量上升趋势较缓;而贮藏20~60 d期间,CBP含量快速下降,ISP和WSP含量骤增;贮藏60~120 d期间,CBP含量缓慢降低,ISP和WSP含量在60~80 d时增加,随后快速下降。与对照组果实相比,42 ℃处理的果实汁胞CBP含量在相同贮藏时间内均较高,而ISP和WSP含量均较低。42 ℃处理的果实汁胞CBP含量在贮藏100~120 d显著高于对照果实(P<0.05),而ISP和WSP含量在贮藏60~120 d显著低于对照果实(P<0.05),其中WSP含量在120 d时极显著低于对照组(P<0.01)。


图4 热处理对琯溪蜜柚果实贮藏期间汁胞细胞壁CBP(A)、ISP(B)和WSP(C)含量的影响Fig.4 Effect of heat treatment on the contents of cell wall covalently bound pectin (A), ion-soluble pectin (B) and water-soluble pectin (C) in the juice sac of Guanxi honey pumelo fruit during storage
2.4 热处理对琯溪蜜柚果实贮藏期间汁胞细胞壁多糖降解酶的影响

如图5所示,琯溪蜜柚果实汁胞的CEL、PME、PG和β-Gal活力在贮藏期间均呈先升高后降低的趋势。由图5A可知,对照组和42 ℃处理组蜜柚果实汁胞CEL活力在贮藏前期(0~60 d)逐渐升高,对照组果实汁胞CEL活力随后不断降低,而42 ℃处理组果实汁胞CEL活力在60~80 d时略有升高后逐渐降低。虽然在贮藏20~60 d时,经42 ℃处理的果实汁胞CEL活力显著低于对照组果实(P<0.05),但是CEL活力在整个贮藏期间变化幅度不大。由图5B、C可知,对照组和热处理组果实的PME活力和PG活力在贮藏0~20 d略有增加,20~60 d迅速升高,随后在60~120 d快速降低。42 ℃处理组果实汁胞的PME活力和PG活力分别在贮藏60~80 d和40~100 d时显著低于对照组果实(P<0.05)。由图5D可知,对照组果实汁胞β-Gal活力在贮藏0~40 d升高较快,40~80 d缓慢上升,随后迅速下降;经42 ℃处理的果实汁胞β-Gal活力在贮藏0~80 d内升高较少,在80~120 d快速下降。与对照组果实相比,42 ℃处理组果实汁胞β-Gal活力在贮藏40~60 d以及100~120 d时显著较低(P<0.05),其中120 d时极显著较低(P<0.01)。
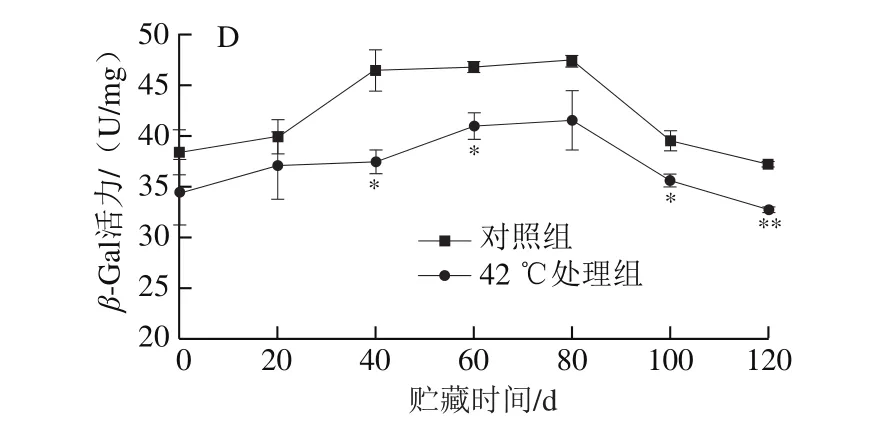
图5 热处理对琯溪蜜柚果实贮藏期间汁胞CEL(A)、PME(B)、PG(C)和β-Gal(D)活力的影响Fig.5 Effect of heat treatment on the activities of cellulase (A), pectin methylesterase (B), polygalacturonase (C) and β-galactosidase (D) in the juice sac of Guanxi honey pumelo fruit during storage
3 讨 论
采后贮藏和流通环节中,蜜柚果实受呼吸作用、蒸腾作用等自身生理因素和环境温度、湿度、气体等外界因素的影响,易出现汁胞失水变硬、细胞壁加厚等现象,导致果瓣含水量下降,出现由近蒂端向果心发展的汁胞粒化,同时有机物质发生转化,如糖和有机酸类物质被消耗,引起风味变化[2,6,30]。适宜的采后处理和贮藏技术可延缓采后柚类果实的失水粒化和风味变化。例如,冷激结合魔芋涂膜、臭氧处理结合气调包装(5% O2、3% CO2、92% N2)等方法均可有效延缓采后琯溪蜜柚果实粒化,减缓总糖和总酸含量降低,保持果实商品价值,延长贮藏期[14,31]。本研究结果表明,随着贮藏时间的延长,琯溪蜜柚果实汁胞粒化程度不断增加,汁胞水分质量分数、TSS和TA质量分数逐渐降低;温和的热处理(35 ℃和42 ℃)可延缓贮藏期内果实汁胞粒化指数的升高和水分质量分数、TA质量分数的下降,并且能提高和维持TSS质量分数,从而较好地维持果实品质,其中42 ℃热水喷淋处理的效果最好;而较高温度(49 ℃和56 ℃)处理在贮藏中后期促进了汁胞粒化,促使果实品质下降,这可能与高温破坏了果皮表面蜡质层,同时造成气孔过于舒张,影响贮藏期内果皮的屏障作用有关。
主要存在于细胞初生壁和次生壁的纤维素、半纤维素和木质素,以及主要存在于胞间层的果胶是高等植物细胞壁的典型构成组分,它们的含量变化受各种生理活动影响,同时决定着果实宏观质地品质[26]。前人研究发现,细胞壁木质化和纤维化是采后琯溪蜜柚果实汁胞粒化的主要因素和表现[8,32]。与木质化有关的木质素合成包括木质素单体形成及木质素单体聚合两个阶段[24]。其中,木质素单体的合成通过苯丙烷代谢途径完成,PAL和CAD作用于这一复杂代谢途径的核心环节,分别催化木质素单体合成的起始步反应和最后一步反应[10],随后的聚合过程则由POD在过氧化氢参与下催化完成[33]。因此,PAL、CAD和POD是木质素合成的关键代谢酶,抑制它们的活性有助于控制果实组织木质化。研究表明,50 ℃热空气处理可以通过抑制枇杷果实PAL、CAD和POD活性,减少木质素合成与积累,减轻冷藏过程中的木质化症状[34];而对于琯溪蜜柚果实,采后水杨酸处理或低温贮藏均能抑制PAL、CAD和POD等酶活性,减少木质素合成,从而延缓木质化和汁胞粒化进程[12]。本研究结果表明,随着贮藏时间延长,对照组琯溪蜜柚果实汁胞粒化指数上升,木质素质量分数不断增加,两者呈极显著正相关(r=0.958);PAL活力在贮藏初期(0~40 d)迅速升高,与木质素质量分数呈正相关(r=0.996);CAD和POD活力在贮藏期内均提高,均与木质素质量分数呈极显著正相关,相关系数分别为0.951、0.957。据此认为,琯溪蜜柚果实在贮藏期内的汁胞粒化的发生与木质素合成相关酶活力提高、导致木质化加剧有关,这一推断与潘腾飞等[12]的研究结果一致。与对照组相比,42 ℃热水喷淋处理有效延缓了采后琯溪蜜柚果实汁胞粒化进程和木质素质量分数升高,抑制了汁胞PAL、CAD和POD活性,表明适宜的热处理可通过抑制木质素合成代谢关键酶的活性推迟木质化的发生,从而减轻粒化程度,维持果实的贮藏品质。
果实中细胞壁多糖降解酶的活性与纤维素、半纤维素和果胶类物质的含量和组分变化密切相关[26]。CEL可催化纤维素水解成纤维寡糖,PME和PG协同催化果胶降解,此过程中存在CBP向ISP和WSP的转化[26,35],β-Gal则可水解半乳聚糖侧链残基,促进果胶-纤维素-半纤维素复合结构解体[36]。前人研究发现,在琯溪蜜柚果实采前成熟阶段,粒化汁胞的细胞壁物质、原果胶和纤维素含量高于未粒化汁胞,而可溶性果胶含量较低,并且粒化程度与PME、PG和CEL活性密切相关[3]。近年来许多研究表明,热处理可以通过抑制PME、PG、CEL和β-Gal等酶的活性,延缓采后草莓[37]、龙眼[38]、葡萄柚[21]等果实细胞壁多糖组分的变化,维持果实采后品质。本研究发现,随着贮藏期内琯溪蜜柚果实汁胞粒化程度的加剧,纤维素和半纤维素含量增加,其中纤维素含量与汁胞粒化指数呈极显著正相关(r=0.949**),表明汁胞粒化过程中存在纤维化现象;与对照组相比,42 ℃处理抑制了琯溪蜜柚果实贮藏期内汁胞粒化指数的上升,同时延缓了纤维素和半纤维含量的升高,据此认为42 ℃处理减轻采后琯溪蜜柚果实汁胞粒化与其抑制纤维化有关。虽然琯溪蜜柚果实汁胞CEL活力在贮藏前期(0~60 d)有所升高,且42 ℃处理抑制了CEL活力变化,但是CEL活力在贮藏期内变化不大。结合纤维素含量增加的现象进行分析,可推断在贮藏期内,琯溪蜜柚果实汁胞中可能存在较为活跃的纤维素合成。此外,在贮藏初期(0~20 d),琯溪蜜柚果实汁胞CBP、ISP、WSP含量以及PME和PG活力变化不大;而在贮藏20~60 d期间,CBP含量迅速下降,ISP和WSP含量快速增加,PME活力快速升高,PME活力与CBP含量呈极显著负相关(r=-0.998),PG和β-Gal活力也升高较快,表明此阶段CBP在PME和PG等酶的作用下大量降解,致使ISP和WSP较快生成;在贮藏后期(60~120 d),汁胞CBP含量缓慢降低,PME和PG活力迅速降低,ISP和WSP含量以及β-Gal活力在80~120 d下降,表明随着贮藏时间的延长,果胶类物质进一步降解,相关降解酶的活性有所降低。与对照处理组相比,42 ℃热水喷淋处理抑制了PME、PG和β-Gal活力的增加,减缓了CBP的降解以及ISP和WSP的生成,因此具有延缓果胶组分变化、维持细胞壁结构的作用。
综上,与其他处理相比,42 ℃热水喷淋处理能够有效抑制琯溪蜜柚果实贮藏期间的汁胞粒化现象,延缓果实水分质量分数降低,维持果实汁胞较高的TSS和TA质量分数,延缓采后琯溪蜜柚果实在贮藏期间的品质劣变。进一步研究发现,42 ℃热处理通过抑制采后琯溪蜜柚果实汁胞中PAL、CAD和POD等酶的活性,减缓了木质素合成与积累,同时延缓了纤维素和半纤维素含量升高,从而减轻了细胞木质化和纤维化;此外,热处理也抑制了PME、PG和β-Gal等细胞壁降解酶活力,延缓了CBP向ISP和WSP的转化。这些作用共同维持了采后琯溪蜜柚果实汁胞细胞壁的组分和结构,延缓了果实衰老和汁胞粒化劣变的进程。本研究在明确采后琯溪蜜柚果实汁胞粒化与木质化关系的同时,初步阐明了热处理对木质化和汁胞粒化的控制作用和机制,但琯溪蜜柚果实汁胞粒化过程中纤维化的发生机制及其受热处理抑制的原因还有待深入研究。

