基于美国SEER数据库的儿童胶质瘤临床特点和预后分析
石易鑫 马文斌 王裕
胶质瘤是儿童和青少年最常见的中枢神经系统肿瘤,临床表现多样,其中,低级别胶质瘤占儿童中枢神经系统肿瘤的25%~30%[1],尤以毛细胞型星形细胞瘤最为多见[2];高级别胶质瘤发生率相对较低,约为低级别胶质瘤的50%[3],主要包括间变型星形细胞瘤和胶质母细胞瘤[2]。弥漫性内生型脑桥胶质瘤(DIPG)好发于儿童,组织学形态呈低级别,但表现出恶性、侵袭性生物学特性[4]。治疗方面,儿童低级别胶质瘤以手术切除为主,肿瘤全切除可达治愈疗效,无法全切除的肿瘤则存在进展和复发可能,通常予长春新碱联合卡铂或单药化疗,长春新碱联合卡铂化疗可显著延长<10岁的进展期胶质瘤患儿5年无进展生存期(PFS)[5];长春新碱单药化疗(1次/周)亦可显著延长进展期胶质瘤患儿的无进展生存期和总生存期(OS)[6]。应注意的是,替莫唑胺方案作为成人胶质瘤的标准治疗并不适用于儿童低级别胶质瘤,总体响应率较低,无法获得有效的治疗反应[7]。随着更多基因突变位点被检出以及分子分型的加入,越来越多的儿童低级别胶质瘤可以从靶向治疗中获益,但仍处于临床研究阶段[8⁃9]。高级别胶质瘤以手术切除联合放化疗为主,可提高患儿生活质量,但预后仍较差[10],儿童胶质母细胞瘤的治疗方法为最大限度手术切除联合基于替莫唑胺的放化疗方案[11],但目前尚缺乏替莫唑胺辅助治疗的临床疗效证据[12]。与成人胶质母细胞瘤相比,儿童胶质母细胞瘤采取基于替莫唑胺的放化疗方案并不能改善生存期,其中位生存期为9~10个月[13],新型辅助化疗和靶向治疗等方案正在进行相应的临床试验[14⁃15],但囊括组织学分型的大样本儿童胶质瘤研究仍较少。SEER(Surveillance,Epidemiology,and End Results;https://seer.cancer.gov/)数据库作为美国国立癌症研究所(NCI)资助的可公开获取的大型肿瘤登记注册数据库,允许全球已签署SEER研究数据协议的研究者对美国所有肿瘤进行基于人群的监测和分析,包括流行率、患病率和病死率等流行病学研究,手术切除与放疗之间治疗模式转换,通过地理和人口统计学因素量化诊断与治疗模式[16]。在本研究中,中国医学科学院北京协和医院基于SEER数据库的人群监测和分析,总结不同组织学分型的儿童胶质瘤的临床特征并探究此类患儿生存获益的相关因素。
对象与方法
一、研究对象
筛选SEER数据库中2000-2015年经组织病理学证实的18岁以下胶质瘤患儿,并排除无生存数据或肿瘤非首发疾病或唯一原发疾病者,最终纳入7759例,男性4197例,女性3562例;确诊年龄为0~18岁,中位年龄7(3,13)岁;根据组织学分为5种类型,即毛细胞型星形细胞瘤、髓母细胞瘤、室管膜瘤、胶质母细胞瘤及其他组织学类型胶质瘤(包括弥漫型和间变型星形细胞瘤、少突胶质细胞瘤、神经元和混合性神经元⁃神经胶质肿瘤、混合性胶质瘤、非特指胶质瘤)。
二、研究方法
1.数据采集 收集患儿人口统计学信息、肿瘤特征和治疗资料等回顾性数据。人口统计学信息包括性别和确诊年龄,其中年龄根据其发育阶段分为婴幼儿期(0~3岁)、学龄前期(4~5岁)、学龄期(6~12岁)和青春期(13~18岁)[17],肿瘤特征包括组织学类型、病理分级、肿瘤大小和原发部位,治疗资料仅包括是否手术切除和放射治疗。
2.统计分析方法 采用SPSS 26.0统计软件进行数据处理与分析。比较5种组织学类型人口统计学信息、肿瘤特征和治疗资料,其中计数资料以相对数构成比(%)或率(%)表示,采用χ2检验;计量资料以均数±标准差(x±s)表示,采用单因素方差分析,两两比较行LSD⁃t检验。生存分析的主要结局是5年生存率,5年生存率定义为确诊后第5年未出现死亡事件的患儿比例,绘制Kaplan⁃Meier生存曲线,比较毛细胞型星形细胞瘤、髓母细胞瘤、室管膜瘤和胶质母细胞瘤患儿的5年生存率。上述4种组织学类型患儿生存预后相关影响因素的筛查,采用单因素log⁃rank检验和多因素向前引入法Cox回归分析(α入=0.05,α出=0.10)。以P≤0.05为差异具有统计学意义。
结 果
7759例胶质瘤患儿根据组织学类型分为毛细胞型星形细胞瘤2585例(33.32%),髓母细胞瘤2061例(26.56%),室管膜瘤777例(10.01%),胶质母细胞瘤443例(5.71%),其他组织学类型胶质瘤(包括弥漫型和间变型星形细胞瘤577例、少突胶质细胞瘤224例、神经元和混合性神经元⁃神经胶质肿瘤70例、混合性胶质瘤89例、非特指胶质瘤933例)1893例(24.40%)。人口统计学信息方面,5种组织学类型患儿性别(P=0.000)和确诊年龄(P=0.000)差异有统计学意义,均好发于男性,毛细胞型星形细胞瘤和胶质母细胞瘤患儿年龄偏大、髓母细胞瘤和室管膜瘤患儿年龄偏小;确诊年龄分别为婴幼儿期(0~3岁)2069例(26.67%)、学龄前期(4~5岁)969例(12.49%)、学 龄 期(6~12岁)2753例(35.48%)、青春期(13~18岁)1968例(25.36%),不同组织学类型高峰发病年龄段差异亦有统计学意义(P=0.000),其中髓母细胞瘤和室管膜瘤发生于婴幼儿期的比例较高,毛细胞型星形细胞瘤好发于学龄期,而胶质母细胞瘤集中于学龄期和青春期(表1)。肿瘤特征方面,低级别(WHOⅠ~Ⅱ级)胶质瘤1191例(15.35%)、高级别(WHOⅢ~Ⅳ级)胶质瘤1490例(19.20%)、病理分级未知5078例(65.45%),5种组织学类型之间差异有统计学意义(P=0.000),其中毛细胞型星形细胞瘤主要呈低级别,髓母细胞瘤、室管膜瘤和胶质母细胞瘤则以高级别为主;肿瘤直径≤4.50 cm 2460例(31.71%)、>4.50 cm 1921例(24.76%)、肿瘤直径未知3378例(43.54%),5种组织学类型之间差异有统计学意义(P=0.000),其中髓母细胞瘤和胶质母细胞瘤直径较大;患儿肿瘤位于脑干1162例(14.98%)、幕上及脑室2771例(35.71%)、小脑2549例(32.85%)、其他部位1277例(16.46%),5种组织学类型之间差异有统计学意义(P=0.000),其中毛细胞型星形细胞瘤和髓母细胞瘤好发于小脑,室管膜瘤和胶质母细胞瘤则以幕上及脑室为主要原发部位(表1)。在治疗方面,手术切除6901例(88.94%),未予手术治疗858例(11.06%),5种组织学类型之间差异有统计学意义(P=0.000),其中胶质母细胞瘤手术切除比例较少;接受放疗2990例(38.54%),未予放疗4769例(61.46%),5种组织学类型之间差异有统计学意义(P=0.000),其中毛细胞型星形细胞瘤接受放疗比例较少(表1)。

表1 不同组织学类型胶质瘤患儿人口统计学信息、肿瘤特征和治疗资料的比较Table 1. Comparison of demographic,tumor characteristics and treatment courses of pediatric glioma patients with different histological classification
本组患儿生存期为0~16.92年,平均(12.89±0.10)岁;毛细胞型星形细胞瘤、髓母细胞瘤、室管膜瘤和胶质母细胞瘤患儿5年生存率分别为97.41%(2518/2585)、64.39%(1327/2061)、76.83%(597/777)和16.25%(72/443),不同组织学类型之间差异具有统计学意义(χ2=2145.672,P=0.000;图1)。进一步筛查胶质瘤预后相关影响因素,上述4种组织学类型各不相同,(1)毛细胞型星形细胞瘤:单因素log⁃rank检验显示,年龄(P=0.013)、病理分级(P=0.003)、肿瘤大小(P=0.003)和部位(P=0.000)、手术切除(P=0.004)、放疗(P=0.000)是预后影响因素,结合单因素log⁃rank检验结果并根据纳入与剔除标准进一步行多因素向前引入法Cox回归分析,计算过程中发现确诊年龄(χ2=0.470,P=0.926)、肿瘤大小(χ2=2.829,P=0.093)和部位(χ2=4.919,P=0.085)、手术治疗(χ2=0.024,P=0.876)对患儿预后影响差异无统计学意义,故未纳入最终的Cox回归模型,结果显示,高级别胶质瘤(RR=5.344,95%CI:1.150~24.837;P=0.032)和 放 疗(RR=3.973,95%CI:1.050~15.029;P=0.042)是毛细胞型星形细胞瘤患儿生存相关的危险因素(表2~4)。(2)髓母细胞瘤:单因素log⁃rank检验显示,年龄(P=0.000)、肿瘤大小(P=0.006)和部位(P=0.000)、手术切除(P=0.000)、放疗(P=0.000)是预后影响因素,进一步行多因素Cox回归分析,计算过程中发现肿瘤大小(χ2=0.039,P=0.844)对患儿预后影响差异无统计学意义,故未纳入最终的Cox回归模型,结果显示,肿瘤位于幕上及脑室是髓母细胞瘤患儿生存 相 关 的 危 险 因 素(RR=1.567,95%CI:1.122~2.189;P=0.008),而学龄前期(RR=0.641,95%CI:0.457~0.898;P=0.010)、学 龄 期(RR=0.631,95%CI:0.480~0.831;P=0.001)和 青 春 期(RR=0.651,95%CI:0.457~0.927;P=0.017)患儿以及接受手术切除(RR=0.262,95%CI:0.157~0.437;P=0.000)和放疗(RR=0.537,95%CI:0.421~0.685;P=0.000)的患儿倾向获得生存获益(表2,3,5)。(3)室管膜瘤:单因素log⁃rank检验显示,病理分级(P=0.003)、肿瘤部位(P=0.000)、手术切除(P=0.000)、放疗(P=0.035)是预后影响因素,进一步行多因素Cox回归分析,计算过程中发现确诊年龄(χ2=3.144,P=0.0.379)、肿瘤部位(χ2=4.080,P=0.130)、放射治疗(χ2=0.669,P=0.413)对患儿预后影响差异无统计学意义,故未纳入最终的Cox回归模型,结果显示,高级别胶质瘤是室管膜瘤患儿生存相关的危 险 因 素(RR=2.709,95%CI:1.398~5.249;P=0.003),而接受手术切除倾向改善患儿生存预后(RR=0.232,95%CI:0.094~0.577,P=0.002;表2,3,6)。(4)胶质母细胞瘤:单因素log⁃rank检验显示,年龄(P=0.001)、病理分级(P=0.027)、肿瘤部位(P=0.000)、手术切除(P=0.000)是预后影响因素,进一步行多因素Cox回归分析,计算过程中发现肿瘤部位(χ2=4.282,P=0.118)、病理分级(χ2=0.365,P=0.546)对患儿预后影响差异无统计学意义,故未纳入最终的Cox回归模型,结果显示,确认年龄为学龄期是胶质母细胞瘤患儿生存相关的危险因素(RR=2.263,95%CI:1.064~4.812;P=0.034),而接受手术切除倾向改善患儿生存预后(RR=0.339,95%CI:0.176~0.654,P=0.001;表2,3,7)。
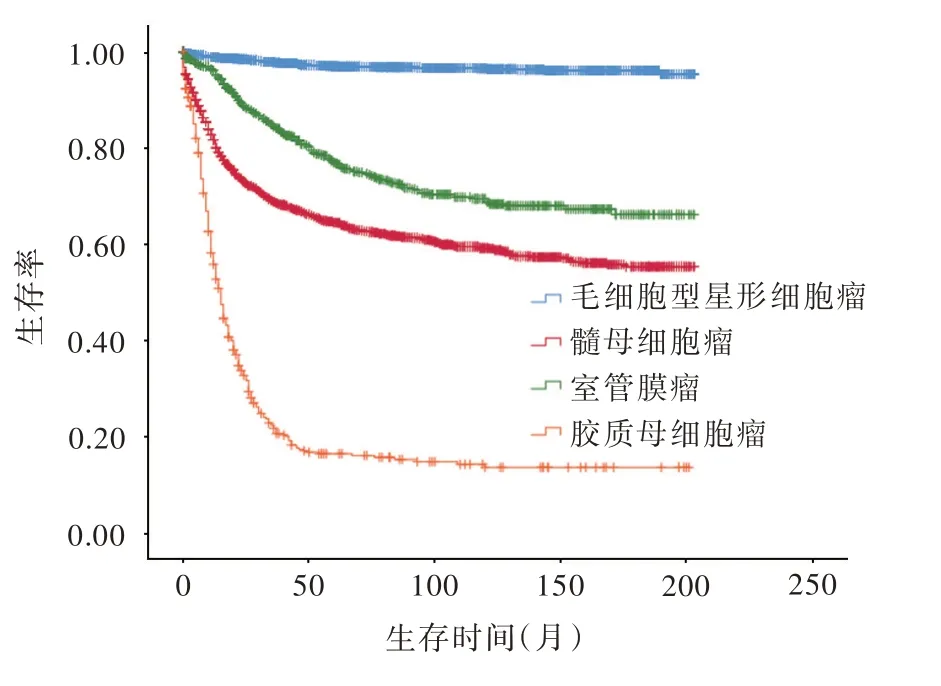
图1 Kaplan⁃Meier生存曲线显示,毛细胞型星形细胞瘤、髓母细胞瘤、室管膜瘤和胶质母细胞瘤患儿5年生存率分别为97.41%(2518/2585)、64.39%(1327/2061)、76.83%(597/777)和16.25%(72/443),不同组织学类型之间差异具有统计学意义(χ2=2145.672,P=0.000)Figure 1 Kaplan⁃Meier survival curve showed that 5⁃year survival rates of pediatric gliomas patients with pilocytic astrocytoma,medulloblastoma,ependymoma,and glioblastoma were 97.41%(2518/2585),64.39%(1327/2061),76.83%(597/777)and 16.25%(72/443),respectively.The difference between different histological types was statistically significant(χ2=2145.672,P=0.000).

表2 不同组织学类型小儿胶质瘤预后相关影响因素的单因素log⁃rank检验Table 2. Univariate log⁃rank test of factors related to prognosis of different histological types of pediatric gliomas
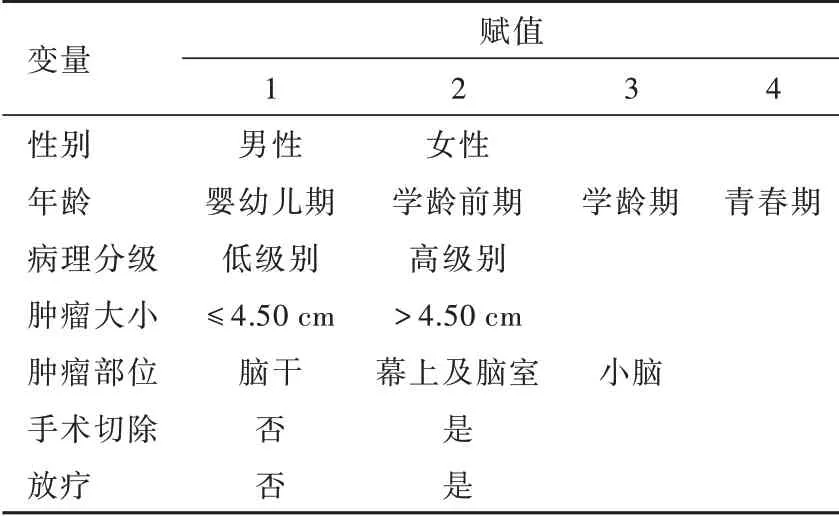
表3 不同组织学类型小儿胶质瘤预后相关影响因素的变量赋值表Table 3. Assignment of variable related to prognosis of different histological types of pediatric gliomas

表4 毛细胞型星形细胞瘤预后相关影响因素的多因素向前引入法Cox回归分析Table 4. Multivariate forward selection Cox regression analysis of factors related to prognosis of pilocytic astrocytoma
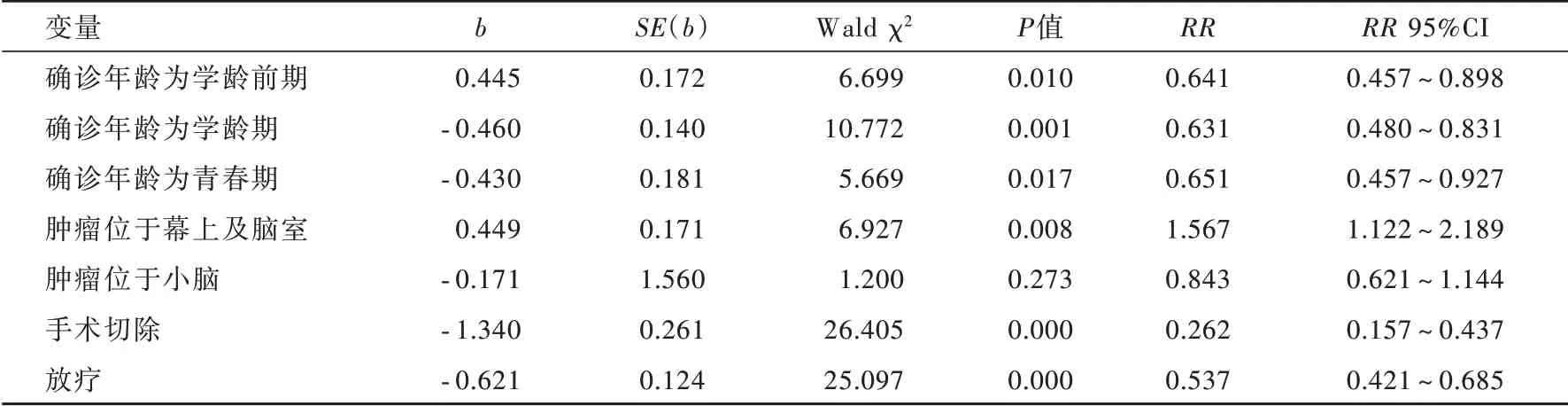
表5 髓母细胞瘤预后相关影响因素的多因素向前引入法Cox回归分析Table 5. Multivariate forward selection Cox regression analysis of factors related to prognosis of medulloblastoma

表6 室管膜瘤预后相关影响因素的多因素向前引入法Cox回归分析Table 6. Multivariate forward selection Cox regression analysis of factors related to prognosis of ependymoma

表7 胶质母细胞瘤预后相关影响因素的多因素向前引入法Cox回归分析Table 7. Multivariate forward selection Cox regression analysis of factors related to prognosis of glioblastoma
讨 论
本研究基于SEER数据库回顾性纳入7759例儿童胶质瘤患者,组织学类型以毛细胞型星形细胞瘤为主,占33.32%(2585/7759)。不同组织学类型之间存在性别差异,髓母细胞瘤和胶质母细胞瘤均好发于男性,分别占60.89%(1255/2061)和57.56%(255/443)。平均确诊年龄为(7.99±5.39)岁,学龄期为高峰发病年龄,占35.48%(2753/7759)。不同组织学类型胶质瘤病理分级差异较大,毛细胞型星形细胞瘤以低级别为主,占24.06%(622/2585);髓母细胞瘤、室管膜瘤和胶质母细胞瘤则主要呈高级别,分别占25.04%(516/2061)、40.15%(312/777)和32.51%(144/443)。不同组织学类型胶质瘤大小和部位亦存有差异,毛细胞型星形细胞瘤和髓母细胞瘤以小肿瘤为主且好发于小脑,分别占31.30%(809/2585)和33.77%(696/2061)、42.24%(1092/2585)和59.58%(1228/2061),而室管膜瘤和胶质母细胞瘤则较大且多发生于幕上及脑室,分别占32.43%(252/777)和29.57%(131/443)、36.81%(286/777)和65.91%(292/443)。生存分析显示,儿童胶质瘤的组织学类型与预后显著相关,毛细胞型星形细胞瘤患儿的5年生存率最佳,高达97.41%(2518/2585);胶质母细胞瘤患儿5年生存率最差,仅为16.25%(72/443);应注意的是,虽然髓母细胞瘤和室管膜瘤以高级别为主,但5年生存率均优于胶质母细胞瘤,分别为64.39%(1327/2061)和76.83%(597/777)。单因素log⁃rank检验和多因素Cox回归分析显示,不同组织学类型胶质瘤预后相关影响因素不尽一致,主要包括确诊年龄、肿瘤大小和部位、病理分级、手术切除和放疗,除毛细胞型星形细胞瘤外,髓母细胞瘤、室管膜瘤和胶质母细胞瘤患儿接受手术切除均对生存预后有积极意义;放疗可降低髓母细胞瘤患儿死亡风险,但可能增加毛细胞型星形细胞瘤患儿的死亡风险,而与室管膜瘤和胶质母细胞瘤患儿死亡风险无关联性。
既往基于人群的流行病学调查和生存分析显示,毛细胞型星形细胞瘤患者预后较好[18],与本研究结果相一致;但一项回顾性研究显示,若肿瘤位于下丘脑/视交叉区域或发生软脑膜播散,因无法进行手术全切除,则总生存期显著缩短[19]。大部分毛细胞型星形细胞瘤可通过手术全切除以实现治愈,而接受放疗的患者多因无法手术全切除或肿瘤复发[20],预后较差;此外,Krishnatry等[21]发现,接受前期放疗的儿童低级别胶质瘤患者的病死率显著上升,与本研究中毛细胞型星形细胞瘤患儿的放疗效果相一致。年龄<3岁的髓母细胞瘤患儿预后较差,考虑是由于严重的认知功能障碍无法进行术后辅助放疗所致[22⁃23],或者此类患儿处于发育早期,肿瘤相对顽固,易产生放疗抵抗[24]。本研究结果显示,手术切除和放疗均对髓母细胞瘤患儿的生存预后有积极意义,业已证实与单纯手术切除相比,手术切除联合放疗可使髓母细胞瘤患者获得最佳的生存获益[25]。儿童室管膜瘤的治疗方案尚存争议,手术切除联合放疗仍为目前的主要治疗共识[26⁃27],而药物化疗效果并无明确的证据支持。本研究结果显示,手术切除可降低室管膜瘤患儿的死亡风险,但并未得出放疗与生存预后相关的证据。与成人胶质母细胞瘤不同,药物化疗在儿童胶质母细胞瘤中的作用尚不明确,手术切除联合放疗仍为主要治疗方式[23]。儿童癌症组(CCG)的研究显示,手术切除率≥90%的高级别胶质瘤患儿5年无进展生存期为35%,而未行手术治疗的患儿仅为17%[28]。本研究结果显示,手术切除可降低胶质母细胞瘤患儿的死亡风险,亦未得出放疗与生存预后相关的证据,可能与儿童胶质母细胞瘤易产生与成人胶质母细胞瘤不同的基因和信号转导通路改变,从而产生放疗抵抗有关。Alhajala等[29]发现,儿童胶质母细胞瘤细胞通过过表达DNA合成限速酶核糖核苷酸还原酶(RR)和组织蛋白酶B前体(pro⁃cathepsin B),增快肿瘤细胞生长速度,产生放疗抵抗。
本研究具有一定的局限性,因无法获得并适当控制未记录在SEER数据库中的变量,生存分析受到限制,例如,缺少肿瘤部位的详细信息,而这对脑干肿瘤分类十分重要[30];SEER数据库中缺少放疗和药物化疗剂量和时间的相关数据,但是既往研究并未显示出不同放疗剂量和时间对预后影响的差异[19,31⁃32];无 法 评 估 患 儿 神 经 功 能 状 态 和 神 经 系 统症状持续时间,回顾性研究显示这些因素均与脑干胶质瘤患儿的预后相关[33]。随着精准医学和肿瘤分子分型的发展,儿童胶质瘤的分子改变将成为预后的关键影响因素[2],但是由于SEER数据库缺少肿瘤分子分型相关信息,且本研究仅纳入2000-2015年的儿童胶质瘤信息,其组织学分型和病理分级与2016年第四版WHO中枢神经系统肿瘤分类修订版不完全相同。尽管存在上述局限性,本研究基于大数据总结儿童胶质瘤的临床特点并进行预后分析,纳入7759例经组织病理学确诊的儿童胶质瘤患者,其研究结论具有普遍性和代表性。
结 论
本研究是基于SEER数据库的大样本儿童胶质瘤队列研究,毛细胞型星形细胞瘤比例最高,预后较好;胶质母细胞瘤发病率相对较低,预后较差。人口统计学信息、肿瘤特征和治疗方案均为儿童胶质瘤患者生存预后的预测因素,手术切除可降低除毛细胞型星形细胞瘤外其他组织学类型胶质瘤患儿的死亡风险;放疗可降低髓母细胞瘤患儿的死亡风险,但有可能增加毛细胞型星形细胞瘤患儿的死亡风险。
利益冲突 无

