脑转移瘤患者单纯手术治疗与手术联合术后脑部放疗对比分析
王月坤 刘磊 陈琬琦 王裕 马文斌
脑转移瘤是成人最常见的颅内恶性肿瘤,是导致死亡的重要原因之一[1]。约30%的实体肿瘤患者病程中可发生脑转移[2]。脑转移瘤患者的预后与多种因素相关,主要包括原发肿瘤类型及分子亚型、年龄、Karnofsky功能状态评分(KPS)、颅外转移、脑转移瘤数目等[3]。目前,对于脑转移瘤数目较少(1~3个)、体积较大(直径≥3 cm)和(或)产生占位效应及相关神经系统症状的脑转移瘤,推荐手术治疗[4];对于单发脑转移瘤,推荐手术联合全脑放射治疗(WBRT)为一线方案[5]。研究显示,针对单发脑转移瘤或存在1~3个转移灶、无相关神经系统症状的新诊断脑转移瘤患者,单纯手术治疗与局部治疗即手术联合术后脑部放疗[包括WBRT和立体定向放射外科(SRS)治疗]均可降低局部复发率,但对生存期的影响无显著差异[6];但有生存分析结果与之相反,认为行术后全脑放射治疗的患者生存期显著延长[7],提示手术联合术后脑部放疗可显著降低脑转移瘤患者脑部病灶复发率,但能否延长生存期尚无高级别循证医学证据。中国医学科学院北京协和医院脑转移瘤数据库建立于2017年,目前已纳入在我院单中心行脑部手术、脑部放疗和(或)就诊于脑转移瘤多学科诊疗模式(MDT)门诊的脑转移瘤患者共462例,本研究基于我院脑转移瘤数据库,总结脑转移瘤手术联合术前或术后脑部放疗的诊疗经验,并探究此类患者放疗获益的相关影响因素。
资料与方法
一、临床资料
1.纳入与排除标准 (1)北京协和医院脑转移瘤数据库中2011年1月1日至2018年12月31日诊治的脑转移瘤患者。(2)年龄>18岁。(3)脑转移瘤的诊断经术后组织病理学证实,原发肿瘤的诊断依据术后脑转移瘤组织病理学诊断、影像学和(或)颅外肿瘤组织病理学诊断。(4)排除原发肿瘤不明的患者。
2.一般资料 根据上述纳入与排除标准共纳入新诊断脑转移瘤患者141例,男性64例,女性77例;年龄23~78岁、平均(55±11)岁,其中≥65岁26例(18.44%)、<65岁115例(81.56%)。原发肿瘤分别为肺癌76例(53.90%),其中非小细胞肺癌69例(48.94%)、小细胞肺癌7例(4.96%),乳腺癌29例(20.57%),消化系统肿瘤14例(9.93%),泌尿系统肿瘤9例(6.38%),妇科肿瘤9例(6.38%),其他肿瘤为4例(2.84%);接受原发肿瘤局部治疗93例(65.96%),未接受局部治疗48例(34.04%);接受原发肿瘤系统治疗(化疗或靶向治疗)110例(78.01%),其中单纯化疗75例(68.18%)、单纯靶向治疗7例(6.36%)、先后行化疗和靶向治疗28例(25.45%),未接受系统治疗31例(21.99%);发生颅外转移40例(28.37%),其中发生肺转移占11.35%(16/141)、骨 转 移 占8.51%(12/141)、肝 转 移 占6.38%(9/141)、肾上腺转移占4.26%(6/141),无颅外转移占71.63%(101/141)。脑转移瘤呈单发112例(79.43%),呈多发29例(20.57%);肿瘤位于幕上106例(75.18%),幕下24例(17.02%),幕下和幕上11例(7.80%);出现神经系统症状122例(86.52%),无神经系统症状19例(13.48%);单纯手术(单纯手术组)91例(64.54%),手术联合术后脑部放疗(联合治 疗 组)50例(35.46%),其 中 行WBRT 10例(7.09%)、局部放疗24例(17.02%)、方案未知16例(11.35%)。联合治疗组患者原发肿瘤局部治疗比例高于单纯手术组(P=0.025),其余各项临床资料组间差异无统计学意义(均P>0.05,表1)。

表1 单纯手术组与联合治疗组患者一般资料的比较[例(%)]Table 1. Comparison of baseline characteristics of patients in neurosurgery group and neurosurgery combined brain radiotherapy group[case(%)]
二、研究方法
1.病例资料收集 本研究回顾性纳入患者临床数据,主要来源于医院信息系统(HIS)和随访记录,包括患者性别、年龄、原发肿瘤类型、神经系统症状、脑转移瘤数目和部位、脑部手术和术后放疗方案、系统治疗方案以及颅外转移情况。术后每6个月随访1次,评估患者是否生存。
2.统计分析方法 采用SPSS 22.0和R语言3.6.2进行数据处理与分析。计数资料以相对数构成比(%)或率(%)表示,采用χ2检验。生存分析起始事件为接受手术治疗或术后放疗,终点事件为死于脑转移瘤。生存时间为开始手术或放疗至出现死亡结局的时间间隔,绘制Kaplan⁃Meier生存曲线,比较两组患者生存期。全部患者进行亚组分析并制作森林图,采用似然比检验计算交互作用P值。联合治疗组预后相关影响因素的筛查采用单因素log⁃rank检验和多因素Cox回归分析(α入=0.05,α出=0.10)。进一步根据筛查的影响因素构建预后评分系统并进行生存分析。以P≤0.05为差异具有统计学意义。
结 果
Kaplan⁃Meier生存曲线显示,单纯手术组患者中位生存期为13.9个月,联合治疗组为21.9个月,组间差异有统计学意义(P=0.009,图1)。为探究接受脑部手术治疗的患者可以从联合治疗显著获益的亚组,对性别、年龄、脑转移瘤数目和部位、神经系统症状、颅外转移、治疗方案进行亚组分析,结果显示,尽管联合治疗组年龄<65岁(P=0.009)和原发肿瘤为非小细胞肺癌(P=0.003)等的患者生存获益优于单纯手术组,但联合治疗方案与各亚组之间并无交互作用(均P>0.05),即各亚组之间手术联合术后脑部放疗的生存获益与单纯手术治疗无明显差异(图2)。

图1 Kaplan⁃Meier生存曲线显示,联合治疗组患者中位生存期为21.9个月,长于单纯手术组的13.9个月(P=0.009) 图2 单纯手术组与联合治疗组患者生存获益亚组分析的森林图Figure 1 Kaplan⁃Meier survival curves showed that the median survival time of neurosurgery combined radiotherapy group was 21.9 months,and statistically longer than neurosurgery group with a 13.9 months of median survival time(P=0.009). Figure 2 Forest plot of subgroup analysis between neurosurgery group and neurosurgery combined radiotherapy group about the survival benefit.
对联合治疗组进行预后影响因素筛查,单因素log⁃rank检验显示,是否为非小细胞肺癌(P=0.027)、不同脑转移瘤数目(P=0.048)和部位(P=0.002)对应的生存曲线分布不同且差异具有统计学意义(表2)。结合单因素log⁃rank检验结果以及纳入与剔除标准将上述因素纳入多因素Cox回归模型,同时纳入临床认为的影响因素——性别、年龄、原发肿瘤类型、治疗方案等,结果显示,女性(RR=0.209,95%CI:0.077~0.567;P=0.002)、年龄≥65岁(RR=2.994,95%CI:1.066~8.411;P=0.037)、原发肿瘤为非小细胞肺癌(RR=0.175,95%CI:0.062~0.496;P=0.001)、脑转移瘤位于幕下(RR=0.065,95%CI:0.009~0.462;P=0.006)以及同时位于幕上和幕下(RR=0.130,95%CI:0.020~0.864;P=0.035)是倾向患者生存获益的影响因素(表3,4)。

表2 联合治疗组患者生存获益相关影响因素的单因素log⁃rank检验Table 2. Univariate log⁃rank analysis of survival time in neurosurgery combined radiotherapy group
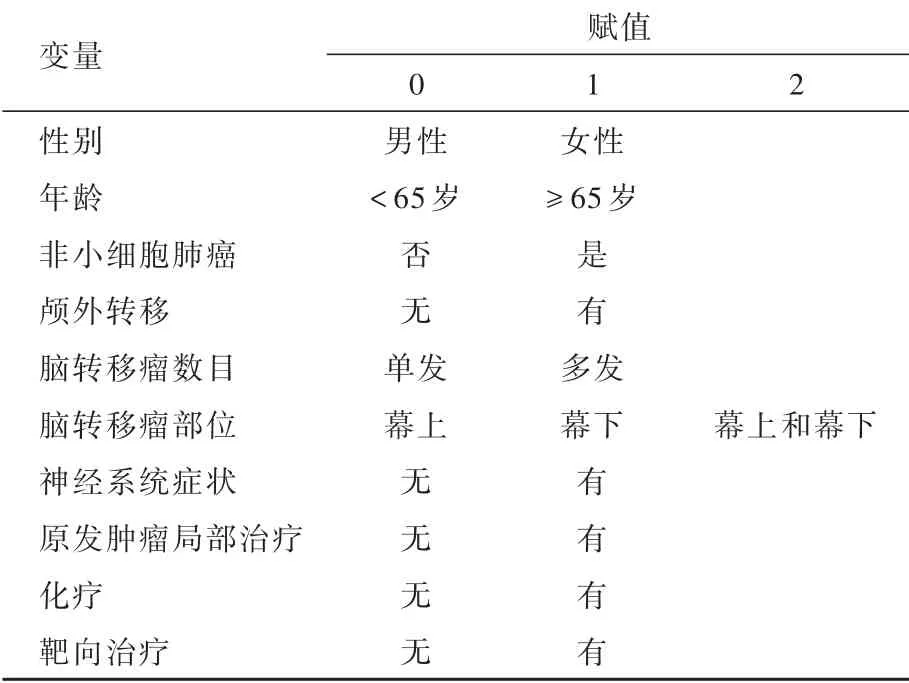
表3 联合治疗组患者生存获益影响因素变量赋值表Table 3. Variable assignments of survival analysis in neurosurgery combined radiotherapy group
根据多因素Cox回归分析结果建立预后评分系统,预后评分系统总分为性别、年龄、原发肿瘤为非小细胞肺癌、脑转移瘤部位这4项影响因素评分的总和(表5)。对于评分>4患者,联合治疗组中位生存期29.6个月,长于单纯手术组的13.9个月(P=0.023);评分≤4患者中位生存期组间差异无统计学意义(11.6个月对8.8个月,P=0.813;图3)。

图3 Kaplan⁃Meier生存曲线显示,对于评分>4的患者,联合治疗组中位生存期为29.6个月,长于单纯手术组的13.9个月(P=0.023);评分≤4的患者中位生存期组间差异无统计学意义(11.6个月对8.8个月,P=0.813)Figure 3 Kaplan⁃Meier survival curves for patients with different prognosis score between neurosurgery group and neurosurgery combined radiotherapy group showed that with a prognosis score >4,those in neurosurgery combined radiotherapy group had a significantly prolonged median survival time (29.6 months vs.13.9 months,P=0.023).For patients with a prognosis score≤4,there was no difference on the median survival time between 2 groups(11.6 months vs.8.8 months,P=0.813).
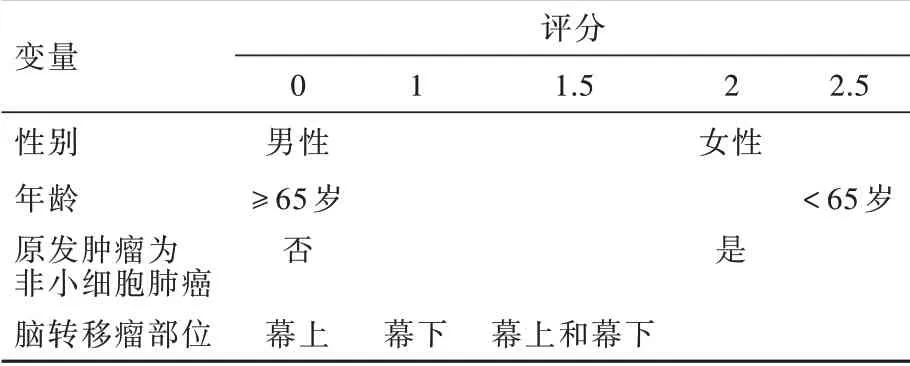
表5 预后评分系统Table 5. Formula of prognosis score
讨 论
本研究回顾性纳入在北京协和医院单中心接受手术联合术后脑部放疗的脑转移瘤患者,原发肿瘤主要为非小细胞肺癌和乳腺癌,脑转移瘤以单发幕上肿瘤为主,多数患者存在神经系统症状;生存分析显示,与单纯手术患者相比,手术联合术后脑部放疗的患者中位生存期延长,但能否延长总生存期仍存争议。
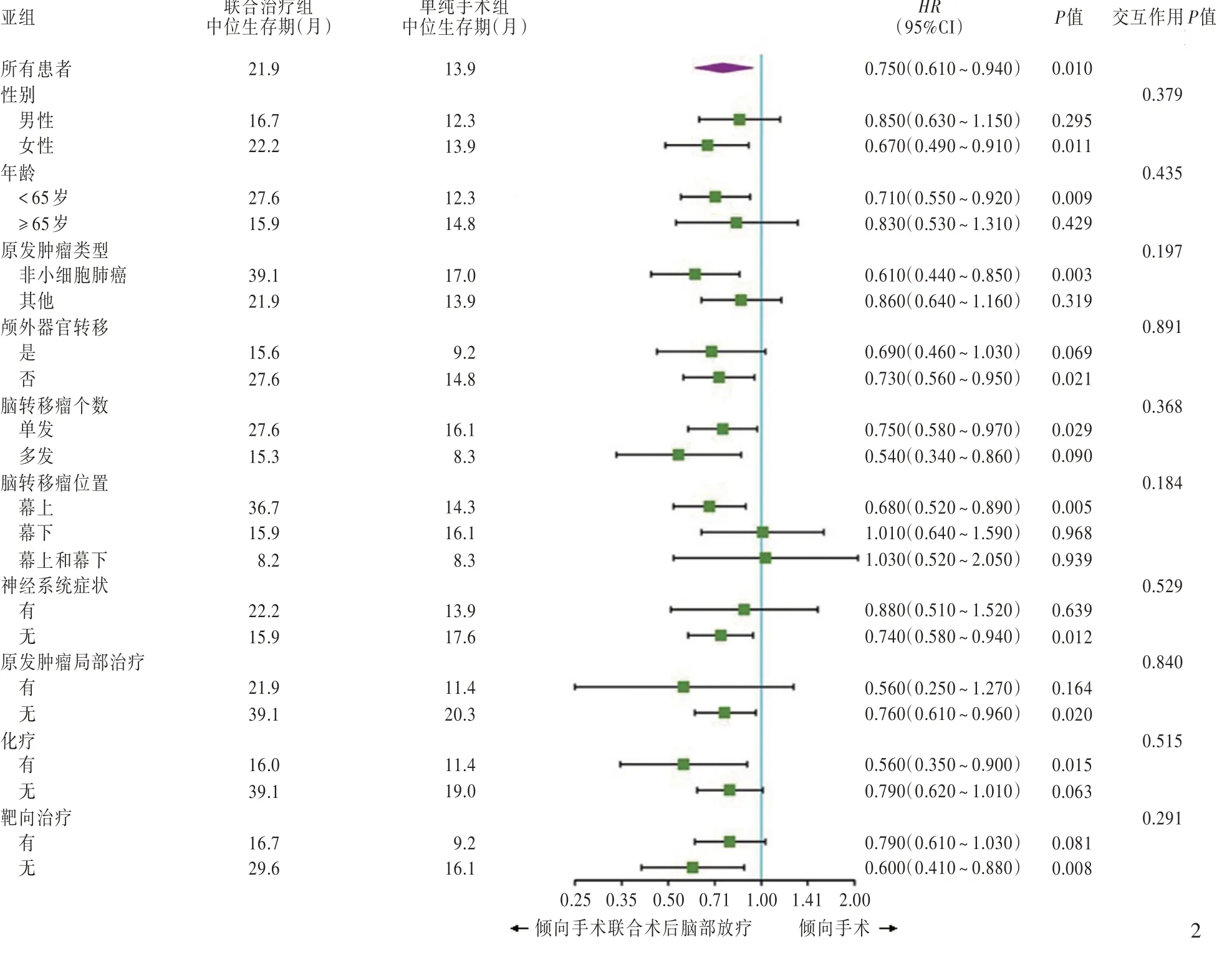
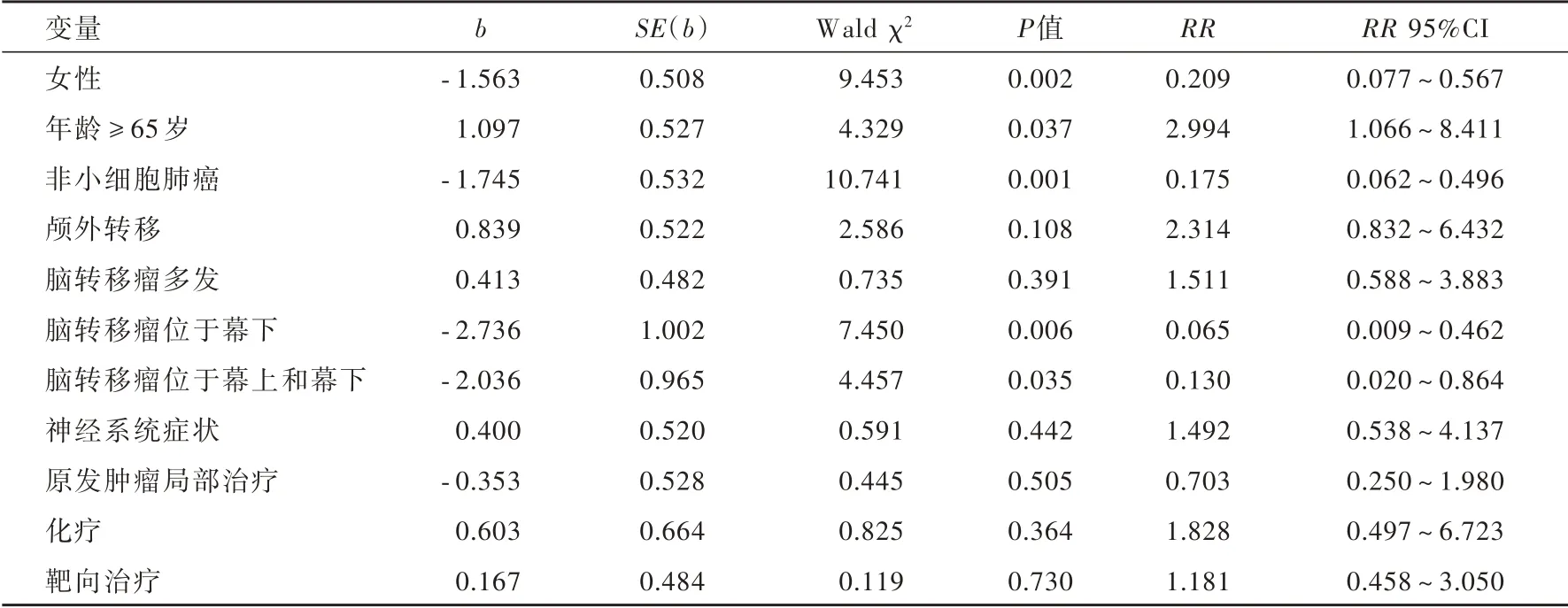
表4 联合治疗组患者生存获益影响因素的多因素Cox回归分析Table 4. Multivariate Cox analysis for survival time in neurosurgery combined radiotherapy group
Schackert等[8]发现,与单纯脑部手术相比,多发脑转移瘤患者手术联合术后WBRT可延长总生存期(8个月对1个月,P=0.03),而对于单发脑转移瘤患者,无论是术后联合WBRT还是SRS总生存期均无明显变化。针对存在神经系统症状的结直肠癌脑转移以及多种原发肿瘤来源的幕下转移病例的回顾性研究显示,脑部手术联合术后放疗可显著延长 总生 存 期[9⁃10]。Chaichana等[11]对多 种 原 发肿 瘤来源的幕下转移病例进行多因素Cox回归分析,发现手术联合术后脑部放疗是总生存期延长的影响因素,其中术后WBRT与生存期延长呈正相关(RR=0.458,95%CI:0.291~0.715;P=0.0006),而术后SRS与生存期无显著关联性。
Sakamoto等[12]纳入65例非小细胞肺癌脑转移患者,其中转移瘤数目为1~3个41例(63.08%)、≥4个20例(30.77%),脑部放疗可显著延长患者生存期,但并非患者预后影响因素。Mahajan等[13]开展一项Ⅲ期临床试验(试验编号:NCT00950001)纳入132例脑转移瘤患者,脑转移瘤数目均为1~3个,经过平均11.1个月的随访,发现单纯手术与手术联合术后SRS的生存期无明显差异(17个月对18个月,P=0.24)。WBRT和SRS方案对脑转移瘤患者预后的改善作用仍不确切。一项针对单发脑转移瘤患者的Ⅲ期临床试验(试验编号:NCT01372774)显示,术后联合SRS还是WBRT对生存期无明显影响,但联合WBRT的患者入组后6个月认知功能恶化率高于联合SRS的患者[14]。另一项临床试验对比单纯SRS与SRS联合WBRT对脑转移瘤患者(转移瘤数目1~3个)预后的影响,结果显示,SRS联合WBRT并不能有效延长生存期,且显著降低认知功能[15]。
Rotta等[16]纳入71例原发肿瘤以肺癌和乳腺癌为主的脑转移瘤患者,肺癌脑转移29例、乳腺癌脑转移24例,单因素log⁃rank检验显示,术后放疗并非生存获益的影响因素。一项针对非小细胞肺癌脑转移患者的回顾性研究亦显示,术后WBRT和(或)SRS并非生存获益的影响因素,但与术前未放疗或者术前单纯WBRT或SRS的患者相比,术前WBRT和SRS的 患 者 生 存 期 缩 短(HR=9.197,95%CI:1.717~49.261;P=0.001)[17]。尽管非小细胞肺癌脑转移患者的脑部治疗获益因素尚不明确,但手术联合术后脑部放疗仍有意义,即在驱动基因突变靶向治疗快速发展的背景下,脑转移瘤与原发肺癌基因组学特征存有较大差异这一论点的提出,提示尽可能行脑部手术获得病理标本有助于靶向治疗决策的 制 定[18⁃19]。一 项 纳 入351例 表 皮 生 长 因 子 受 体(EGFR)基因突变的非小细胞肺癌脑转移患者的单中心回顾性研究探讨SRS或WBRT联合靶向治疗的生存获益,结果显示,SRS联合靶向治疗的患者生存期显著延长,中位生存期达46个月[20]。Leone等[21]总结单中心行手术治疗的58例乳腺癌脑转移患者的诊疗经验,发现与未放疗患者相比,SRS和(或)WBRT对生存期的影响无显著差异;进一步筛查预后影响因素发现,雌激素受体(ER)阳性、孕激素受体(PR)阳性、人类表皮生长因子受体2(HER2)阳性的病理亚型并非预后影响因素。
欧洲神经肿瘤协会(EANO)2017年发表于Neuro Oncol的《脑转移瘤指南》、美国神经外科联盟(AANS)2019年发表于Neurosurgery的《脑转移瘤诊疗指南》以及美国国立综合癌症网(NCCN)发布的《中枢神经系统肿瘤指南2020年第2版》均指出,直径≥3 cm的脑转移瘤推荐手术切除,同时应综合一般情况和神经系统症状等评估结果;直径<3 cm或体积<20 cm3的脑转移瘤推荐SRS[4]。对于单发脑转移瘤患者,手术全切除患者的生存期长于次全切除患者(10.6个月对8.7个月,P=0.007)[22],但手术切除程度对手术联合术后脑部放疗的影响尚未明确。肿瘤大小和手术切除程度与脑转移瘤患者生存获益的相关性有待进一步研究。
为优化脑转移瘤患者手术联合术后脑部放疗方案,应进一步探究从该治疗方案中生存获益的亚组患者的临床特点和预后相关影响因素。本研究亚组分析和多因素Cox回归分析显示,女性、年龄<65岁、原发肿瘤为非小细胞肺癌、脑转移瘤位于幕下以及同时位于幕上和幕下患者,手术联合术后脑部放疗可使其生存获益。Ayas等[23]对手术联合术后脑部放疗的单发脑转移瘤患者的预后进行分析,发现年龄较小、KPS评分较高(≥80)、既往未行脑部放疗与总生存期较长呈正相关。一项Ⅱ期临床试验纳入29例手术联合术后SRS的脑转移瘤患者,进行平均12个月的随访,非小细胞肺癌、肿瘤直径<3 cm的患者局部复发率降低,而幕下肿瘤复发风险增加,但该项研究并未对总生存期进行分析[6]。
本研究根据单因素log⁃rank检验及多因素Cox回归分析筛查出的预后影响因素进行分析并构建预后评分系统,评分>4的患者推荐手术联合术后脑部放疗。目前,递归分区分析评分(RPA)及基于诊断的分级预后评分(ds⁃GPA)是临床广泛应用的脑转移瘤预后评分系统[3]。RPA评分包括年龄、KPS评分、原发肿瘤控制情况及有无颅外转移,可显著区分对手术和放疗方案不同应答的脑转移瘤患者[24]。ds⁃GPA评分包括年龄、KPS评分、颅外转移、脑转移瘤数目和特殊亚组,该评分对不同原发肿瘤来源的脑转移瘤建立不同的预后评分公式,至少包含上述因素的一项,对ds⁃GPA>1.0者推荐积极的手术联合术后脑部放疗的局部治疗方案[25]。Nieder等[26]对脑转移瘤患者进行的生存分析表明,ds⁃GPA评分可有效评估手术和术后WBRT的生存获益,但对总生存期<4个月的患者可能存在对生存期长短的误判。Aoyama等[27]对一项Ⅲ期临床试验(JROSG 99⁃1)的再分析表明,ds⁃GPA>2.5的非小细胞肺癌患者,SRS联合WBRT较单纯SRS更能延长患者生存期。Churilla等[28]对Ⅲ期临床试验(EORTC 22952⁃26001)的进一步分析得出不同结论,不同ds⁃GPA评分的非小细胞肺癌患者,单纯手术或SRS与手术或SRS联合WBRT对生存期的影响无显著差异,提示患者存在个体异质性,可以从手术联合术后脑部放疗中获益的患者亚群仍待进一步探究。
本研究尚存在一定局限性:(1)为单中心回顾性研究,纳入样本量有限,且患者之间存在异质性,数据记录的缺失和偏倚也不可避免,这种样本量和缺失信息的限制,在亚组分析和预后影响因素分析中,可能存在未发现的混杂因素,进而影响统计分析结果。(2)未对肿瘤大小、手术和放疗时间间隔等因素[29]对生存期的影响进一步分析。(3)未对不同放疗方案进一步分析[14]。(4)仅在具有手术适应证的患者中进行统计分析,可能不适用于其他患者。(5)单纯手术与手术联合术后脑部放疗对预后评分≤4的患者生存曲线差异无统计学意义,但未对相关神经系统症状和生活质量等进行分析,尚待进一步研究。
利益冲突 无

