ZFNet模型在胶质瘤MRI诊断中的应用
井奚月 乔婕 么秀华 徐立霞 闫华
胶质瘤是一种颅内占位性病变,发病率相对较高[1],2016年世界卫生组织(WHO)中枢神经系统肿瘤分类将胶质瘤分为WHOⅠ~Ⅳ级[2],我国胶质瘤年发病率(3.0~6.4)/10万,年病死例数高达3万例。其中,恶性胶质瘤发病率为5.8/10万,5年病死率仅次于胰腺癌和肺癌,位居全身肿瘤的第3位[3],治疗后中位生存期(MST)仅16个月[4],早期明确诊断、及时手术切除、术后尽早放疗可有效延长无进展生存期(PFS)[5]。胶质瘤组织活检或最大程度手术切除标本病理学检查是明确诊断的“金标准”,但为有创性检查或治疗[5],故临床实践中初诊疑似胶质瘤时首选头部MRI检查[6⁃8],初步提供肿瘤相关信息,包括肿瘤部位、大小和边界等[5⁃8],高质量的MRI检查结果可为神经外科医师提供可靠的手术方案依据,进而间接改善患者预后[9]。目前主要采取影像科医师人工阅片或分析报告的方式,依据疾病的影像学诊断指南和自身的临床经验,但人工阅片有其缺陷,不同阅片者的诊断水平和个人经验存有差异,主观判断可导致诊断结果不一致;随着影像学技术的发展,影像学检查越来越细致、图像数量越来越多,繁重的阅片工作量可导致影像科医师阅片效率和准确度下降[10⁃11]。
近年来,随着人工智能(AI)和计算机技术的飞速发展,通过深度学习(DL)技术进行医学影像识别与诊断成为可能[10]。卷积神经网络(CNN)是机器学习(ML)中颇受重视的算法之一[12],具有强大的分类能力,可直接输入原始图像,无需对图像进行复杂预处理,目前广泛应用于图像分类(包括医学影像领域)[13⁃15],进行疾病诊断,即通过医学影像训练、调整并完善卷积神经网络模型,达到识别医学影像中病灶部位和形态的目的[16⁃18]。卷积神经网络作为一种相对成熟的算法,目前的发展方式主要是加入更多的池化层以对图片进行更精确的分类[19]。AlexNet是卷积神经网络发展过程中的经典网络模型 之 一,由Krizhevsky等[20]于2012年提 出,应 用GPU显卡和ReLU激活函数,可显著提高学习训练速度,获得2012年ILSVRC(ImageNet Large Scale Visual Recognition Challenge)竞赛图像分类与目标定位(CLS⁃LOC)冠军。与上一代模型LeNet相比,AlexNet通过ReLU激活函数以实现非线性表达,减弱梯度消失现象,从而训练层数更多的网络。ZFNet模型在AlexNet基础上调整一些可视化细节,在每个卷积层增加一个对应的反卷积层,即输入为Feature Map、输出为像素,反卷积可视化过程包括反池化、ReLU和反卷积过程,卷积神经网络的最大池化过程是不可逆的,ZFNet模型采用近似实现方法通过转换变量记录每个池化区域中最大值位置,并在反池化过程中将该最大值返至其应该的位置,其他位置以数字0填充;反卷积过程亦称为转置卷积,即将卷积核进行转置,对下一卷积层进行卷积以获得上一卷积层的像素值;而网络结构本身并无明显变化[21]。鉴于此,本研究采用人工神经网络(ANN)相关机器学习算法,辅助影像科医师对胶质瘤患者头部MRI图像的人工阅片,以期改善人工阅片耗时、费力以及因个人经验不同导致阅片结果不同的缺陷。
对象与方法
一、研究对象
1.病例来源 本研究130例成年胶质瘤患者的头部MRI图像资料均来自TCIA(The Cancer Imaging Archive)数据库中的 REMBRANDT(Repository of Molecular Brain Neoplasia Data)数据(https://wiki.cancerimagingarchive.net/display/Public/REMBRANDT),图像格式为DICOM。男性78例,女性52例;年龄18~86岁,平均(53.85±15.31)岁;白种人114例(87.69%),黑种人或非裔美国人5例(3.85%),亚洲人7例(5.38%),未知4例(3.08%);新发胶质瘤128例(98.46%),复发胶质瘤2例(1.54%);生存8例(6.15%),死亡122例(93.85%);Karnofsky评分为40~100、其中位评分为80,40分1例(0.77%)、60分10例(7.69%)、70分1例(0.77%)、80分72例(55.38%)、90分3例(2.31%)、100分18例(13.85%)、评分缺失25例(19.23%)。
2.图像资料 本研究仅选取T1WI图像为研究对象,共40 036张,按照7∶3比例随机分为训练集(28 025张)和测试集(12 011张)。该数据库中每张图像均有医学专家的标注,根据标注,含肿瘤影像的图像定义为“肿瘤影像”、不含肿瘤影像的图像定义为“正常影像”。训练集中“肿瘤影像”12 498张、“正常影像”15 527张,测试集中“肿瘤影像”5641张、“正常影像”6370张。
二、研究方法
1.建模 直接应用ZFNet模型建立胶质瘤分类诊断模型。建模过程中自动在训练集中随机选取25%的图像(7006张)作为验证集,验证集可用于快速调整参数,即通过验证集进行超参数(如网络层数、迭代次数等)的选择,还可在训练过程中检测模型是否存在过拟合等异常情况,以决定是否提前终止训练。其余75%图像(21 019张)作为训练集,采用ZFNet算法针对训练集进行胶质瘤分类诊断模型的训练。绘制训练集的强化学习曲线,横轴为训练步数、纵轴为训练准确度,观察训练准确度随训练步数变化的趋势。采用ZFNet反卷积命令,在训练集中任意选取5张作为示例图像,进行ZFNet的可视化逐层展示。同时采用AlexNet对比建模。
2.模型效果评价指标 评价ZFNet模型对MRI图像的预测分类效果即预测诊断胶质瘤的能力,评价指标主要包括准确度(accuracy)、阳性预测值(PPV)、灵敏度(sensitivity)、特异度(specificity)和F1值(F1⁃measure)[22]。计算公式为:准确度(%)=(真阳性数+真阴性数)/全部目标数×100%,阳性预测值(%)=真阳性数/(真阳性数+假阳性数)×100%,灵敏度(%)=真阳性数/(真阳性数+假阴性数)×100%,特异度(%)=真阴性数/(真阴性数+假阳性数)×100%。其中,真阳性数指模型预测分类结果为“肿瘤影像”的所有目标中符合TCIA数据库“肿瘤影像”的图像数目;真阴性数指预测分类结果为“正常影像”的所有目标中符合数据库“正常影像”的图像数目;假阳性数指预测分类结果为“肿瘤影像”的所有目标中实际符合数据库“正常影像”的图像数目;假阴性数指预测分类结果为“正常影像”的所有目标中实际符合数据库“肿瘤影像”的图像数目。准确度、阳性预测值、灵敏度和特异度的取值范围为0~100%,越接近100%、模型预测分类效果越佳。F1值是反映模型预测分类效果的综合性指标,计算公式为:F1=2×阳性预测值×灵敏度/(阳性预测值+灵敏度)×100%,F1值越大、模型预测分类效果越佳。
结 果
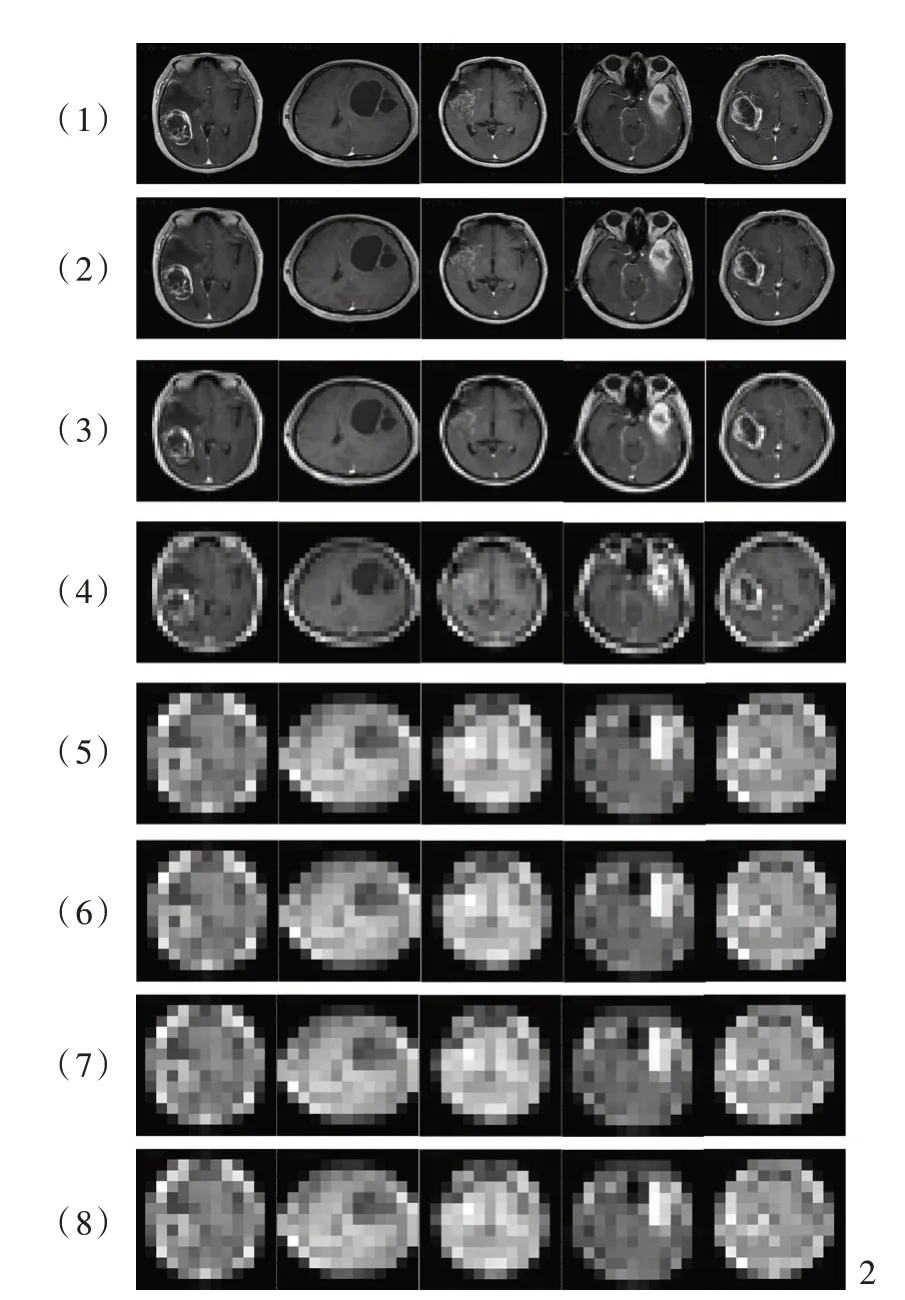
ZFNet模型结构和训练路径图如图1,最终建立的ZFNet模型深度共8层,由浅入深不断重复卷积池化过程;ZFNet模型可视化逐层展示如图2,可见同样的5张图像从第1层至第8层,Feature Map图像逐渐模糊,这是由于随着学习的进行,每层均对图像进行卷积或池化的信息提取整合,图像分辨率从第1层的225×225减至第8层的13×13,进而可以在低分辨率下提取更多的信息完成训练。
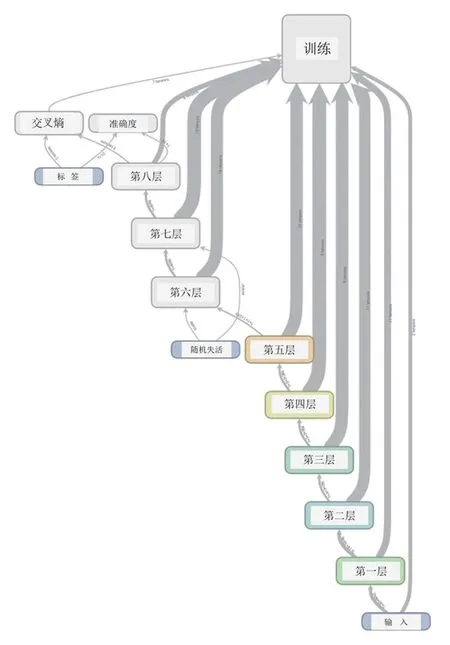
图1 ZFNet模型结构和训练路径图 图2 ZFNet模型可视化逐层展示(第1~8层)Figur e 1 Structure and training path of the ZFNet model. Figure 2 Examples of visualization of the ZFNet model(layer 1-8).
绘制训练集28 025张图像的强化学习曲线,ZFNet模型在最初训练的10 000步内,训练准确度迅速升高,此后趋于平稳,最终在训练38 757步后,训练准确度稳定为99.7%(图3);将测试集12 011张图像导入ZFNet模型,ZFNet模型预测“肿瘤影像”的准确度为84.42%(10 140/12 011),阳性预测值为80.77%(4817/5964),灵敏度为86.93%(4817/5541),特异度为82.27%(5323/6470),F1值为83.74%(表1)。AlexNet模型则在训练37 984步后,训练准确度稳定为98.23%;将测试集12 011张图像导入AlexNet模型,AlexNet模型预测“肿瘤影像”的准确度为80.74%(9698/12 011),阳性预测值为77.68%(4529/5830),灵敏度为81.74%(4529/5541),特异度为79.89%(5169/6470),F1值为79.66%(表2)。由此可见,ZFNet模型在各个维度的分类性能均优于AlexNet模型,且ZFNet模型可实现逐层可视化,这是AlexNet模型不具备的功能。

表1 ZFNet模型混淆矩阵(例)Table 1. Confusion matrix of ZFNet model test(case)

表2 AlexNet模型混淆矩阵(例)Table 2. Confusion matrix of AlexNet model test(case)
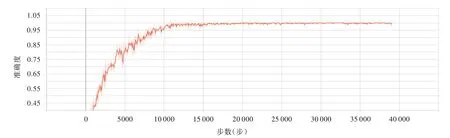
图3 强化学习曲线可见ZFNet模型训练准确度随训练步数的变化趋势Figure 3 Reinforcement learning curve showed the tendency chart of training accuracy changed with the training steps of ZFNet.
讨 论
近年来,随着人工智能和计算机技术的飞速发展,通过深度学习技术进行医学影像识别与诊断成为可能[10]。深度神经网络(DNN)在图像分类领域的优势是,无需以人工方法进行的图像特征提取作为第1步,而是在计算机运算过程中自动进行图像特征提取,节省人力成本[23]。然而,经典的深度学习算法同样有其局限性,即模型对输入对象学习充分与否及对其最终预测的分类准确性通常依靠输入对象的样本量,大样本的输入是模型可以获得较好预测效果的根本保障,因此实际上单独一所医院的临床数据难以采用深度学习算法建立完美的预测模型[24]。
TCIA数据库是国际公认的囊括常见肿瘤(如肺部肿瘤、脑肿瘤等)医学图像的大规模开放数据库,由美国国家癌症研究所(NCI)癌症影像计划资助、阿肯色大学医学科学院管理,图像模态包括MRI和CT等,其图像存储格式主要是DICOM格式。本研究基于TCIA数据库纳入130例成年胶质瘤患者共计40 036张头部MRI图像,按照7∶3比例随机分为训练集(28 025张)和测试集(12 011张),较好地避免了样本量过小的问题,保证了ZFNet模型对MRI图像的充分强化学习。绘制训练集的强化学习曲线,ZFNet模型在训练38 757步后训练准确度稳定为99.7%,AlexNet模型则在训练37 984步后稳定为98.23%;将测试集导入模型,ZFNet模型预测“肿瘤影像”的准确度为84.42%(10 140/12 011)、阳性预测值为80.77%(4817/5964)、灵敏度为86.93%(4817/5541)、特 异 度 为82.27%(5323/6470)、F1值 为83.74%,AlexNet模 型 为80.74%(9698/12 011)、77.68%(4529/5830)、81.74%(4529/5541)、79.89%(5169/6470)和79.66%,ZFNet模型在各个维度的分类性能均优于AlexNet模型,效果满意。
人工智能在胶质瘤影像学诊断中的应用主要是分级诊断[25],涉及的模型和算法包括Logistic回归(LR)、支持向量机(SVM)和随机森林(RF)等浅层机器学习算法,可对胶质瘤患者的MRI图像进行纹理分析[26⁃31],但浅层算法在结构上较为简单,隐层节点层数较少,可看作仅有一层隐层节点(如支持向量机)或无隐层节点(如Logistic回归),与深度学习算法相比,易出现梯度弥散现象,从而使训练结果陷入局部最优困局[32]。2006年神经网络之父Hinton教授提出,包含多个隐藏层级结构的人工神经网络的表征学习能力较强,通过逐层训练的方法可解决浅层机器学习算法局部最优的问题,至此深度学习算法步入飞速发展的时期[32]。本研究采用的ZFNet模型是一种深度神经网络,在每个卷积层增加一个对应的反卷积层,反卷积可视化过程包括反池化、ReLU和反卷积过程,从而较好地避免浅层算法的局部最优困局[21]。最终建立的ZFNet模型深度共8层,由浅入深不断重复卷积池化过程,并实现逐层可视化,随着学习的进行,每层均对图像进行卷积或池化的信息提取整合,图像分辨率从第1层的225×225减至第8层的13×13,进而在低分辨率下提取更多的信息完成训练,这是AlexNet模型不具备的功能。
综上所述,ZFNet模型在胶质瘤患者头部MRI图像分类预测方面的效果尚佳,可为建立胶质瘤影像学辅助诊断模型提供良好的技术支持。然而,本研究存在一定的局限性,纳入对象仅为TCIA数据库中T1WI图像的建模预测结果,未包含T2WI、FLAIR、DWI等其他扫描序列;MRI图像仅纳入横断面图像,未包括矢状位和冠状位图像,今后尚待根据扫描序列和投照位置进一步归类整理图像,以达到提高模型分类预测准确度的目的。
利益冲突 无

