以突发呼吸困难为表现的急性迟发性膈疝1例并文献回顾
付杰 尹腾飞 刘金广 魏广友 郑爱华 李亚楠
作者单位:236800 安徽 亳州,亳州市人民医院1.儿科重症监护室、2.小儿腹壁疝外科
急性迟发性CDH是一种可以致命的小儿临床急症。该类患儿一般起病突然,发展迅速,因有多种临床表现,常被误诊为胸腔积液、肺炎或气胸。及时有效的治疗是降低病死率,取得良好预后的关键。但治疗过程中应及早识别,以避免漏诊、误诊。现报道我院1例以突发呼吸困难为临床表现的左侧巨大膈疝患儿,并复习相关文献。
病例资料
患者,女,1个月25天。因“代诉:呻吟、气促4小时余”于2019年11月13日11:46入院。患儿入院4小时余前异常哭闹后出现呻吟、气促、吐沫,无青紫发作,无抽搐,无发热,无咳嗽,无呕吐,家人为诊治携患儿至xx医院,给予吸氧、苯巴比妥镇静、头孢曲松(罗氏芬)抗感染、呋塞米利尿治疗,完善胸部CT(见图1)示:肺炎、左侧气胸、胸腔积液,后为进一步治疗吸氧下急转入我院,拟“重症肺炎、左侧气胸、胸腔积液”收住我科。入院查体:T 36.7 ℃ P 180次/分 R 62次/分 BP 121 /66 mmHg W 3.22 kg SPO294%(吸氧下),神清,精神反应欠佳,呻吟明显,呼吸急促,吐沫,营养发育欠佳,全身皮肤稍发花、苍白,毛细血管再充盈时间3~4 s,皮肤弹性尚可、无皮疹,双瞳孔等大等圆,对光反射存在,鼻翼煽动,颈软,胸廓饱满,三凹征阳性,双肺呼吸音粗,可闻及湿罗音,左肺呼吸音低,呼气无延长。心率180次/分,心律齐,心音有力,未闻及明显病理性杂音。腹膨软,未及包块,无肌紧张,肝脾脏肋下未及,肠鸣音正常。生理反射存在,病理反射未引出,四肢肌张力正常。入院后辅助检查;随机血糖10.4 mmol/L,血气分析示:乳酸2.0 mmol/L,PH 7.34 PCO248.3 mmHg,PO296.8 mmHg,实际碱剩余0.2 mmol/L,血常规示白细胞计数14.27×109/L,中性粒细胞百分比66.40 %,淋巴细胞百分比27.00 %,红细胞计数2.54×1012/L,血红蛋白83.00 g/L,红细胞压积0.245,血小板计数415×109/L。肝肾功示:总蛋白 55.8g/L,白蛋白37.3 g/L,谷丙转氨酶37 U/L,谷草转氨酶36 U/L,尿素4.15 mmol/L,肌酐 18 μmol/L,心肌酶谱示肌酸激酶196 U/L,肌酸激酶同工酶34 U/L,电解质、凝血正常,肌钙蛋白Ⅰ 0.028 ng/mL,NT-ProBNP 648 pg/mL,因患儿膈疝不能除外,完善上消化道造影检查,提示膈疝(见图2),请小儿外科会诊考虑左侧膈疝,征得家人同意后于11月13日22:35在全麻下行胸腔镜下左侧膈疝修补术,麻醉成功后,患者取右侧卧位,常规消毒手术区,铺巾。取左侧第3肋间腋中线切口0.5 cm,建立气胸,压力约5 mmHg,分别于左侧第6肋腋前线及左侧第4肋腋后线切口进0.5 cm,0.5 cmTrocar建立操作孔道,探查胸腔见胸腔内肺已压缩,胃、脾脏及部分肠管疝入胸腔(见图3),暂时增大胸腔压力至10 mmHg,还纳腹腔内容物后维持胸腔压力约3 mmHg,见疝环位于左侧膈肌角后外侧缘(见图4)。疝环直径约5 cm,给予不可吸收缝线间断缝合,关闭膈肌疝环,并在膈肌角处的体表投影缝合膈肌角固定于肋缘,再次探查胸腔内无活动性出血及渗漏,置负压引流球自腋前线切口穿出,清点器械敷料无误,膨肺后见左肺复张可,可吸收线缝合皮下组织,术中经过顺利,术后患儿于23:40安返儿科重症监护室,入科后立即接呼吸机辅助呼吸,头孢曲松钠抗感染治疗。术后复查血常规,示白细胞计数12.81×109/L,中性粒细胞百分比69.60 %,淋巴细胞百分比23.00 % ,红细胞计数2.35×1012/L,血红蛋白76.00 g/L,红细胞压积0.235,血小板计数412×109/L,生化示总蛋白49.7 g/L,白蛋白32.7 g/L,肌酸激酶(MB)同工酶171 U/L,超敏C反应蛋白10.20 mg/L,余肝肾功、电解质、心肌酶正常,降钙素原0.080 ng/mL,腹部B超示胰腺及胆囊显示不清,左侧腹部无回声区-局限性积液可能,盆腔少量积液。贫血存在,输注A型去白红细胞悬液48 mL。复查胸片(见图5)示两肺纹理增多、模糊,纵隔区及左肺野低密度影。11月15日复查血气分析示Ph值7.44,二氧化碳分压31.3 mmHg,氧分压77.3 mmHg,实际碱剩余-1.8 mmol/L,基本正常,患儿自主呼吸活跃,予拔管撤机改鼻导管吸氧,并予布地奈德雾化吸入减轻喉头水肿;患儿无呕吐,肠鸣音存在,予试喂糖水可耐受。11月17日生命体征平稳,拔除胸腔引流管,停吸氧;11月21日患儿术后恢复可,嘱避免受凉及剧烈哭闹予出院。出院2周门诊随访胸片无异常(见图6)。
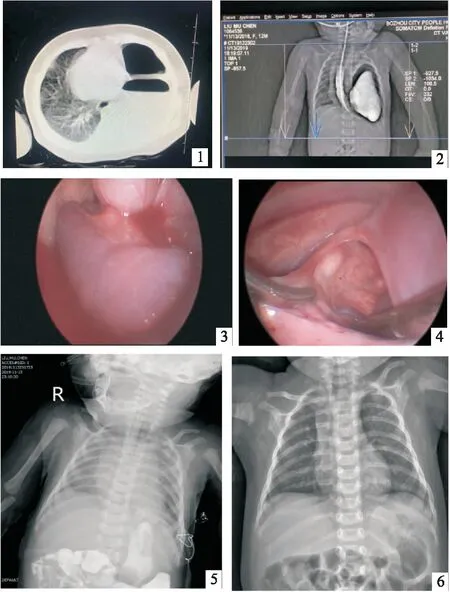
图1 外院胸部CT 图2 上消化道造影图 图3 腔镜下脾脏疝入胸腔 图4 腔镜下疝环 图5 术后复查床边胸片 图6 出院后2周胸片
讨 论
先天性膈疝(congenital diaphragmatic hernia,CDH)是一种罕见的膈肌发育性缺损,其特征是腹部内容物疝入胸部,导致不同程度的肺发育不全和肺动脉高压(PH)[1]。CHD常发生于婴幼儿,目前 CDH 发病率约为1 ∶2 500~1 ∶5 000,发病原因还不明确,其常常合并心血管、泌尿系统、骨骼肌肉系统及中枢神经系统畸形,结构畸形和染色体畸形发生率为35%~50%[2]。尽管经过几十年的研究,CDH的诊断和治疗取得了许多进展,但发病率和死亡率仍然很高,约27%[3],早产儿可能更高[4]。据报道同时合并其他结构异常和染色体异常的患儿病死率接近100%[5]。而其根本原因在于出生后的各种治疗并不能改善患儿已存在的肺动脉高压(PH)、肺发育不全和心功能不全肺发育不良。
CDH根据横膈膜缺损的位置,疝气可以分为不同的类型。Bochdalek疝是由膈肌后外侧缺损引起的,是最常见的类型(70%~75%),大多数发生在左侧,较少发生在右侧,且右侧CDH的死亡率明显高于左侧[6]。Morgagni疝由隔膜前内侧缺损(20%~25%)引起,而中央疝占2%~5%。双侧缺损非常罕见,并与预后不良有关。
CDH临床表现复杂多样,常见的临床表现为突然呼吸困难、咳嗽、气喘等呼吸道感染症状,甚至部分患儿因呕吐为主诉入院,若医生观察不细致,亦造成延误诊断与治疗造成严重的后果。
CHD的产前诊断主要依靠影像学检查。其中超声是产前诊断CHD最为有效、最为常用的的检测手段,具有无创、安全、可重复等特点,便于早期诊断及随访观察[7]。约60%的CDH患儿可通过产前超声检查确诊[8]。由于不同的临床表现,晚期出现或复发的膈肌缺损对诊断具有挑战性。目前的诊断方法包括用X线片进行初步评估,并辅以其他影像诊断方法主要有透视、超声、CT、MRI等。胸片单独检查有很高的误诊率,而透视检查不能描述相关实体器官的异常。超声具有实时评估的优点和相对容易的可访问性,MRI能够显示横隔肌不连续,亦能准确描述疝内容物,缺陷的位置和大小,是一种有用的晚期表现或复发膈疝诊断评估工具。但MRI检查的挑战包括较长的检查时间、对最优顺序的要求和镇静剂的使用,临床工作应注意[9]。临床研究表明,胎儿MRI比产前超声更准确地预测重度肺发育不全,提示胎儿MRI在产前评估CDH是一个有价值的辅助手段[10]。该患儿系1月余小婴儿,外院胸部CT提示气胸,膈疝待排,考虑患儿病情危重,选择了上消化道造影得以明确诊断,提示上消化道造影亦是一种膈疝诊断的方法,另外临床工作中,临床表现与辅助检查存在异议时,可以选择另外一种检查方法进行验证诊断,以提高诊断准确率。
CDH是儿童危重症之一,重症先天性膈疝常常合并较重的肺发育不良及持续肺动脉高压[11],其病死率高,术后生存质量亦较差。手术是治疗CDH的选择,但手术策略仍存在争议,主要取决于术者的训练和偏好。研究发现经开胸术后CDH修复在出生后1年内的手术再干预率较开腹术高[12]。自2001年Becmeur等[13]首次报道胸腔镜在先天性膈肌修复中的应用,对CDH进行了一系列的实践研究已经证明了该技术的理论优势例如减少组织创伤、疼痛和皮肤美容畸形,该技术也已逐渐得到广泛应用。研究发现腹腔镜和胸腔镜下无明显差异,但由于手术技术难度大,且有复发的可能性,胸腔镜下对CDH晚期的修复效果较好[14]。然而,亦有研究也提出手术涉及到胸腔镜晚期CDH的修复是困难的,复发率很高,但它可以通过将手术重点转移到手术细节上,降低复发率[15]。Ali Kamran等亦认为胸腔镜CDH修复后的复发率高于标准开放式修复方法,建议进行夹层式支撑修复[16]。而对于缺损较大的膈疝,有学者建议应优先考虑用人工补片,从而达到无张力膈肌修补[17]。但国外有学者亦对胸腔镜术中引起的的低体温[18],高碳酸血症和酸中毒可能导致缺血性脑损伤存在质疑[19]。但该患儿通过胸腔镜修补膈疝,疗效确切,创伤小,花费低,临床价值值得肯定,至于术后是否存在复发可能,还需进行长期的临床观察、随访。
随着目前产前胎儿镜下气管堵塞术,围术期监护、胸腔镜膈疝修补术以及ECMO等辅助治疗技术不断提高,CDH患儿的病死率已较以前明显下降[20-23]。对于病情较轻的 CDH可行胸腹腔镜手术;对于较大的膈肌缺损或未完全发育的膈肌,目前认为采用外科手术将疝入胸腔的脏器还纳入腹腔,并同时进行膈肌修复术[24]。对于手术修补时机,前期急诊手术能解除了肺受压,但肺动脉高压未能纠正,还可能降低肺顺应性,增加术后急性呼吸窘迫的发生率,潜在提高了CDH患儿的病死率。目前多认为应先进行内科治疗,待患儿肺动脉高压改善后再进行手术治疗,有助于提高手术的成功率、减少并发症[25-30]。陈栋等[28]亦发现胎膜早破、术后机械通气时间、肺不张、氧合指数大于5.74是CDH患儿术后死亡的高危因素,通过适当延期手术,稳定内环境,CDH患儿术后死亡率可有效降低。而手术选择也逐渐从急诊手术转变为待患儿呼吸功能和血流动力学稳定后择期手术[27]。本例患儿因突发呼吸困难,在外院进行胸部CT检查,早期考虑肺部感染、气胸可能,入我院后及时予上消化道造影明确为左侧膈疝,其疗效好的原因考虑该患儿虽然存在张力性胃胸,但未存在肺发育不良和肺动脉高压,通过及时给予胃减压术减轻了胃对肺、心脏的压迫,稳定内环境后给予胸腔镜微创修补,得到了较好的临床疗效。亦提示我们在临床遇到呼吸困难、青紫等肺部表现异常的患儿,除考虑常见的肺部感染、气胸、先天性心脏病等疾病外,亦应排除膈疝、食管闭锁、食管气管瘘等外科疾病,以减少漏诊、误诊,提高自身诊疗水平。总之,该例患儿临床诊断急性迟发性膈疝,临床少见,对于临床该类患儿的早期识别、诊断及治疗有着较高的指导及借鉴意义。
通过相关文献复习,目前发现CDH患儿的孕周、产后Apgar评分、出生体重、是否有胎儿水肿、羊水量多少、PPHN、肺发育不良程度、有无肝膈疝[31]、心功能障碍[32]、是否需要较高的初始峰值吸气压/高频通气、是否需要贴剂闭合[33]、是否合并其他畸形、膈肌缺损的部位和大小、腹腔器官疝入胸腔的多少等因素均影响CDH胎儿的预后。CDH存活者有大缺陷、长期使用机械通气或接受ECMO治疗可能增加胃食管反流、胃轻瘫和大胃肠手术的风险[34]。与是否选择腔镜手术则无明显关系[35]。此外,肺动脉高压持续时间、较长肺保护性通气、营养、感染预防和PH的早期积极处理以及血清B型利钠肽水平( B-type natriuret-ic peptide,BNP) 等均与预后有一定关联。

