程序性死亡蛋白-1及其配体抑制剂在妊娠滋养细胞肿瘤中的应用进展
肖萍,尹如铁
妊娠滋养细胞肿瘤(gestational trophoblastic neoplasia,GTN)是一组来源于妊娠滋养细胞的少见的妇科恶性肿瘤,是一类大部分患者可能通过化疗治愈的疾病。包括侵蚀性葡萄胎(invasive mole,IM)、绒癌(choriocarcinoma,CC)、胎盘部位滋养细胞肿瘤(placental site trophoblastic tumor,PSTT)、上皮样滋养细胞肿瘤(epithelioid trophoblastic tumor,ETT)。根据FIGO 2000年评分标准分为高危和低危患者,低危患者总体生存率可达100%,高危患者可高达90%[1]。然而,仍有少数患者因耐药复发而死亡。近年来,免疫治疗在各类恶性肿瘤治疗中的探索如火如荼,也为难治性GTN患者提供了新的选择与希望。其中免疫监测点抑制剂研究最多,程序性死亡蛋白-1(programmed cell death protein 1,PD-1)及其配体抑制剂最受关注。本文复习文献,对 PD-1/程序性细胞死亡因子配体1(programmed cell death ligand 1,PD-L1)抑制剂在难治性GTN中的研究现状做一总结,以期为临床诊治提供帮助。
1 程序性死亡蛋白-1/程序性细胞死亡因子配体1与肿瘤
PD-1是由Pdcd1编码的I型跨膜蛋白,在活化的T细胞、B细胞、单核细胞、 NK细胞、骨髓细胞以及树突状细胞中均有较高表达。PD-1有两个配体,PD-L1及PD-L2,均为B7家族的成员。PD-L1广泛表达于T细胞、B细胞、单核巨噬细胞、树突状细胞等免疫相关细胞,以及内皮细胞、胎盘细胞、胰岛细胞和大多数肿瘤细胞[2-3]。PD-L2主要表达于树突状细胞、单核细胞、肥大细胞、B细胞,在内皮细胞及T细胞中少量表达。PD-L1及PD-L2相对独立地调控细胞的反应[4],PD-L1与PD-1结合后通过抑制T、B细胞的活性来防止自身免疫疾病及肿瘤的发生[5-6],而PD-L2主要参与调控自然环境抗原引起的免疫或耐受反应[7]。
一系列研究结果显示,PD-L1在多种肿瘤细胞中高表达,如黑色素瘤、肺癌、肾透明细胞癌、尿路上皮癌、头颈部鳞癌等[8-10]。在肿瘤微环境中,PD-1/PD-L1通路被激活,T、B细胞活性受到抑制,肿瘤细胞因此获得免疫逃逸。PD-1及PD-L1抑制剂可阻断PD-1/PD-L1通路,使得T、B细胞活性增强,从而提高对肿瘤细胞的识别及攻击,达到抗肿瘤的作用。目前PD-1/PD-L1抑制剂共有7种,包括PD-1抑制剂:Nivolumab、Pembrolizumab、Cemiplimab、Camrelizumab,PD-L1抑制剂:Atezolizumab、Durvalumab、Avelumab,已用于多种恶性肿瘤的治疗,并取得了一定的疗效[11-12]。
2 妊娠滋养细胞肿瘤中程序性细胞死亡因子配体1的表达及意义
查阅多个数据库发现有关PD-L1在GTN中表达研究的英文文献4篇,中文文献仅1篇。约翰霍普金斯医学院的学者Emanuela Veras等[13]对16例早孕流产组织、5例足月产胎盘、7例完全性葡萄胎、11例胎盘部位结节、35例CC、6例PSTT、14例ETT标本进行免疫组化染色,发现PD-L1在流产组织及正常胎盘组织的合体滋养细胞的外层细胞中高表达,但在细胞滋养细胞及中间滋养细胞及胎盘植入部位不表达或局部弱表达。在完全性葡萄胎、CC的合体滋养细胞中高表达,但在PSTT、ETT中不表达或相对较低地表达。细胞滋养细胞不表达PD-L1,但在种植部位、中间滋养细胞中有表达。北京协和医院向阳教授团队[14]对68例CC、33例PSTT、11例ETT进行PD-L1的免疫组化检测。结果显示,CC、PSTT、ETT中的PD-L1均高表达,前两者的表达强于后者。Bingjian LU等[15]研究也得出了类似的结果。但PD-L1的表达与FIGO分期、预后评分、完全缓解(complete remission,CR)率等均无明显相关。Bloze等[16]的研究也显示,PD-L1的表达与FIGO分期、预后评分、妊娠结局及化疗敏感性无关。
3 程序性死亡蛋白-1/程序性细胞死亡因子配体1抑制剂在GTN中的应用现状
2019年GTN的NCCN指南中,将PD-1/PD-L1抑制剂纳入多药耐药GTN的治疗方案,但PD-1/PD-L1抑制剂治疗GTN的报道很少。2017年9月首次报道Pembrilizumab治疗1例多药耐药多发远处转移的CC患者取得了令人满意的效果,截止目前共有病例报道8例(详见表1),其中6例达到CR,1例报道时达到部分缓解(partial remission,PR),1例无效。获CR的其中1例患者停药22个月。7例患者均为高危多药耐药或复发患者,治疗疗程4~15个,巩固疗程3~5个。不良反应包括肝功能损害、关节痛、皮肤瘙痒、滑膜炎、皮疹、中性粒细胞减少、周围神经病变等,多为I~II级,其中1例患者因III级肝功能损害而停药,肝功能恢复后药量减半继续治疗至CR。1例因III级周围神经病变停药,仅巩固3个疗程。
8例患者均检测了PD-L1的表达,获得CR患者的PD-L1表达率均>90%或100%,而治疗失败患者的表达率为50%。
查阅Clinical Trial网站,显示目前已注册的PD-1/PD-L1抑制剂治疗GTN的临床试验有4项。法国的TROPHIMMUN研究(NCT03135769),预计纳入29例单药或多药耐药的GTN患者,评估Avelumab治疗疗效和毒副反应。截止2018年9月,该研究报道了3例单药耐药患者经Avelumab治愈后随访10.7个月无复发。韩国CHA大学注册的Pembrolizumab治疗难治性GTN的II期临床试验(NCT04303884),拟纳入15例病例,预计2022年5月1日总结初步结果,2023年5月1日试验结束。此外,法国的TROPHAMET临床试验(NCT04396223),预计纳入26例低危GTN患者,PD-L1抑制剂Avelumab联合甲氨蝶呤作为一线方案治疗,评估其安全性及有效性。该临床试验为I/II期临床试验,预计2022年6月1日统计初步结果,2023年7月1日试验结束。向阳教授团队注册了一项临床试验(NCT04047017),预计纳入20例接受至少两种联合化疗的复发耐药高危患者,接受Camrelizumab治疗,评估疗效、安全性等。试验预计2021年8月8日结束。期待这些研究能够积累更多的数据,验证PD-1/PD-L1抑制剂在GTN中的安全性及有效性。这3项临床研究的数据值得我们期待。
虽然PD-1/PD-L1抑制剂相关研究如火如荼,但因不同种类恶性肿瘤的异质性,PD-1/PD-L1抑制剂的客观反应率差异较大,疗效好可高达58%,疗效差则仅有4%[12]。对于大部分使用PD-1/PD-L1抑制剂的患者而言,药物不良反应小,耐受良好,但应重视免疫相关性不良反应的诊治。迄今为止报道的8例GTN患者中6例达CR。在GTN患者中,PD-1/PD-L1抑制剂的反应率明显高于其他恶性肿瘤,仅1例患者出现III级肝功能损害,但是样本量过少,值得临床扩大样本量进一步研究。
探索敏感的预测指标用于更好地指导免疫抑制剂在GTN治疗中患者的选择,可更好地分配资源,实行个体化治疗。据目前的病例报道结果显示,Pembrolizumab治疗后获CR患者的PD-L1高表达(>90%或100%),治疗失败者的PD-L1表达强度低(50%)。但样本量太小,GTN中PD-L1表达水平是否能预测PD-1/PD-L1抑制剂的反应率需进一步验证。
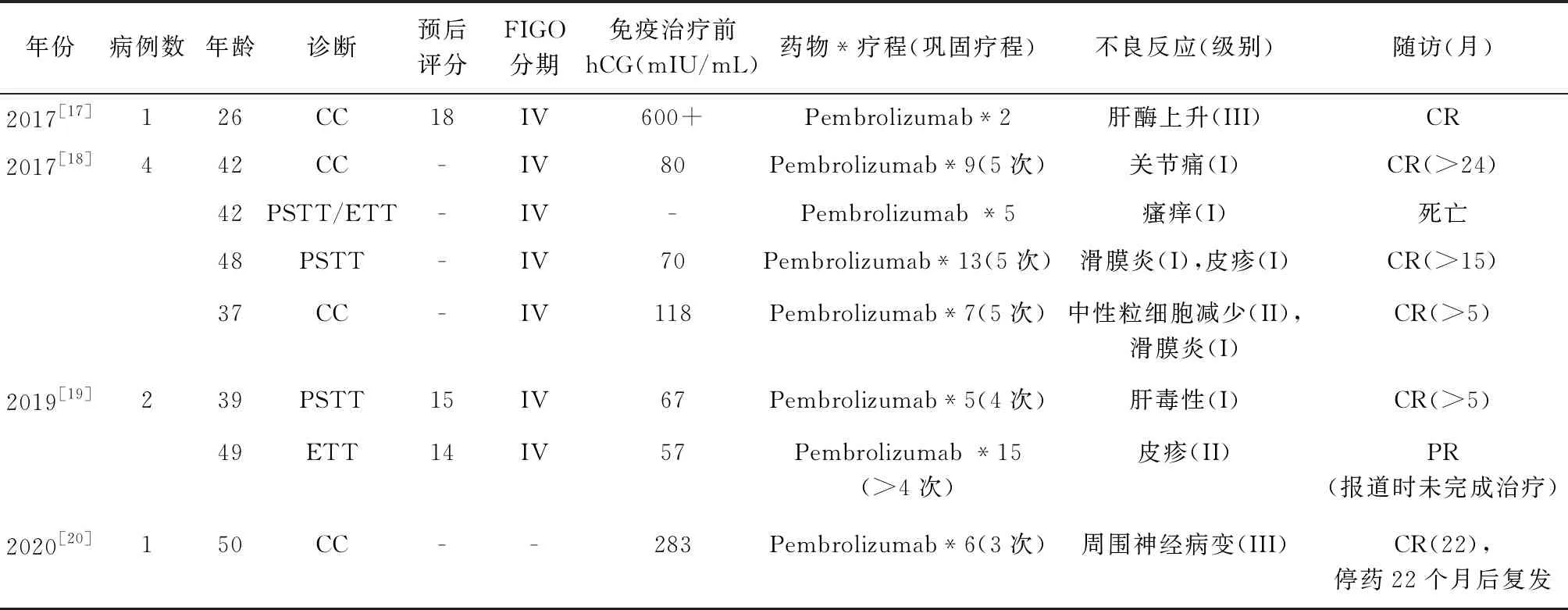
表 1 Pembrolizumab治疗8例GTN患者的临床特点
4 总结
目前有限的病例报道显示,PD-1/PD-L1抑制剂对耐药、复发的难治性GTN有良好疗效,且大部分患者不良反应小,耐受良好。但因样本量小、观察期有限,有效性、安全性、远期复发风险、对妊娠结局的影响等有待积累更多数据验证。

