沉默Bax Inhibitor-1基因对子宫肌瘤细胞凋亡的影响及机制研究
苗润燕,刘华,田源
子宫肌瘤是一种子宫肌层的良性肿瘤,在临床上非常普遍,调查显示子宫肌瘤在50岁以下女性中的累积发病率高达70%左右,且有逐年上升的趋势[1-5]。迄今为止,其病因及发病机制仍不清楚。既往大量研究证实在子宫肌瘤组织中调控细胞凋亡的B细胞淋巴瘤-2(B-cell lymphoma-2,Bcl-2)家族存在异常高表达,如抗凋亡相关基因Bcl-2的表达显著增加,而促凋亡基因Bax(Bcl-2 associated X protein)表达明显减少,这导致子宫肌瘤细胞中Bcl-2/Bax比值异常升高,上述现象提示Bcl-2/Bax调控的细胞凋亡障碍可能参与子宫肌瘤的发生、发展[6-8]。Bax抑制因子1(Bax inhibitor-1,BI-1)是近年来新发现的一种同时存在于动植物中的高度保守性细胞死亡抑制因子,广泛存在于肺、前列腺、心脏、胎盘等组织中[9-10]。BI-1是Bcl-2与Bax调控细胞凋亡通路上的重要调节蛋白,研究证实BI-1能够通过影响细胞内Ca2+浓度而调控线粒体功能从而影响Bcl-2/Bax对凋亡调节作用,如在多种恶性肿瘤组织中的表达显著增加的BI-1能够通过上述作用调控肿瘤细胞的增殖、凋亡等生物学行为,而促进肿瘤的进展[11-13]。然而在子宫肌瘤中BI-1的表达及其对子宫肌瘤细胞增殖及凋亡的影响尚无相关研究。本研究拟通过观察BI-1在子宫肌瘤组织中的表达,探讨其相关作用机制及在子宫肌瘤发生进展中的影响。
1 材料与方法
1.1 临床标本采集
选择2018年4月至2019年4月于延安市人民医院妇产科因子宫肌瘤行子宫切除术的患者20例,年龄(47.3±2.6)岁,均未绝经。瘤旁组织为肌瘤旁≥5 cm处正常子宫肌肉组织。术中待子宫离体后迅速采集新鲜组织约15~25 g,30 min内运回实验室进行-80℃储藏备用。20例患者中14例为多发性肌瘤(70%),6例为单发肌瘤(30%);肌壁间肌瘤12例(60%),混合性肌瘤8例(40%)。所有患者均经病理HE及免疫组化染色证实为子宫平滑肌瘤。
纳入标准:① 满足子宫肌瘤的病理学诊断;② 标本具有足量的对应瘤旁组织;③ 患者1年内未经任何肿瘤相关治疗,如服用免疫抑制剂、放疗或化疗等;④ 患者及家属对本研究目的表示知晓理解,并签署知情同意书。本研究经本院伦理委员会审批。
1.2 主要试剂
0.25%胰蛋白酶(美国Hyclone公司);Trizol试剂(美国Invitrogen公司);胎牛血清(FBS)、青链霉素混合液(均为100 U/mL)(杭州四季青生物公司);PCR试剂盒(上海康为世纪);PCR引物(上海生工);Opti-MEM培养基(美国Invitrogen 公司);靶向沉默BI-1的小干扰RNA(si-BI-1)及其阴性对照序列(si-negative control,si-NC)(上海吉玛生物);JC-1线粒体膜电位检测盒、Annexin V-FITC/PI凋亡检测试剂盒(江苏碧云天);兔抗Bcl-2、Bax、Cleavd-caspase-3、GAPDH单克隆抗体(美国Abcam公司);大鼠抗BI-1单克隆抗体(美国Santa Cruz公司);大鼠抗Cyt-C(美国Affinity公司);辣根过氧化酶(HRP)标记的山羊抗兔、抗大鼠IgG(广州晶彩生物公司);其他试剂均为国产分析纯。
1.3 方法
1.3.1 原代子宫肌瘤细胞的分离、培养及鉴定 取收集的肌瘤组织,胶原酶溶解法加差异贴壁法进行原代细胞的分离。使用含10% FBS,1%双抗的DMEM/F12培养液中进行培养分离所得的肌瘤细胞,并置于37℃、5% CO2恒温培养箱进行培养,待细胞生长融合至80%~90%以上时可使用胰酶进行消化传代。选取传代至第3代以后且生长状态良好的子宫肌瘤细胞,应用α-Actin进行免疫细胞染色进行纯度鉴定。
1.3.2 细胞转染及分组 转染前24 h,取处于对数生长期的子宫肌瘤细胞进行常规消化后,细胞计数,按1×106个/mL接种于6孔板中,待细胞生长融合至80%时,根据LipofectamineTM3000说明书方法将si-BI-1、si-NC转染入细胞中。将转染后的细胞置于培养箱中培养8 h后即可进行检测转染效率及后续相关实验。按细胞转染情况的不同将其分为3组:Control组,即正常培养未转染的肌瘤细胞;si-BI-1组,即转染BI-1的肌瘤细胞;si-NC组,即转染si-NC组。上述各组细胞均使用10% FBS,1%双抗的DMEM/F12培养液中,并置于37℃、5% CO2恒温培养箱进行培养。
1.3.3 CCK-8检测细胞增殖能力 收集生长状态良好的各组肌瘤细胞,进行常规消化后,接种至96孔板中,调整细胞密度至1×103个/孔,并向每孔加入200 uL含10% FBS的DMEM/F12培养液,置于培养箱中进行培养,待细胞生长融合至70%~80%时,弃除原培养液,更换为用不含血清的DMEM/F12继续培养细胞。分别于培养0 h、12 h、24 h、36 h、48 h时向每孔加入10 μL的CCK-8试剂,于培养箱中继续培养2 h后,用酶标仪于490 nm波长处检测每孔吸光度值(OD490),每个时间点每组设置5个复孔,绘制细胞的生长曲线。
1.3.4 Annexin V-FITC流式细胞术检测细胞凋亡 取生长状态良好的各组子宫肌瘤细胞, 130 g离心5 min,弃上清,收集细胞沉淀,用195 μL Annexin V-FITC结合液重悬细胞,并调整细胞至7×105个/mL,依次加入5 μL Annexin V-FITC及10 μL的碘化丙啶(PI)染色液,轻轻摇晃离心管以充分混匀后,室温下避光孵育半小时。300目滤膜过滤细胞团块后,进行流式细胞仪检测。实验单独重复3次。
1.3.5 JC-1法检测细胞线粒体膜电位水平 取生长状态良好的各组子宫肌瘤细胞进行常规消化后,PBS重悬细胞后并将细胞调整至5×105个/mL,取1 mL的细胞悬液于EP管中并加入0.5 mL的JC-1染色工作液,于37℃孵育20 min,4℃下800 g离心5 min,收集细胞沉淀, 重悬于1 mL的JC-1染色缓冲液中后,进行流式细胞仪检测。实验单独重复3次。
1.3.6 细胞内钙离子浓度测量 取生长状态良好的各组子宫肌瘤细胞进行常规消化后,调整至1×105个/mL,取100 μL的细胞悬液接种至6孔板中,待细胞生长融合至70%~80%时,在无血清培养基中孵育24 h,胰酶消化贴壁的细胞后,130 g离心5 min,收集细胞沉淀。对于细胞内Ca2+的测量,在上述细胞沉淀中加入3 uM Fluo-4 AM,并于培养箱中孵育20 min;对于线粒体中的Ca2+测量,在收集的细胞沉淀中加入3 uM Rhod-2 AM,并于4℃中进行孵育30 min。上述孵育后的细胞使用Hank’s 平衡液洗涤后,300目滤膜过滤细胞团块后,进行流式细胞仪检测。实验单独重复3次。
1.3.7 实时荧光定量PCR(RT-PCR) 采用Trizol法提取待测组织或细胞中总RNA,分光光度计检测浓度与纯度后,根据逆转录试剂说明书逆转录为cDNA。再按照RT-PCR试剂说明书及预实验确定的反应时间与温度进行实时定量,RT-PCR反应条件为:95℃(30s)预变性后,变性95℃(7 s)→退火60℃(30 s)→72℃(15 s),40个循环周期。RT-PCR引物为:BI-1上游引物为5′-CCTCTTCTGGTGGATGC-3′,下游引物为5′-GCCTCGCTCTGTTGATGTGA-3;GAPDH上游为5′-AGAAGGCTGGGGCTCATTTG-3′,下游为5′-AGGGGCCATCCACAGTCTTC-3′。以GAPDH为内参,采用2-△△Ct方法分析BI-1 mRNA的表达量。上述实验单独重复3次。
1.3.8 Western blot实验 将子宫肌瘤组织及瘤旁组织在液氮中进行研磨,采用RIPA裂解液及蛋白酶抑制剂于冰上进行组织或细胞中总蛋白的提取。BCA法进行蛋白定量,按照1∶4向上清液中加入5×上样缓冲液,并于沸水中加热变性10 min。取35 ug的蛋白进行聚丙烯酰胺凝胶(SDS-PAGE)电泳进行蛋白分离,采用湿转法将分离的蛋白转至PVDF膜上,5%的脱脂牛奶于室温下封闭2 h后,分别加入BI-1(1:300)、Bcl-2(1∶800)、Bax(1∶1 000)、Cleaved caspase-3(1∶1 000)、GAPDH(1∶2 000)一抗,4℃摇床孵育过夜。TBST溶液清洗3次,5 min/次,以HRP标记的二抗(1∶5 000)室温孵育1 h,以TBST溶液清洗3次,5 min/次,最后在载有蛋白条带的PVDF膜上均匀滴加ECL发光液后于凝胶成像仪进行曝光拍照。Image J软件测定条带灰度值,以目标蛋白与内参GAPDH的比值作为其相对含量。以上实验单独重复3次。
1.4 统计学分析

2 结果
2.1 BI-1在子宫肌瘤及瘤旁组织中的表达
RT-PCR及Western blot实验检测20对组织样本显示, BI-1在子宫肌瘤中的mRNA及蛋白表达较瘤旁组织均显著增加(P<0.05)。见下页图1A,B。

注:A图为RT-PCR实验检测BI-1 mRNA在子宫肌瘤及瘤旁组织中的表达;B为Western blot实验检测BI-1蛋白在子宫肌瘤及瘤旁组织中的表达;a为肌瘤组织,b为瘤旁组织;与肌瘤组织相比,**P<0.01。
2.2 分离培养子宫肌瘤细胞的鉴定
体外分离培养的原代子宫肌瘤细胞经α-Actin免疫染色后,结果显示超过90%的细胞胞质内可见棕黄色阳性染色,提示分离培养的原代子宫肌瘤细胞纯度较高,可满足后续实验研究。见下页图2。

图2 免疫组织化学鉴定分离培养的原代子宫肌瘤细胞(×40)
2.3 转染si-BI-1后子宫肌瘤细胞中BI-1 mRNA与蛋白表达
RT-PCR及Western blot实验检测转染后子宫肌瘤细胞中BI-1 mRNA的表达,结果显示与正常培养的Control组子宫肌瘤细胞相比,si-BI-1组细胞中BI-1 mRNA的表达显著降低(P<0.01),而si-NC组细胞中BI-1 mRNA的表达无明显变化(P>0.05)。见下页图3。
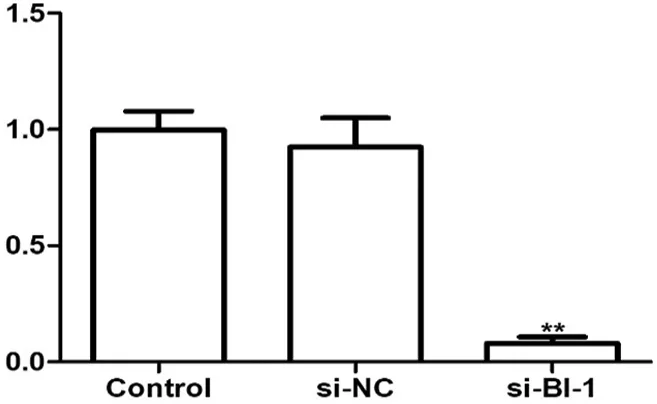
注:与Control组细胞相比,**P<0.01。
2.4 沉默BI-1对子宫肌瘤细胞增殖的影响
CCK-8检测沉默BI-1基因对子宫肌瘤细胞增殖的影响,结果显示随培养时间的延长,3组子宫肌瘤细胞的增殖能力无明显变化(P>0.05)。见图4。

图4 3组子宫肌瘤细胞增殖能力变化图
2.5 沉默BI-1对子宫肌瘤细胞凋亡的影响
Annexin V-FITC细胞流式检测沉默BI-1基因对子宫肌瘤细胞凋亡的影响,结果显示与Control组子宫肌瘤细胞相比,si-BI-1组细胞的凋亡率明显增加(P<0.01),而si-NC组细胞凋亡率无明显变化(P>0.05)。见下页图5。

注:与Control组细胞相比,*P<0.05。
2.6 沉默BI-1对子宫肌瘤细胞线粒体膜电位的影响
JC-1流式检测沉默BI-1对子宫肌瘤细胞中线粒体膜电位的影响,结果显示与Control组相比,si-BI-1组中细胞的线粒体膜电位显著降低(P<0.05),而si-NC组细胞凋亡率无明显变化(P>0.05),见下页图6。

注:与Control组细胞相比,**P<0.01。
2.7 沉默BI-1对子宫肌瘤细胞线粒体钙离子浓度的影响
流式细胞术检测沉默BI-1对子宫肌瘤细胞线粒体Ca2+浓度的影响,结果显示与Control组细胞相比,si-BI-1组细胞的胞质及线粒体中的Ca2+浓度均显著增加(P<0.05),其中以线粒体中的Ca2+浓度升高更为显著;而si-NC组细胞的Ca2+浓度无明显变化(P>0.05),见下页图7A,B。

注:与Control组细胞相比,*P<0.05。
2.8 沉默BI-1对子宫肌瘤细胞中Cyt-C及凋亡相关蛋白表达的影响
Western blot检测沉默BI-1对子宫肌瘤细胞中Cyt-C及凋亡相关蛋白Bcl-2、Bax及Cleaved caspase-3表达的影响,结果显示与Control组相比,si-BI-1组中细胞的Bcl-2蛋白表达显著降低(P<0.05),Bax、Cleaved caspase-3及Cyt-C蛋白表达明显增加(P<0.05),Bcl-2/Bax比值明显降低(P<0.05),si-NC组细胞的上述蛋白均无明显变化(P>0.05)。见下页图8。

注:与Control组细胞相比,*P<0.05,** P<0.01。
3 讨论
尽管子宫肌瘤不是女性生殖系统的恶性肿瘤,但其能引起多种与妇科及生殖相关的棘手问题,如异常子宫出血、慢性盆腔疼痛、复发性流产,甚至不孕等[2,4]。长期以来,临床上对子宫肌瘤的治疗方法多为子宫切除术或肌瘤切除/剔除术,但手术治疗不仅严重影响患者的生活质量,且肌瘤切术/剔除术后仍有不少患者会出现肌瘤的复发[5],因此积极探究子宫肌瘤的分子机制有望从源头上阻遏疾病的发生及进展。
既往大量数据证实,控制细胞凋亡基因的异常表达在子宫肌瘤的发生发展中起着重要的作用,其中最为重要的是Bcl-2基因家族。Bcl-2家族主要分为两类,一类是以Bcl-2为代表的抗凋亡基因与一类以Bax为代表的促凋亡基因[6-8]。在正常生理状态下,Bcl-2家族基因根据不同上游信号传导的信息激活特定的下游基因,并诱导相应基因的表达与转录,从而调控细胞的凋亡与存活,从而维持细胞代谢的稳定[14]。Bcl-2基因广泛表达于多种细胞的线粒体、内质网以及细胞核膜等细胞器表面,通过调控细胞周期进展,并影响Ca2+内流等多种机制抑制细胞发生凋亡[15]。而促凋亡基因Bax能够拮抗Bcl-2的抗凋亡作用,其主要通过结合线粒体膜上的糖蛋白,以形成Bax/Bax同源二聚体结构,进而导致线粒体膜损伤及膜电位的下降,最终导致细胞的凋亡[16]。BI-1是一种新发现的凋亡抑制基因,其蛋白产物能够抑制由Bax、星形细胞素等引起的细胞凋亡[9]。既往对其的研究发现,BI-1并非与Bax直接作用,而是与抗凋亡蛋白Bcl-2和Bcl-XL相互结合,通过改变其自身的表达,以调节BI-1/Bcl-XL/Bcl-2和Bax比值,调控细胞的凋亡[10]。同时BI-1还能有效抑制Bax/Bax同源二聚体的形成,从而阻止其诱导的线粒体对Cyt-C的释放,抑制该途径引起细胞凋亡的发生[17-18]。此外,有研究报道,BI-1/Bcl-2二聚体能够与线粒体通透性转换孔(MPTP)的主要组成成分进行结合,从而通过维持线粒体膜电位的稳定,以保护线粒体结构及功能的完整,进而发挥抗凋亡作用[19]。基于BI-1的上述抗凋亡作用机制,既往大量研究证实在多种肿瘤组织中异常增加的BI-1能够通过上述机制促进肿瘤细胞的增殖并抑制其发生凋亡[12-13]。
本研究首先通过检测子宫肌瘤组织与瘤旁组织中BI-1的表达,证实BI-1在子宫肌瘤组织中同样表现为异常高表达。利用siRNA干扰技术,沉默原代分离培养的子宫肌瘤细胞中BI-1基因,采用相关实验检测发现沉默肌瘤细胞中BI-1基因表达不影响细胞的增殖能力,但能够促进细胞发生凋亡。鉴于Bcl-2、Bax及BI-1均能影响线粒体功能且主要通过线粒体途径影响细胞凋亡,我们进一步通过实验检测沉默BI-1基因对子宫肌瘤细胞线粒体膜电位及细胞中Ca2+浓度的影响,结果显示沉默BI-1基因能够通过促进线粒体及胞质中的Ca2+浓度的增加,以诱导子宫肌瘤细胞线粒体膜电位的下降。而线粒体膜电位是离子在跨膜转运时所产生的膜外正电位,而线粒体基质能够产生大量负电荷,这导致线粒体内外膜两侧形成电位差。在细胞受到持续性有害刺激时,线粒体通透性增加,膜电位下降从而启动线粒体途径的细胞凋亡事件[17]。这与Lee等[20]研究发现的BI-1能够通过影响Ca2+浓度,以调控线粒体功能的结果相似。最后我们通过Western blot实验证实沉默BI-1基因能够通过促进细胞中Cyt-C、Bax及Cleaved caspase-3蛋白表达的增加,而降低Bcl-2蛋白水平。Cyt-C一般存在于线粒体的内外膜间隙之间,生理条件下其不能穿过线粒体外膜到达细胞质,而线粒体膜电位的变化及结构损伤时,Cyt-C从线粒体内释放到胞浆中,并作为重要的促凋亡因子,在三磷酸脱氧腺苷的协同作用下与凋亡蛋白酶活化因子-1相互结合,激活Caspase-3,启动Caspases的级联反应,最终导致细胞凋亡的发生。其中Caspases的活化是凋亡的中心环节,而Caspase-3是细胞凋亡过程中的关键执行者,它的活化是凋亡进入不可逆阶段的标志[21]。
综上,本研究发现BI-1在子宫肌瘤组织中的表达显著增加,沉默子宫肌瘤细胞中BI-1基因可能通过改变Bcl-2/Bax比值,促进胞质及线粒体中Ca2+浓度的增加,进而引起线粒体膜电位的下降,最终诱导细胞发生凋亡。本研究首次探究并报道了BI-1在子宫肌瘤中的表达及相关作用,为进一步阐明子宫肌瘤发生发展的分子机制提供了一定的理论基础及实验室依据。

