SIRT1调控Nrf2信号通路对宫颈癌细胞增殖、凋亡及迁移侵袭的影响
卢霞,许旭
宫颈癌在中国已成为中青年女性的第二大高发恶性肿瘤,每年新发病例占全球病例的28%以上[1]。沉默信息调节因子1(silent information regulator 1,SIRT 1)是一种组蛋白去乙酰化酶,是调节细胞应激、诱导细胞凋亡的重要分子[2]。临床研究表明SIRT1随宫颈病变的加重表达升高,对宫颈癌的发生和发展发挥促进作用,且SIRT1表达与宫颈癌的不良临床预后相关;体外实验发现SIRT1在人乳头状瘤病毒(human papilomavirus,HPV)感染的宫颈癌细胞中过表达[3-4]。然而SIRT1促进宫颈癌发生发展的具体作用机制目前尚不明确。核因子E2相关因子2(nuclear factor-E2-related factor 2,Nrf2)信号通路可通过调节机体氧化应激维持细胞的正常生理活动,Nrf2异常激活会引起Nrf2蓄积,导致Nrf2下游产物增多,增加肿瘤细胞对化疗药物的耐受性[5]。有研究发现,Nrf2蛋白在宫颈癌组织和细胞中高表达,上调Nrf2促进宫颈癌细胞的增殖、迁移和侵袭,下调Nrf2的表达后可抑制肿瘤细胞的增殖、侵袭和迁移,促进细胞凋亡[6]。据报道,SIRT1在细胞氧化还原平衡和抗氧化应激中起重要作用,Nrf2的表达可受到SIRT1的正调控[7]。因此本研究探讨SIRT1调控Nrf2信号通路对宫颈癌细胞增殖、凋亡及迁移侵袭的影响,从分子角度阐述SIRT1促进宫颈癌发生发展的作用机制。
1 材料与方法
1.1 实验试剂
宫颈癌细胞株Hela细胞购自美国ATCC、胎牛血清购自美国Gibco公司、RPMI-1640培养基购自北京天润善达生物科技有限责任公司、TRIzol Reagent购自美国Invitrogen公司、SIRT1、Nrf2、NQO1、GAPDH普通PCR上下游引物购自广州华大生物科技有限公司、SYBR Green PCR Master Mix购自TaKaRa、RevertAid First Strand cDNA Synthesis Kit购自Thermo Scientific、RIPA裂解液购自上海申能博彩生物科技有限公司、BCA蛋白浓度测定试剂盒购自Thermo公司、SIRT1单克隆抗体、Nrf2单克隆抗体、NQO1单克隆抗体、HO-1单克隆抗体均购自美国Abcam公司、HRP标记山羊抗兔IgG购自美国Santa Cruze公司。
1.2 方法
1.2.1 细胞培养、分组与转染 细胞培养条件:将Hela细胞加入到体积分数为10%的胎牛血清的RPMI 1640培养基中,于37℃,体积分数为5% CO2培养箱培养。将细胞培养至对数生长期即可进行后续实验。
细胞分组:① 空白对照组:每孔细胞加入PBS液;② SIRT1阴性对照组(negative control group,NC组):每孔细胞转染对照空载体(GFP-SIRT1);③ SIRT1抑制组:每孔细胞转染SIRT1干扰载体(si-SIRT1)。
1.2.2 Western Blot和qRT-PCR法检测各组细胞SIRT1的表达水平 取对数生长期细胞参照总蛋白提取试剂盒步骤提取各组细胞总蛋白,加入等体积上样缓冲液,沸水浴变性5~10 min。取50 μL变性蛋白样品至SDS聚丙烯酰胺凝胶电泳中电泳。经转膜仪转膜后浸于含5%脱脂奶粉的封闭液中封闭。洗涤后加入抗体(1∶1 000),4℃孵育过夜,再加入HRP标记的二抗(1∶2 000)常温下孵育2 h。比较各组细胞SIRT1蛋白的相对表达量。
各组细胞按照总RNA提取试剂盒、反转录试剂盒说明分别提取总RNA及cDNA模板,取1 μL cDNA产物进行qRT-PCR扩增。扩增条件:预变性94℃ 5 min,94℃变性30 s,57℃退火45 s,72℃延伸30 s。40个循环后72℃维持10 min。引物由广州华大生物科技有限公司设计合成,引物设计如下:SIRT1上游5′-GCAACAAGCATCTTGCCTGAT-3′,下游5′-GTGCTACTGGTCTCACTT-3′;GAPDH上游5′-ACGGCCGCATCTTCTTGTGCA-3′,下游5′-TGCCACTG CAAAT- GGCAGCCC-3′。SIRT1基因的相对表达量按公式(2-△△Ct法)计算,每组实验重复3次。
1.2.3 MTT法检测各组细胞的增殖能力 待细胞数达到1.0×106/mL后更换为无血清RPMI-1640培养基培养24 h。避光条件下每孔加入0.5 mg/mL的MTT,继续培养4 h,弃100 μL上清后每孔加DMSO 100 μL,震荡10 min,分别于0 h、24 h、48 h、96 h检测490 nm处的吸光度(OD值)。
1.2.4 流式细胞术检测各组细胞的凋亡能力及细胞周期 各组细胞培养72 h后收集2×105~5×105细胞加入Binding Buffer液500 μL悬浮细胞,加入Annexin V-FITC 5 μL混匀,加Propidium Iodide 5 μL。室温避光反应10 min,采用流式细胞仪检测细胞凋亡。
将各组细胞于37℃环境中孵育48 h后,使用PBS洗涤细胞2次,加入含量为70%预冷乙醇轻柔吹打混匀细胞后,于4℃环境中固定12 h,使用PBS洗涤细胞2次。取0.5 mL PBS重悬细胞,加入10 μL 7-AAD,同时加入适量RNaseA使其终浓度均为50 mg/L,于37℃环境中温浴30 min后,加400 μL PI避光染色30 min,采用流式细胞仪检测细胞周期。
1.2.5 细胞划痕实验检测各组细胞的迁移能力 取各组转染后培养48 h的细胞用胰蛋白酶消化,按2×105/孔接种于6孔板,37℃恒温培养过夜,用200 μL高压灭菌枪头垂直于板孔进行划线,用PBS冲洗划出的细胞后加入无血清培养基继续培养,24 h后对划痕处细胞迁移情况进行观察、拍照;划痕宽度用Image-proplus 6.0进行检测。实验重复3次。
1.2.6 Transwell细胞侵袭实验检测各组细胞的侵袭能力 取Matrigel基质胶,用不含胎牛血清的培养液按9∶1进行稀释,平铺于Transwell小室的上室,37℃过夜凝固。取各组转染后培养48 h的细胞用胰蛋白酶消化,调整细胞密度为4×105/mL,取200 μL加入小室的上室,将600 μL含20%胎牛血清的培养液加入下室,37℃培养24 h,取出小室,1%多聚甲醛混合,结晶紫溶液染色15 min,显微镜观察拍照,计数穿膜细胞数。实验重复3次。
1.2.7 Western Blot和qRT-PCR法检测各组细胞Nrf2、NQO1、HO-1的表达水平 具体实验操作步骤同1.2.2。Nrf2上游5′-GGACCTAAAGCACAGCCAACACAT-3′,下游5′-TCGGCTTGAATGTTTGTCTTTTGTG-3′;NQO1上游5′-TGGAAGCTGCAGACCTGGTG-3′,下游5′-TTGTCATA CATGGTGGCATACGTG-3′;HO-1上游5′-CTTTTTTCACC TTCCCGAGCATC-3′,下游5′-GGTCTTAGCCTCTTCTGT CAGGGTGT-3′。
1.3 统计学方法

2 结果
2.1 各组细胞SIRT1的表达水平比较
与空白对照组和SIRT1 NC组相比,SIRT1抑制组SIRT1 mRNA和蛋白表达水平均显著降低,差异均有统计学意义(P<0.05),详见图1。

注:与空白对照组相比,*P<0.05;与SIRT1 NC组相比,#P<0.05。
2.2 各组细胞的增殖能力比较
与空白对照组和SIRT1 NC组相比,SIRT1抑制组细胞的吸光度值显著降低,差异有统计学意义(P<0.05),详见图2。

注:与空白对照组相比,*P<0.05;与SIRT1 NC组相比,#P<0.05。
2.3 各组细胞的凋亡能力及细胞周期比较
细胞凋亡结果显示,与空白对照组和SIRT1 NC组相比,SIRT1抑制组细胞的凋亡能力显著增加;细胞周期结果发现,SIRT1抑制组G0/G1期细胞数明显多于空白对照组和SIRT1 NC组;而SIRT1抑制组S期细胞数明显少于空白对照组和SIRT1 NC组。差异均有统计学意义(P<0.05),详见下页图3、4。

注:与空白对照组相比,*P<0.05;与SIRT1 NC组相比,#P<0.05。

注:与空白对照组相比,*P<0.05;与SIRT1 NC组相比,#P<0.05。
2.4 各组细胞的迁移和侵袭能力比较
细胞划痕实验结果显示,SIRT1抑制组中划痕宽度显著宽于空白对照组和SIRT1 NC组;Transwell 细胞侵袭实验结果发现,与空白对照组和SIRT1 NC组相比,SIRT1抑制组中穿过小室基质胶的细胞数目显著减少。差异均有统计学意义(P<0.05),详见下页图5、6。

注:与空白对照组相比,*P<0.05;与SIRT1 NC组相比,#P<0.05。
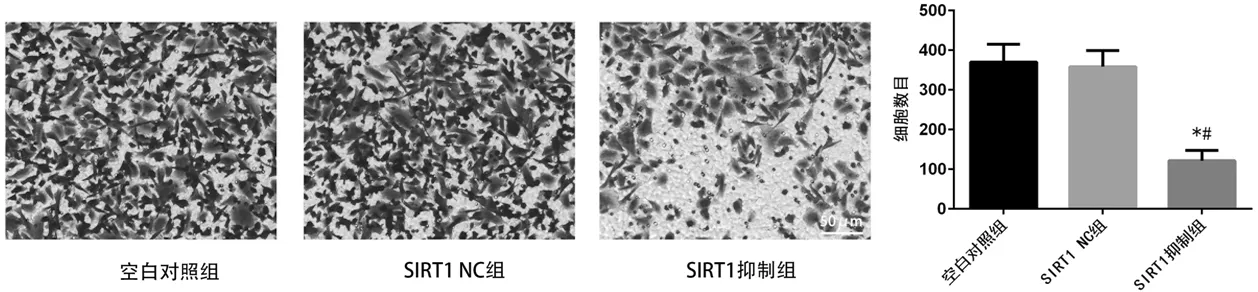
注:与空白对照组相比,*P<0.05;与SIRT1 NC组相比,#P<0.05。
2.5 各组细胞Nrf2、NQO1、HO-1的表达水平比较
SIRT1抑制组Nrf2、NQO1、HO-1的mRNA表达水平[(0.48±0.11)、(0.67±0.09)、(0.53±0.07)]与空白对照组[(1.00±0.15)、(1.00±0.15)、(1.00±0.11)]和SIRT1 NC组[(1.01±0.12)、(0.95±0.14)、(1.00±0.05)]相比均显著降低,差异均有统计学意义(P<0.05);与空白对照组和SIRT1 NC组相比,SIRT1抑制组Nrf2、NQO1、HO-1的蛋白及mRNA表达水平均显著降低,差异均有统计学意义(P<0.05)。详见下页图7。
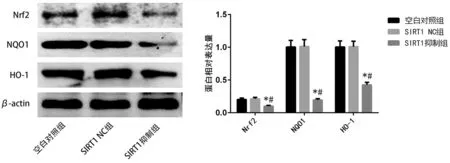
注:与空白对照组相比,*P<0.05;与SIRT1 NC组相比,#P<0.05。
3 讨论
宫颈癌是一种以肿瘤细胞的持续增生和侵袭、不凋亡为特征的恶性肿瘤,目前对促进肿瘤细胞侵袭及抑制凋亡的细胞机制是研究的热点[7]。研究表明,肿瘤细胞高迁移性和侵袭性是导致复发的重要原因[8]。SIRT1能够涉及到细胞的能量代谢、凋亡以及恶性肿瘤的发生和发展多个方面,其中SIRT1在机体发挥抑制细胞凋亡的作用[9-10]。目前研究显示,SIRT1在肿瘤中过表达,其表达水平越高,肿瘤细胞的凋亡越少,恶性生长特征越明显,侵袭转移增殖等现象增加[11]。有研究发现,miRNA-204可通过下调SIRT1抑制肝癌细胞增殖、促进其凋亡[12]。另有研究发现,miRNA-34a可下调SIRT1的表达从而抑制前列腺癌细胞的增殖,提示SIRT1具有维持前列腺癌增殖的作用[13]。
本研究采用转染SIRT1干扰载体(si-SIRT1)特异性抑制Hela细胞中SIRT1基因的表达,Western Blot和qRT-PCR结果均显示,SIRT1抑制组Hela细胞中SIRT1基因的蛋白和mRNA表达水平均低于空白对照组和SIRT1 NC组,提示Hela细胞中SIRT1基因的表达被成功抑制。MTT结果显示,48 h、96 h后SIRT1抑制组细胞的吸光度值均低于空白对照组和SIRT1 NC组,提示SIRT1参与细胞的增殖过程,下调SIRT1基因的表达可有效抑制细胞的增殖活性。细胞凋亡结果显示,与空白对照组和SIRT1 NC组相比,SIRT1抑制组细胞的凋亡能力显著增加;细胞周期结果发现,SIRT1抑制组G0/G1期细胞数明显多于空白对照组和SIRT1 NC组;而SIRT1抑制组S期细胞数明显减少,提示下调SIRT1基因的表达可使细胞在G1期阻滞,促进细胞的凋亡。细胞划痕实验结果显示,SIRT1抑制组中划痕宽度显著宽于空白对照组和SIRT1 NC组;Transwell 细胞侵袭实验结果发现,与空白对照组和SIRT1 NC组相比,SIRT1抑制组中穿过小室基质胶的细胞数目显著减少,提示特异性抑制细胞中SIRT1基因的表达可有效降低细胞迁移及侵袭能力。
当细胞受到氧化应激、亲电子试剂等刺激后,Nrf2可迅速解离出来并活化转位进入细胞核,与ARE结合进而激活下游靶基因的转录,以保护正常细胞免受氧化应激。但是,高水平的Nrf2在癌症中促进癌细胞生长,具有化学抗性和放射抗性[14]。近年来,越来越多的研究表明Nrf2具有致癌特性,如乳腺癌、肺癌、食管鳞状细胞癌等[15-16]。NQO1是一种黄素酶,在机体的解毒代谢中发挥着重要作用,能维持抗氧化物质的生物活性和还原性[17]。HO-1是热休克蛋白家族中的重要成员,具有抗增殖的作用,在许多疾病中发挥作用[18-19]。有研究发现,宫颈癌组织中Nrf2、HO-1蛋白表达上升,提示在宫颈癌中Nrf2/ARE通路被特异性激活,为宫颈癌的早期干预提供参考依据[20]。焦淑娟等[21]研究发现,维吾尔族宫颈鳞癌组织中存在Nrf2通路的激活,Nrf2基因沉默可能通过调控HO-1抑制宫颈癌SiHa细胞的增殖、迁移及侵袭能力,并促进细胞凋亡。本研究结果表明,与空白对照组和SIRT1 NC组相比,SIRT1抑制组Nrf2、NQO1、HO-1的蛋白及mRNA表达水平均显著降低,提示抑制细胞中SIRT1基因的表达可降低Nrf2、NQO1、HO-1的表达,从而抑制Nrf2信号通路的活化,在肿瘤的生物学行为中起到一定的作用。
综上所述,SIRT1可促进宫颈癌细胞增殖、迁移和侵袭,抑制其凋亡,其可能的作用机制是SIRT1促进Nrf2信号通路的活化,为临床治疗宫颈癌提供一个新的思路。

