微囊泡对人卵巢癌细胞耐药性传递作用的初步研究
谷芳,王淑珍
卵巢癌是妇科常见的恶性肿瘤之一,其病死率居妇科恶性肿瘤的首位[1]。卵巢癌化疗过程中产生的耐药是卵巢癌复发和治疗失败的最主要原因之一,卵巢癌细胞易对化疗药物如顺铂、紫杉醇等产生耐药性,从而导致治疗失败[2]。肿瘤化疗产生耐药的过程可能是多因素联合完成的,包括细胞环境中药物的解毒作用增加、化疗药物在细胞内积聚减少、排出增加、对DNA损伤耐受或修复增加和对促凋亡信号的抵抗[3]。
1967年Wolf第一次提出微囊泡(microvesicles,MV)的释放和它的生理功能[4]。MV是细胞以出芽方式产生的直径0.1~1 μm的具有双层膜结构的微囊泡[5],以膜表面显著暴露磷脂酰丝氨酸(phosphatidylserine,PS)为特征[6-7]。
本研究通过人卵巢癌耐顺铂细胞SKOV3/DDP和敏感细胞SKOV3,通过超高速离心、流式细胞仪分离检测耐药细胞SKOV3/DDP释放的MV,进一步证实人卵巢癌细胞的耐药性可以通过一种“非遗传”的方式——MV的介导,以期为临床逆转卵巢癌耐药提供一种新的治疗靶点。
1 材料与方法
1.1 材料与仪器
人卵巢癌SKOV3、SKOV3/DDP细胞购自中国医学科学院肿瘤研究所,采用10%胎牛血清、2 mmol/L谷氨酰胺、100 U/mL青霉素、100 μg/mL链霉素的RPMI1640培养液,培养于37℃、饱和湿度、5% CO2(V/V)、21% O2(V/V)条件下。顺铂购自美国Sigma公司,用DMSO溶液溶解成10 mmol/L的储存液,避光保存于4℃。Megamix Beads购自法国Biocytex 公司。Rhodamine123购自美国Sigma公司。流式细胞仪Gallious购自美国Beckman Coulter公司。
1.2 方法
1.2.1 微囊泡的提取分离 SKOV3/DDP生长期细胞无血清状态下培养12 h,收集上清液3 000 rpm、15 min离心去除细胞碎片,将上清液无菌状态下27 300 rpm、1 h、4℃超高速分离得到SKOV3/DDP的MV,用PBS或超高速分离后的medium将MV沉淀重悬,可-80℃分装冻存。
1.2.2 微囊泡的流式检测 使用流式细胞仪的定标及校正,使用Megamix Beads(含0.5 μm、0.9 μm、3 μm预混微球)进行定标,调整PMT使三群微球同时出现在同一FS-SS窗内,调整电压,使0.5 μm与0.9 μm微球比值介于2∶1~1∶1之间。我们首先通过FL1通道,区分0.5 μm和0.9 μm微球,分别标记为a门和b门,外切0.9 μm微球群作为MV gate。将分装的MV于37℃迅速溶解,使用荧光AnnexinV标记,与MV孵育半小时,在Beckman Coulter Gallious上进行MV检测,调整各荧光通道之间补偿值,避免相互干扰,利用Gallious随机自带软件获取原始数据。
1.2.3 MTT实验分析细胞活力 取对数生长期的人卵巢癌SKOV3/DDP、SKOV3细胞,调整密度为 1×104/孔接种于96孔培养板,每孔100 μL,每组分别设5个复孔,培养过夜后,实验组加入终浓度分别为0.25、1、4、16、64、128 μmol/L的顺铂,对照组加入等量的RPMI1640 培养液,置于37℃,5% CO2孵育箱内分别培养24 h、48 h后,每孔加入5 mg/mL MTT 20 μL,继续培养4 h后,每孔再加 DMSO 150 μL,充分震荡10 min,酶联免疫检测仪570 nm处测量吸光度(A)值。计算各组细胞活力(cell viability% of control),绘制生长曲线,并计算50%抑制浓度(IC50)及耐药指数。细胞活力=(1-实验组A值/对照组A值) ×100%。耐药指数=IC50(耐药细胞株)/IC50(亲本细胞株)。
1.2.4 SKOV3/DDP与SKOV3共同孵育,检测SKOV3耐药性的改变 鉴于细胞直径8~12 μm,MV直径0.1~1 μm,我们应用微孔滤膜2 μm的12-well transwell小室模型,上室培养耐药细胞SKOV3/DDP,下室培养敏感细胞SKOV3,将SKOV3/DDP与SKOV3共同孵育24 h,如图1。

图1 SKOV3/DDP与SKOV3共同孵育
对于耐药功能的检测可以通过流式细胞仪检测SKOV3/DDP、孵育后SKOV3(Co-incubatin SKOV3)、SKOV3细胞对罗丹明123(R123)的外排功能(蓄积能力),实现对耐药功能的检测。用0.25%的胰酶消化,1 000 rpm离心5 min;用PBS洗涤细胞两次, 2 000 rpm离心5 min,去除未结合的MV,PBS混匀、收集细胞并调整细胞浓度至1×106/mL;加入荧光染料R123 0.5 μM,混匀,4℃避光30 min;在Beckman Coulter Gallious流式细胞机上进行检测,记录激发波长488 nm处红色荧光。
1.2.5 分离SKOV3/DDP的MV,检测SKOV3与MV共同孵育后耐药性的改变 收集SKOV3/DDP的上清,按照1.2.1的方法超高速分离法得到MV,将MV与敏感细胞SKOV3共同孵育24 h,如图2。

图2 MV与SKOV3共同孵育
通过流式细胞仪检测SKOV3/DDP、与MV孵育后的SKOV3(MV Co-incubation SKOV3)、SKOV3细胞对罗丹明123(R123)的外排功能(蓄积能力)。方法同上。
1.3 统计学分析

2 结果
2.1 微囊泡的提取分离与流式检测
在FL1通道,区分0.5 μm和0.9 μm微球,分别标记为a门和b门(图3A)。然后在FSC和SSC通道上,外切b门,确立MV gate(图3B)。图3C为用该方法检测卵巢癌SKOV3/DDP细胞产生的MV。图3D表示用该方法检测MV的提纯率为75.82%。图3见彩插2。
2.2 卵巢癌SKOV3、SKOV3/DDP细胞的细胞活力及耐药指数
在0.25、1、4、16、64、128 μmol/L浓度的顺铂作用24 h、48 h后,SKOV3/DDP的细胞活力明显高于SKOV3细胞,差异有统计学意义(P<0.05)。SKOV3细胞培养24 h、48 h的IC50分别是8.06 μmol/L、2.7 μmol/L,SKOV3/DDP细胞培养24 h、48 h的IC50分别是34 μmol/L、12.4 μmol/L,SKOV3/DDP在24 h、48 h的耐药指数为4.21、4.59。人卵巢癌SKOV3和耐药细胞SKOV3/DDP在不同浓度顺铂作用下的细胞活力,见图4。
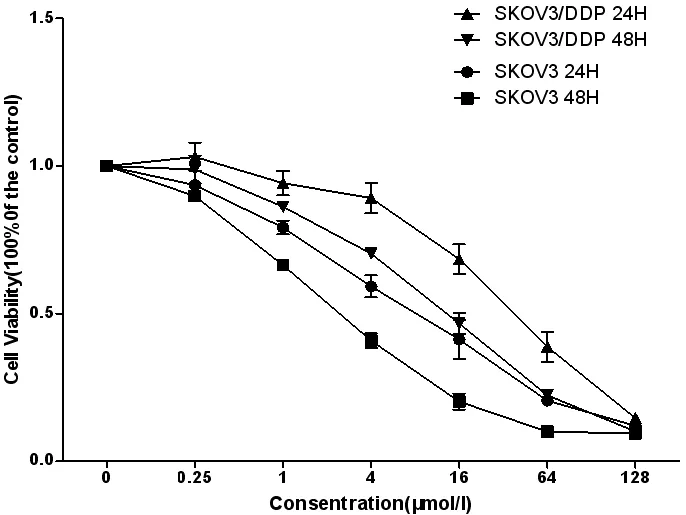
图4 MTT法检测SKOV3/DDP、SKOV3在顺铂作用下的细胞活力
2.3 SKOV3/DDP与SKOV3共同孵育后,流式细胞仪检测SKOV3的耐药性增加
流式细胞仪检测结果发现,SKOV3/DDP与SKOV3共同孵育后,SKOV3内蓄积的R123的荧光峰向左偏移(P<0.001),见图5(彩插2),表明敏感细胞与耐药细胞共同孵育后,敏感细胞内蓄积的R123减少,对R123的外排能力增加,耐药性增加。
2.4 微囊泡与SKOV3共同孵育后,流式细胞仪检测SKOV3的耐药性增加
流式细胞仪检测结果发现,SKOV3/DDP分离的MV与SKOV3共同孵育后,SKOV3内蓄积的R123的荧光峰同样向左偏移(P<0.001),见图6(彩插2),表明敏感细胞内蓄积的R123减少,对R123的外排能力增加,SKOV3的耐药性增加。
3 讨论
卵巢癌耐药极大影响了卵巢癌的预后,因此研究卵巢癌耐药的发生和发展机制,寻求逆转卵巢癌耐药发生的治疗方案成为卵巢癌研究中有待解决的重要课题。近年来,外泌体(exosomes,Exo)在肿瘤中的作用已经得到了很多关注,但是体积较大的MV的功能仍不甚清楚。这似乎令人惊讶,因为与Exo相比,MV在患者血液中更易于获取,且通过常规方法即可检测鉴定,理论上更适合成为“体液检查”的理想选择[8]。很多研究发现,肿瘤细胞同样可以释放大量的内含蛋白酶、各种信号分子、mRNA和microRNA的MV,通过MV的传递,这些来自肿瘤细胞的蛋白、脂质和核苷酸等作用于靶细胞,从而影响肿瘤自身的生长、侵袭、转移、血管化、导致肿瘤细胞耐药[9-11]。
最常用的MV定量检测方法是使用流式细胞仪[12-13],传统流式细胞仪的检测灵敏度较低,尤其是直径0.5 μm以下的颗粒,而新一代的高灵敏度流式细胞仪在这方面具有明显的优势。本实验采用Beckman Coulter Gallios高灵敏度流式细胞仪作为主要仪器,建立了基于Megamix Beads的MV定量方法。 Megamix Beads是一种商品化的荧光微球,含有0.5 μm(a)、0.9 μm(b)、3 μm(c)3种尺寸。在本实验中,我们使用该方法确立了MV gate,成功检测到人卵巢癌细胞产生的MV。
MV在肿瘤细胞耐药形成机制中所起的作用很值得一提,研究发现肿瘤细胞通过释放MV的方式募集、排出抗肿瘤药物,从而使肿瘤细胞产生抵抗作用[14-15]。在本研究中,为了探究MV在人卵巢癌细胞之间耐药性的传递作用,我们用R123实验模拟肿瘤药物的输出,发现人卵巢癌耐药细胞SKOV3/DDP与敏感细胞SKOV3共同孵育后,敏感细胞耐药性增加,同时,人卵巢癌耐药细胞SKOV3/DDP释放到肿瘤微环境中MV单独与敏感细胞SKOV3共同孵育后,敏感细胞耐药性同样增加,这说明MV作为一种“非遗传”的介导工具,在耐药细胞和敏感细胞之间传递了耐药性。关于MV与卵巢癌耐药性产生和传递过程中的具体信号通路和机制,我们还在进一步研究中。
综上,本研究通过高灵敏度流式细胞仪成功检测到人卵巢癌细胞产生的MV,通过流式细胞仪检测R123的外排实验,表明人卵巢癌细胞可以通过MV向敏感细胞传递耐药性,但其具体机制尚需要进一步的研究。在卵巢癌耐药方面,我们可以进一步研究抑制MV释放及靶细胞摄取的方法,或许可为逆转卵巢癌耐药提供新思路,成为化疗耐药新的治疗靶点。

