14例小汗腺螺旋腺瘤临床及病理特征分析
徐斐妮 陈爱军
重庆医科大学附属第一医院皮肤科,重庆,400016
小汗腺螺旋腺瘤(eccrine spiradenoma,ES)是一种1956年被首次提出的罕见小汗腺来源皮肤附属器肿瘤[1,13],临床表现与表皮囊肿、纤维瘤等难以区分,常因认识不足而误诊。小汗腺螺旋腺瘤的组织病理特征对于其诊断十分重要,需与基底细胞癌、真皮圆柱瘤等其他皮肤肿瘤鉴别。为了进一步加深对ES的认识,提高临床诊治水平,现将本院2015-2019年门诊确诊的14例ES病例临床及病理资料进行分析总结,报道如下。
1 资料和方法
1.1 一般资料 2015-2019年于重庆医科大学附属第一医院皮肤科确诊为ES的14例患者的临床资料(表1)。14例病例的HE染色切片均由2名我科高级职称、长期从事病理读片的皮肤科医师判读,确诊为小汗腺螺旋腺瘤。
1.2 方法 回顾性分析14例小汗腺螺旋腺瘤的临床(年龄、性别、皮损部位、皮损特点、临床初步诊断)及组织病理学表现,并对上述进行免疫组织化学染色,标记CEA、EMA、S-100、SMA。
2 结果
2.1 性别及年龄 14例患者中,男5例,女9例,男女之比1∶1.8,中位发病年龄为40.5岁。
2.2 发病部位及皮损特点 14例患者中10例(71.43%)位于躯干,3例(21.43%)皮损位于头面部,1例(7.14%)位于四肢。皮损主要表现为皮下包块或结节(图1),颜色可见皮色、红色、蓝色、浅褐色。所有病例皮损均未见破溃。其中11例(78.51%)患者诉皮疹处疼痛或触痛。
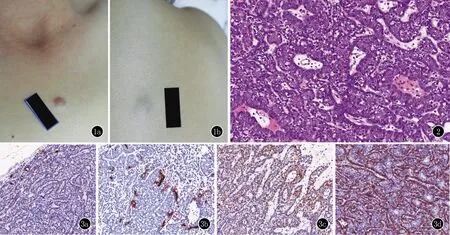
图1 小汗腺螺旋腺瘤的皮损 1a:胸部红色结节;1b:背部蓝色皮下包块 图2 ES组织病理表现,可见导管样结构。肿瘤主要由两种典型细胞构成,小叶外周细胞小且核圆深染,而中央细胞大而核呈椭圆泡状,胞质淡染。肿瘤小叶间质内可见淋巴细胞浸润,且可见淡红色基质(HE,×400) 图3 小汗腺螺旋腺瘤的免疫组化(×400) 3a:CEA在导管样结构处阳性表达;3b:EMA于导管样结构处表达阳性;3c:S-100在部分肿瘤细胞中呈阳性表达;3d:SMA肿瘤小叶外周细胞表达阳性
2.3 临床首诊 首诊诊断误诊率为100%,误诊为表皮囊肿6例(42.86%)、色素痣3例(21.43%)、皮肤纤维瘤2例(14.29%)、皮下结节2例(14.29%)、平滑肌瘤1例(7.14%)。
2.4 组织病理特征 所有病例镜下表皮未见明显异常,肿瘤位于真皮较深层次,与表皮无连接。6例肿瘤为多叶状,余8例为单叶。肿瘤细胞与周围组织境界清,有包膜,可见导管分化结构。其中4例肿瘤内可见血管扩张。肿瘤小叶间及血管旁可见淡红色均质基质样结构。高倍镜下肿瘤小叶周边细胞由偏小的核圆深染的肿瘤细胞构成。而肿瘤小叶中央的肿瘤细胞较大,胞浆淡染或呈嗜酸性,核为空泡核。肿瘤细胞有丝分裂象不明显。所有病例间质内均可见较多淋巴细胞浸润(图2)。
2.5 免疫组化 14例ES均进行CEA、EMA、S-100、SMA免疫组化染色。结果示肿瘤细胞CEA及EMA局灶性(+),阳性反应见于肿瘤导管样结构处,肿瘤细胞团CEA及EMA染色为阴性。S-100蛋白在ES部分肿瘤细胞中呈阳性表达。SMA主要于ES肿瘤小叶外周细胞表达阳性(图3)。
3 讨论
小汗腺螺旋腺瘤是一种罕见的小汗腺来源良性肿瘤。目前ES的病因及发病机制尚不清楚。目前国内外对ES的病案报道较少。在目前国外文献中已报道约数十例小汗腺螺旋腺瘤,主要发生在15~35岁的患者,无明显性别倾向性[1]。本研究所报道的14例小汗腺螺旋腺瘤以中青年多见,但亦有60岁以上患者,男女之比1∶1.8。各文献中所报道ES的发病年龄及性别倾向的数据因受样本量限制,而可能有所差异。
根据Kanwaljeet等[1]的报道,ES常表现为较小结节状病变,在躯干多见。据其初步统计,已报道的病例中97%为单发病灶,余3%为胸部、上肢、头皮等的多发性肿瘤病例。本研究中ES病历均为单发,皮损形态以结节、皮下包块为主,皮损边界较清,颜色可呈现皮色、红色或蓝色等,且多伴有疼痛或触压痛。其皮损缺乏特征性,临床上极易被误诊,本文报道的14例患者曾被临床初步诊断为表皮样囊肿、炎性结节、皮肤纤维瘤、平滑肌瘤等,与其病理活检结果不符,提示ES误诊率高。本研究所报道的14例患者中最常见发病部位为躯干(71.43%),其次为头面部(21.43%)。根据国内外文献报道,一些特殊部位如耳廓、眼睑[3]、乳头[4]也可发生。ES偶可见多发病例,呈线性、带状、痣样、花斑样多发螺旋腺瘤曾被报道,多发性ES的发生推测与相关肿瘤抑制基因缺陷有关[5]。当螺旋腺瘤与其它附件肿瘤如真皮圆柱瘤和毛发上皮瘤同时发生时,应怀疑为一种常染色体显性遗传病Brooke-Spiegler综合征,其发病原因目前认为与位于16号染色体q12-q13上的CYLDI基因存在缺陷有关。该基因的外显率60%~100%。家族性真皮圆柱瘤和家族性毛发上皮瘤中同样也发现CYLD1基因突变[5,6]。因此,组织病理学在区分Brooke-Spiegler综合征、真皮圆柱瘤和毛发上皮瘤中起着重要作用。
ES最主要的诊断依据为其特征性的组织病理学表现。其组织病理学特点主要为:①肿瘤位于真皮,常外覆包膜,由单叶或多个小叶构成。肿瘤中多可见导管分化的形态。部分ES中可见血管扩张。②ES的肿瘤细胞排列较密集,主要由肿瘤小叶外周小而深染的细胞和中央大而淡染的两种肿瘤细胞构成。肿瘤间质中多数伴较多淋巴细胞浸润。组织学方面的鉴别诊断,因部分ES中富含血管,血管腔扩张明显,故易与血管球瘤混淆。但是血管球瘤无导管样结构,且肿瘤细胞为均匀一致的圆形细胞。ES的组织学表现亦可与真皮圆柱瘤相似,但是真皮圆柱瘤少见包膜, 由大小不等的瘤细胞团块组成“七巧板”样的结构,瘤细胞团块周围被嗜酸性膜样结构所包绕[15,16]。部分ES病例据报道间质内可见扩张的淋巴管,易被误认为集合淋巴管,必要时可通过免疫组化予以鉴别[14]。
当ES组织病理中导管样结构不明显时可通过免疫组织化学染色辅助诊断。本研究中ES的CEA及EMA阳性表达在肿瘤导管分化结构处明显,说明局部导管形成,提示肿瘤为汗腺来源。S-100及SMA在部分肿瘤细胞中表达阳性,与既往报道结果一致[7],提示肿瘤向肌上皮细胞分化,亦为支持肿瘤为小汗腺来源的依据。其他相关研究指出,ES还可有P63、calponin、CK7、CD117阳性等的阳性表达[7,8]。虽ES的诊断以其组织病理学表现为主导,但通过免疫组化的辅助能够提示肿瘤的来源及分化,与其他上皮组织肿瘤等鉴别,最终提高诊断准确性。
ES虽向恶性转化发生率低,但仍需警惕,尤其是当皮损表现为慢性皮肤肿块在短期内快速生长,伴明显压痛、溃疡、出血和卫星灶时。若组织病理中肿瘤有丝分裂象增多,伴灶性坏死,肿瘤细胞沿纤维包膜线延伸时提示ES向恶性转化。免疫组化Ki67在ES表达中弱表达,若出现Ki-67高表达也是诊断恶性螺旋腺瘤的线索[10]。目前已有发生于耳廓、外阴、胸部的恶性螺旋腺瘤被报道[10-12]。若确诊为恶性螺旋腺瘤,需仔细排查患者有无淋巴结、远处转移。在Andreoli等[9]的一项meta分析中,35例恶性螺旋腺瘤患者未出现淋巴结转移,而24例出现了远处转移。其中无转移的患者术后33个月无病生存率为100%。
ES的治疗方案标准尚未确立,但多数病损均选择予以手术切除。其他治疗方式如冷冻治疗,放疗或应用氩和CO2激光治疗少有报道。相关研究还表明,阿司匹林及其衍生物的使用可导致新病变的迅速形成[5]。若患者病损活检提示恶性转化,应积极筛查有无转移,同时其治疗方式需考虑手术联合淋巴结清扫,必要时予以放化疗。

