逆行腋窝淋巴示踪的动物研究
朱倩男, 王珏, 陈锐, 查小明, 史跃年, 王水
上肢淋巴水肿是乳腺癌腋窝淋巴结清扫术(axillary lymph node dissection ,ALND)后最常见的并发症之一。目前,前哨淋巴结(sentinel lymph node,SLN)活检术广泛用于临床腋窝淋巴结阴性的患者,尽可能避免不必要的ALND。然而,对于SLN有转移或者探查SLN失败的患者依旧需要进行ALND。少数行SLN活检的患者也出现术后上肢水肿[1-4]。
Kimberg[5]于2007年提出逆行腋窝淋巴示踪(axillary reverse mapping,ARM)的概念,通过显影剂逆向显影腋窝淋巴管网,以利于在行ALND和(或)前哨淋巴结活检(sentinel lymph node biopsy,SLNB)时保护患者上肢至腋窝的淋巴通道,进而降低上肢水肿的发生率,提高患者的生活质量[6-13]。ARM的可行性基于以下假设:乳腺和上肢的淋巴回流通路在结构和功能上有相对独立性,两者之间仅有极少的交通支,乳腺原发恶性肿瘤不会累及上肢来源的淋巴系统[14-16]。然而,ARM有一定局限性,有研究者发现在少数情况下SLN同时接收上肢淋巴液[2-19]。Casabona等[7]的研究结果显示,在37.5%(27/72)的患者中上肢汇至腋窝的淋巴管道与乳腺汇至腋窝的淋巴管的独立性不明显,SLN与ARM示踪的淋巴结有重叠。因此,有不少研究针对SLNB时ARM的可行性、ARM示踪的淋巴结检出率及分布情况、ARM示踪的淋巴管分布情况、ARM示踪的淋巴结肿瘤侵袭情况、SLN与ARM示踪的淋巴结的关系等进行了探讨。亚洲的ARM临床研究较少,且大多直接在患者身上借鉴西方经验进行研究。我们希望通过动物研究来验证ARM操作的可行性,探索适合ARM实行的最佳染料、最佳注射点,同时寻找ARM示踪的淋巴结和淋巴管的分布规律,进而指导ARM在临床中的应用。结合发展中国家核素法施行的困难以及荧光法需要专用设备提高操作成本等,我们选择价格低廉、操作简单的染料染色法(亚甲蓝和纳米炭混悬注射液)行ARM的研究。
1 研究材料
1.1 研究对象 健康雌性新西兰大白兔54只,体重(1 800±300)g,非怀孕、非哺乳期,购自金陵种兔场,均单笼饲养,兔舍安静,恒温24 ℃,空气湿度60%~70%,将全价饲料、饮水全部备入饲槽中,任兔自由采食。
1.2 研究染料 1%亚甲蓝注射液(美蓝),购自江苏济川制药有限公司;纳米炭混悬注射液(卡纳琳),0.5 ml:25 mg,购自重庆莱美药业股份有限公司。
1.3 研究器材 动物手术台,3%戊巴比妥钠20 ml及1 ml注射器,纱布、棉球、绷带,血管钳、眼科剪、眼科镊、刀柄、刀片,计时器。
2 实验步骤
所有大白兔均用3%的戊巴比妥钠麻醉,置于手术台上。手术前刮除兔子双侧上肢兔毛,充分暴露皮肤。将兔子按照体重从轻到重编号后,通过安全随机数随机选取每次研究的大白兔。
2.1 淋巴管网的独立性 随机选择9只大白兔,在其右侧最上方乳腺注入0.5 ml亚甲蓝行SLN活检,右侧上肢皮下注射0.5 ml卡纳琳行ARM。同时在这批兔子的左侧最上方乳腺注入0.5 ml卡纳琳行SLN活检,左侧上肢皮下注射0.5 ml亚甲蓝行ARM。5 min后解剖腋窝,评估上肢淋巴管网与腋窝淋巴管网的相对独立性。
2.2 上肢淋巴管的汇集特点 随机选择3只大白兔,以环形网状样(纵向每隔1 cm、横向每隔1 cm)于双侧趾蹼间、掌间、上肢的皮下、肌肉中注入亚甲蓝,每侧共注入亚甲蓝2 ml,每个注射点均匀注射染料,解剖腋窝,观察上肢染色的淋巴汇集至腋窝的情况。
2.3 注射染料、部位的选择 随机选择9只大白兔并随机分为3个亚组,每亚组3只,全麻后用亚甲蓝染色右侧上肢淋巴管,卡纳琳染色左侧上肢淋巴管,每亚组中每只大白兔双侧上肢染料计量相同,3只大白兔染料计量分别为2 ml、1 ml、0.5 ml。第一组注射部位选择兔趾蹼间的皮下处,第二组选择肘部屈侧皮下处,第三组选择上肢近腋窝内侧皮下与肌间沟处。等待5 min后解剖腋窝,观察汇入腋窝的引流上肢淋巴液的淋巴结与淋巴管的显色情况,选择最佳注射部位并选定后续实验染料注射剂量。
2.4 ARM示踪淋巴结与淋巴管的分布 根据上述三部分实验结果进一步研究ARM下上肢淋巴液引流至腋窝淋巴结与淋巴管的分布情况:在33只雌性新西兰大白兔双侧上肢近心1/3处内侧肌间沟的皮下、肌间沟及肌内注射亚甲蓝,充分按摩5 min后解剖腋窝,详细记录淋巴管、淋巴结显色及分布情况。
本研究获得南京医科大学第一附属医院伦理委员会和南京医科大学动物实验中心的伦理批准,批准号:1601179。
3 结果
从上肢淋巴管网独立性的研究可见大白兔双侧腋窝区蓝染的淋巴管网与黑染的淋巴管网是相对独立的。17侧上肢ARM示踪的淋巴结与SLN不是同一淋巴结(图1A)。仅有一侧发现了1枚(1/18)双染的淋巴结,这枚淋巴结就是交汇的ARM示踪淋巴结和SLN(图1B)。
上肢淋巴管汇集的研究结果显示上肢淋巴管道流入腋窝时分为浅层淋巴通路和深层淋巴通路,深层淋巴通路在腋窝区汇聚成数根较粗的淋巴干(图1C),亚甲蓝对于淋巴管的显色更为清晰。
注射染料、部位选择研究的结果提示亚甲蓝与卡纳琳对淋巴结的染色效果相近,均可清晰呈现淋巴结,但亚甲蓝对于淋巴管的显象更为清晰,更适合用于ARM技术的施行。最佳的染料注射部位为上肢的肌间沟处(图2)。
在研究ARM示踪的淋巴结与淋巴管分布的33只大白兔中,有两只大白兔因麻醉死亡,9只大白兔仅一侧上肢ARM操作成功。经统计,共45侧上肢的腋窝区探查到蓝染淋巴结,47侧上肢腋窝区探查到蓝染淋巴管,其中有37例同时探查到蓝染的淋巴结与淋巴管。为了便于统计观察,我们将腋窝通过下述方法划分为五个区域[11]:以前锯肌、腋静脉、第二肋间臂神经、背阔肌前缘及胸背神经血管束为标志物,区域A以腋静脉和第二肋间臂神经为上下界,胸背神经与背阔肌前缘为前后界;区域B毗邻A区域,在A区前方,以腋静脉和第二肋间臂神经为上下界,前锯肌后缘与胸背神经为前后界;区域C在B区下方,由第二肋间臂神经、前锯肌后缘和胸背神经分隔而成;区域A的下方、区域C的后方即为区域D;腋静脉上方的空间定位区域E(图3A)。在我们的研究中,蓝染淋巴结常位于某一个区域,只有1只大白兔的一侧在A、B区均发现1枚蓝染淋巴结。蓝染淋巴结多数分布在腋静脉与第二肋间臂神经之间,也就是A、B区域,A区域检出率为58.7%(27/46),B区域检出率为32.6%(15/46),C区域检出率为8.7%(4/46),D、E区域未检出蓝染淋巴结。蓝染淋巴管多伴行于腋静脉。我们如图3B所示,将其走行分成4种路线:路线1伴行于腋静脉上方;路线2伴行于腋静脉下方,但在第二肋间壁神经上方;路线3从CD区域纵行向AB区域方向;路线4是较为细小的数条淋巴管走行于腋窝区域。只有一侧上肢出现了同时伴行于腋静脉上下的淋巴管分支,以及同时有路线1与2的走行,其他多数为单种走行路线,具体分布情况为:路线1占10.4%(5/48),路线2占77.1%(37/48),路线3占10.4%(5/48)、路线4占2.1%(1/48)。
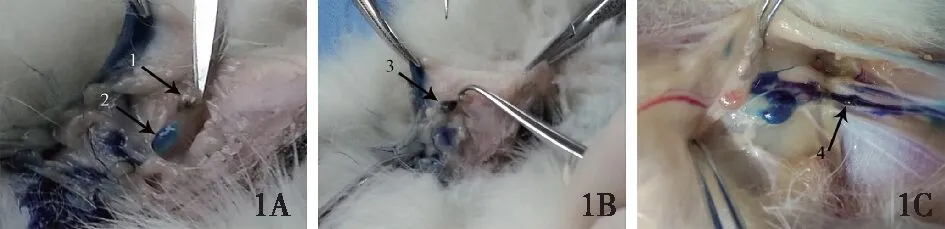
1A:卡纳琳黑染了1枚前哨淋巴结(箭头1),亚甲蓝行ARM示踪蓝染了1枚淋巴结(箭头2),ARM示踪的淋巴结与SLN不是同一个淋巴结;1B:有ARM示踪的淋巴结与SLN重叠(箭头3);1C:通过亚甲蓝行ARM发现,上肢淋巴管网分为深浅两层,在汇入腋窝淋巴结之前会先汇聚成数根较粗的淋巴干(箭头4)图1 大白兔上肢与乳腺汇入腋窝的淋巴管网的情况
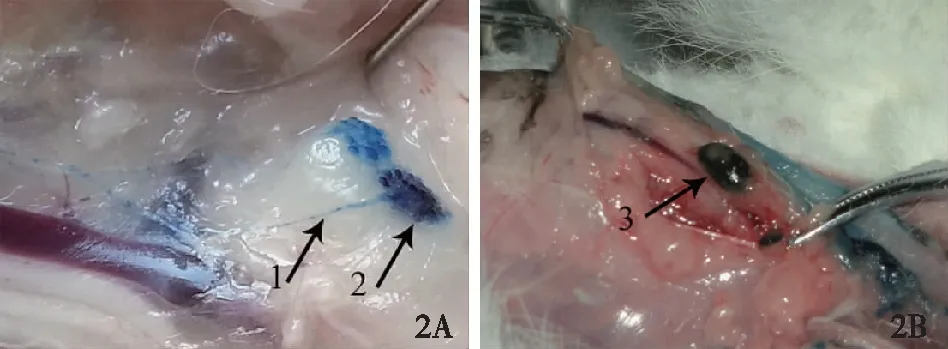
2A:沿着上臂内侧肌间沟皮下注射亚甲蓝可以同时清晰的显影淋巴管(箭头1)和淋巴结(箭头2);2B:卡纳琳可以清晰显示淋巴结(箭头3),但是示踪淋巴管效果较差图2 分别用亚甲蓝与卡纳琳行ARM的示踪情况

3A:ARM淋巴结多数位于腋静脉和第二肋间壁神经之间(A、B区域)。ARM淋巴结多数位于一个区域中,少数可同时存在于A、B区域;3B:ARM淋巴管多沿腋静脉走行,多数为路线1的情况图3 ARM淋巴结和淋巴管在腋窝的分布情况
4 讨论
目前不少研究结果认为多数情况下乳腺的淋巴引流与上肢的淋巴引流在腋窝区鲜有汇聚,SLN与ARM示踪的淋巴结不重叠,偶尔两者会出现交汇[1-3,6-13]。本研究中,蓝染的淋巴网与黑染的淋巴网相对独立,也证实了SLN与ARM示踪的淋巴结的相对独立性。在多数研究中,为了蓝染上肢淋巴管网,前哨淋巴结的活检仅用核素法进行操作,部分术者认为单一示踪剂会降低SLN检出率,坚持染料结合核素法行SLN活检,拒绝ARM技术[11]。我们将亚甲蓝用于ARM技术、卡纳琳结合核素法用于SLN活检,可以保证SLN检出率的同时进行ARM技术。
尽管ARM示踪的淋巴结不等同于SLN淋巴结,但是少数案例中两者是可以重叠的,侧面解释了为什么有的患者仅进行了SLN活检也会出现上肢淋巴结水肿。一般ARM示踪的淋巴结与SLN两者的交汇率波动于0~21%(3/14)[1-3,5-21]。我们的动物实验也证实两者有为同一枚淋巴结的可能,交汇率为5.56%(1/18),与临床结果相似。当然,这些研究的样本量较小,需进一步扩大样本量后深入研究,进一步分析临床数据,评估交汇可能。
值得一提的是上肢浅层与深层的淋巴液在汇入腋窝的过程中会由细小的分支汇成数根主干。通过解剖证实保护这些淋巴干管道可以维持上肢淋巴管网的完整性。ARM技术可以显示这些淋巴干并有助于术者在术中可视的情况下对这些淋巴干进行保护,减少因淋巴干切断后引起上肢淋巴水肿。
我们研究中的一部分是通过对不同注射点注射同等计量的染料来进行ARM操作,对比发现上肢近心端的肌间沟内侧为最佳注射点。和其他注射点如指蹼间、肱二头肌、肱三头肌相比,肌间沟内侧注射点不仅可以有效地进行ARM操作,同时可以最大限度降低染色导致的不美观。用亚甲蓝进行ARM技术简易且价格适中,其染色速度快,染色效果鲜明,对汇入腋窝淋巴系统中的上肢淋巴管显色清晰,淋巴结及淋巴管染色效果均较理想;卡纳琳对淋巴结染色效果明显,但难以清晰显示淋巴管,不利于术中保护上肢淋巴管道,而上肢汇总入腋窝的淋巴管往往是维持上肢淋巴循环的关键,因此卡纳琳难以用于ARM技术[14]。但在行ARM时,卡纳琳可结合核素和(或)荧光染料进行SLN活检,且检出率较为稳定。上肢淋巴引流可分浅深两层,深层淋巴管至腋窝一般汇集成数根淋巴管,主淋巴管有1~3根,汇入相近位置的淋巴结,ALND主要损伤上肢深部淋巴引流的主管道,术中如果保留1~2根蓝染淋巴管并保留部分蓝染淋巴结,一定程度上维持了上肢淋巴循环的完整性,减少了对上肢淋巴循环的破坏,进而减少术后水肿的发生。绝大多数情况下,上肢引流至腋窝的淋巴管沿腋静脉下方走行,其汇入的ARM示踪的淋巴结多数位于腋静脉下方、第二肋间臂神经上方、近上肢处。此次研究中并未发现D区、E区有蓝染淋巴结,但并不能排除D区、E区出现蓝染淋巴结的可能,腋窝5个区域均有可能找到ARM示踪的淋巴结,但是A区域探及到ARM示踪淋巴结的几率最大,手术操作时需格外注意。SLN多数位于腋窝淋巴结中央区,少数情况下ARM示踪淋巴结也可在此区域,需尽量精细化操作,避免活检SLN时切除范围过大而连带切除了ARM示踪的淋巴结。
本研究也存在一些局限性。首先,结合发展中国家经济、政策特点,亚甲蓝用于ARM是可行的,但是ARM研究的人群样本量极其有限且单一染色法行ARM的成功率并不理想。其次,ARM示踪的淋巴结被肿瘤累及的风险缺乏大样本数据,保留ARM示踪的淋巴结和淋巴管的最关键问题是其肿瘤安全性和保留适应证,这也直接影响ARM是否可应用于实际。一些临床研究已证实ARM示踪的淋巴结有肿瘤侵袭的可能[11-12, 17-20]。第三,对于ARM示踪的淋巴结有肿瘤转移或ARM示踪淋巴结与SLN淋巴结为同一淋巴结的情况下,术者难以接受保留ARM示踪的淋巴管道和淋巴结,因此患者不能从ARM技术中获益。保留ARM示踪的淋巴管道和淋巴结的标准尚不明确。ARM可施行的前提是基于上肢淋巴通路不会受原发乳腺癌侵袭这一假设,所以我们需要扩大研究样本量并结合肿瘤模型去评估ARM示踪淋巴结受肿瘤侵袭的风险性。最后,目前没有关于ARM术后的长期随访,ARM技术运用的价值尚未得以肯定。
综上所述,ARM技术是可行的,但是进行ALND或者SLN活检时ARM示踪的淋巴结与SLN淋巴结重叠的患者难以从ARM中获益。上肢的淋巴管道汇聚成几条较粗的淋巴管进入腋静脉,在进行卡纳琳联合核素或荧光染料进行SLN活检术时,可通过在上臂内侧肌间沟的皮下注射亚甲蓝染料进行ARM,操作保护上肢淋巴引流通路。在动物研究中,ARM示踪的淋巴结与淋巴管的分布情况与临床结果相近,同时也存在ARM示踪淋巴结与SLN的交汇。ARM示踪淋巴结与淋巴管的保留条件和保留后能否改善上肢淋巴水肿的发生有待进一步研究。
——淋巴管系统

