内外环境热量共蓄法在腹腔镜直肠癌根治术围术期低体温预防中的应用效果
吴礼华,曾萍,吕小新
(1.兴国县人民医院,江西 兴国 342400;2.兴国县中医院,江西 兴国 342400)
体温恒定是机体维持正常功能的重要保障[1],而全麻手术者常会受低体温影响[2]。导致患者低体温的因素复杂多样,包括麻醉用药所致体温调节中枢的抑制、术中低温液体大量输入以及在低温环境中的长时间暴露等[3-5]。术中低体温易导致患者寒战、切口感染、麻醉复苏延迟甚至心血管疾病发作等,严重影响术后恢复[6-7]。故以积极措施防控全麻手术患者术中低体温成为手术室护理重点任务之一[8]。我们尝试采用内外环境热量共蓄法进行腹腔镜直肠癌根治术全麻手术低体温预防护理,效果较好,报告如下。
1 资料与方法
1.1 一般资料
选择2019年1月—2019年10月行腹腔镜根治术的直肠癌患者90 例,以随机数字表法分为对照组和观察组,每组45 例。对照组男24 例,女21 例,年龄(49.38±9.62) 岁,体质量(55.38±11.62) kg,体温(36.79±0.18) ℃。观察组男25 例,女20 例,年龄(49.66±9.27) 岁,体质量(55.54±11.47) kg,体温(36.32±0.20) ℃。两组患者体质量、年龄、性别、基础体温等一般资料比较,差异无统计学意义(P>0.05),具有可比性。纳入标准:行腹腔镜直肠癌根治术,年龄18~60 岁;知情同意。排除标准:术前高热、低体温;代谢性疾病;术前使用缩血管药物;手术时间预计小于2 h。
1.2 方法
对照组接受外环境热量蓄积干预。手术室温度控制于23~26 ℃,加温毯铺于手术床棉质床单上,患者平卧于加温毯上,通过与加温毯相连的温毯机持续向加温毯内吹入加热气体,加温毯温度控制于38~43 ℃。术中行肛温监测,肛温示37~40 ℃以上时,将鼓风机温度适当调低。观察组接受内外环境热量共蓄法干预。于体外加温基础上加用加温液体体内静脉输注干预,具体实施方式:麻醉完成后,以棉质手术单覆盖于手术消毒范围外的体表区域,将输液管与加温仪加以缠绕,使输液管内流动的液体与加温仪形成持续性的热量交换,从而使输液管内液体温度得以间接提升,提升目标温度控制于37~40 ℃。肛温示37~40 ℃之上时,将加热液体的输入速度调慢。加温器选用BFW-1000型贝斯曼输液加温器。
1.3 评价指标
比较两组麻醉后、术毕、苏醒后10 min、30 min及60 min的体温;比较两组的寒战发生率;比较两组的并发症发生率,包括恶心呕吐、呼吸抑制等。
1.4 统计学方法
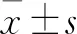
2 结 果
2.1 两组患者各观察点体温比较
观察组患者干预后各观察点体温显著高于对照组,差异有统计学意义(P<0.05)(见表1)。
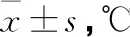
表1 两组患者干预后各观察时间节点体温比较
2.2 两组患者术后寒战和并发症发生率比较
观察组患者干预后寒战与并发症发生率显著低于对照组,差异有统计学意义(P<0.05)(见表2)。
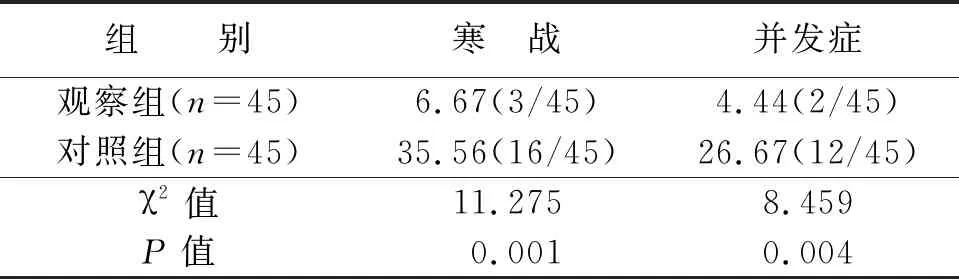
表2 两组患者干预后寒战与并发症发生率比较 %
3 讨 论
围术期低体温是手术患者热紊乱现象的常见类型,发生率可达50%~90%[9]。术中体温过低与手术间室温、医护工作者保暖措施、患者年龄及心理应激等密切相关,术中低体温可能引发系列性不良后果,如切口感染率上升、凝血功能下滑、心功能障碍与心律失常、基础代谢率下降、低钾血症、复苏延时等[10-12]。由此可见,探讨适用与实用的手术患者低体温预防策略至关重要。本研究采用内外环境热量共蓄法对腹腔镜直肠癌根治术者实施保暖护理,研究结果显示,观察组各观察时间节点的中心体温值明显高于对照组。以体外暖风加温举措保暖,手术医师、手术器械等对于手术区域的挤压效应以及保温毯上无菌单的覆盖等,均限制了加温气体对整个保温毯的充溢度,保暖效应有失均衡,加温效果不尽理想[13],且出于避免过热气体所致机体损伤风险,气体温度严格控制在38~43 ℃,所能输出的热量亦较为有限,故单一应用外环境热量蓄积法效果不佳。术时冷液体、温度较低库存血的输入、冷盐水大量反复的体腔冲洗等均会形成“冷稀释”效应而降低患者体温,引发寒战[14]。本研究于体外加温基础上加用加温液体静脉输注干预,加温仪温度设置于37~40 ℃,使输液管与加温仪间形成一定的热量传输温度梯度,输液管内液体可在流动过程中持续获得一定的热量直至输入人体,不存在热量丢失之忧,既可避免冷稀释效应,亦具备良好的加温保暖效果。
寒战系人类个体对于手术及外界环境的应激性反应[15],低体温可引发手术患者的寒战反应。低体温还可对中枢神经系统的调节功能形成一定影响,使机体交感神经处于过度兴奋状态,而胃肠道等受副交感神经支配的系统发生供血不足,患者表现为恶心呕吐等不适反应。内外环境热量共蓄法可持续维护腹腔镜直肠癌根治术患者于较平稳的体温水平,使机体局部组织缺血缺氧状况得以改善,降低机体应激反应的程度,从而降低寒战、恶心呕吐、呼吸抑制等并发症风险。本研究结果显示,观察组腹腔镜直肠癌根治术者干预后寒战与并发症发生率显著低于对照组。

