透骨消痛胶囊调节Ras-Raf-MEK1/2-ERK1/2信号通路抑制骨关节炎炎症反应的机制研究
林木南,邵 翔,许丽梅,张 欣,朱在师,韩一旦,段辛威,陈建梅,高 松,李西海*
1中国人民解放军联勤保障部队第九〇〇医院,福建 福州350025;
2福建中医药大学中西医结合学院,福建 福州350122
骨关节炎(Osteoarthritis,OA)是一种常见的慢性退行性骨关节疾病,是生物力学、生物学、基因遗传等多种复杂因素共同作用的结果,其临床表现为关节疼痛、功能障碍,甚至关节畸形等,主要病理变化为软骨退变、骨赘形成、软骨下骨重塑异常等[1-2]。炎症反应是导致软骨退变的关键因素[3],而Ras-Raf-丝裂原激活蛋白激酶的激酶(mitogenactivated proteinkinase kinase,MEK)-细胞外信号调节激酶(extracellular-signal-regulated kinase,ERK)信号通路在软骨基质降解的过程中发挥关键的调控作用[4-5],也是防治OA的潜在有效靶点。微小核糖核酸(micro ribonucleic acids,miRNAs)是一类非编码的小RNA分子,通过与信使RNA的直接结合,从而起到调控基因表达的作用,参与炎症反应的调控[6]。其中,miR-27b、miR-34a、miR-146a与OA发生发展密切相关,miR-27b可以靶向基质金属蛋白酶(matrix metallopeptidase,MMP)-13,影响软骨基质的降解[7],miR-34a则与炎症因子介导的软骨细胞凋亡相关[8],miR-146a可作为炎症信号通路的负反馈调节器,参与OA炎症反应中[9],均已成为OA的生物标志物和治疗靶点研究的热点问题。
透骨消痛胶囊是福建中医药大学附属第二人民医院院内制剂(批准文号:闽制字Z20100006),具有补肝肾、强筋骨、止痹痛之功,长期应用于临床,疗效可靠。本课题组前期研究显示,透骨消痛胶囊能够抑制OA的炎症反应,但具体作用机制有待深入研究[10]。因此,本研究以脂多糖(Lipopolysaccharide,LPS)诱导软骨细胞炎症反应为OA细胞模型,采用透骨消痛胶囊干预,观察Ras-Raf-MEK1/2-ERK1/2信号通路中关键调控因子表达及miR-27b、miR-34a、miR-146a的变化,旨在揭示透骨消痛胶囊抑制OA炎症反应的作用机制,为临床的应用推广提供实验依据。
1 材料与仪器
1.1 实验动物
4周龄SPF级SD雄性大鼠20只,购于上海斯莱克实验动物公司[生产许可证号:SYXK(沪)2017-0005],由福建中医药大学实验动物中心提供饲养环境及设施[许可证号:SYXK(闽)2019-0007]。本研究中处理实验动物方法符合《关于善待实验动物的指导性意见》。
1.2 实验药物与试剂
透骨消痛胶囊组方:巴戟天12 g,白芍12 g,川芎6 g,肿节风6 g。参照前期透骨消痛胶囊提取方法[11]:14倍量超纯水回流提取药物2次,每次微沸后计时2 h,合并滤液后过滤,旋转蒸发浓缩,完全干燥后称取浸膏使用无菌PBS配制药物母液100 mg/mL,超声溶解后,无菌滤头过滤,4℃保存,备用,实验时根据需要进行稀释。
LPS(美国Sigma公司);显影液、RIPA裂解液、BCA蛋白浓度测定试剂盒(上海碧云天公司);胎牛血清(美国Gibco公司);MMP-3、MMP-13、p-ERK1/2、ERK1/2、MEK1/2、Raf、Ras抗体(美国Abcam公司);羊抗兔、羊抗小鼠(武汉博士德生物公司)。
2 实验方法
2.1 软骨细胞提取与鉴定
采用机械-Ⅱ型胶原酶消化法获得大鼠原代软骨细胞,即麻醉处死大鼠后,取双侧膝关节,手术刀片削取透明软骨层,Ⅱ型胶原酶消化处理,每隔2 h收集消化液,离心后即获得原代软骨细胞,进行培养。待细胞长至培养瓶85%时,进行传代。取第2代软骨细胞,爬片培养后,多聚甲醛固定、0.5%Txiton处理,根据免疫组化试剂盒(武汉博士德公司)试剂说明进行操作,DAB显色液(北京中杉公司)显色,显微镜观察下记录结果。
2.2 软骨细胞分组和干预
取对数期生长的第2代软骨细胞分为4组,参照本课题组前期实验结果[11-12],10 ng/mL LPS诱导建立软骨细胞炎症模型,透骨消痛胶囊最佳干预浓度为300μg/mL。具体干预方法如下:空白组用含10%胎牛血清(fetal bovine serum,FBS)的培养基(dulbecco modified eagle medium,DMEM)培养8 h;模型组用含10 ng/mL LPS的10%FBS DMEM培养8 h;抑制剂组先用含10 ng/mL U0126的10%FBS DMEM干预30 min,再加入LPS培养8 h;透骨消痛胶囊组用含10 ng/mL LPS及300μg/mL透骨消痛胶囊的10%FBS DMEM同时培养8 h。
2.3 蛋白表达检测
各组干预结束后,收集蛋白样本,依据碧云天BCA蛋白定量试剂盒说明进行定量,获取蛋白浓度,变性后,采用蛋白免疫印迹(Western blot)法对蛋白进行处理,显影曝光后获得条带,并选择β-actin作为内参,进行计算分析。每个指标获得3次有效数据后,进行统计分析。
2.4 基因表达检测
各组干预结束后,采用Trizol法提取总RNA,检测RNA浓度。再依据PrimeScriptTMRT reagent Kit试剂盒进行逆转录,取2μL逆转录产物,根据ChamQ®SYBR®qPCR Master Mix说明,上机进行检测,选择GAPDH作为参照指标进行计算,其中引物序列见表1。
2.5 miRNAs表达检测
各组干预结束后,美国Taqman公司mirco-RNA提取试剂盒提取总miRNA,检测miRNA浓度后,依据RevertAid First Strand cDNA Synthesis Kit试剂盒说明进行反转录,取反转录后产物,qPCR法进行检测,分析计算所得数据。

表1 qPCR引物序列Table 1 Primer sequence of qPCR
2.6 统计学方法
3 结 果
3.1 软骨细胞鉴定结果
Ⅱ型胶原组化阳性组细胞胞浆被染为棕黄色,细胞核呈蓝色,阴性对照组细胞胞浆未见明显棕黄色染色,仅有细胞核被染为蓝色,表明所获得的细胞为软骨细胞。见图1。
3.2 软骨细胞蛋白检测结果
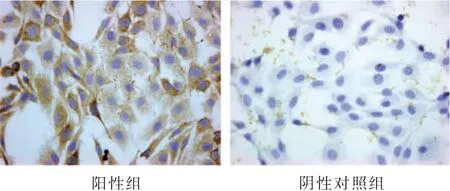
图1 免疫组化鉴定(×400)Figure 1 Identification by using immunocytochemistry(×400)
软骨细胞中Ras、Raf、MEK1/2、MMP-3、MMP-13蛋白表达比较,模型组比空白组明显升高(P<0.01,P<0.05),p-ERK1/2模型组比空白组表达升高,但差异无统计学意义(P>0.05);与模型组相比,抑制剂组与透骨消痛胶囊组Ras、Raf、p-ERK1/2、MEK1/2、MMP-3、MMP-13蛋白表达均明显下降(P<0.01,P<0.05),其中MEK1/2蛋白表达透骨消痛胶囊组比模型组降低,但差异无统计学意义(P>0.05)。见图2和表2。
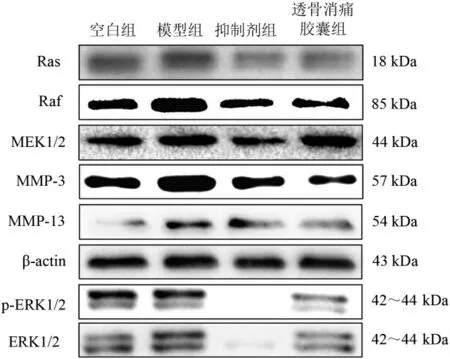
图2 Ras-Raf-MEK1/2-ERK1/2信号通路关键调控因子及MMPs蛋白表达比较Figure 2 Comparison of key factors of Ras-Raf-MEK1/2-ERK1/2 signaling pathway and expression of MMPs protein
表2 Ras-Raf-MEK1/2-ERK1/2信号通路关键调控因子及MMPs蛋白表达比较(±s)Table 2 Comparison of key factors of Ras-Raf-MEK1/2-ERK1/2 signaling pathway and expression of MMPs protein(±s)
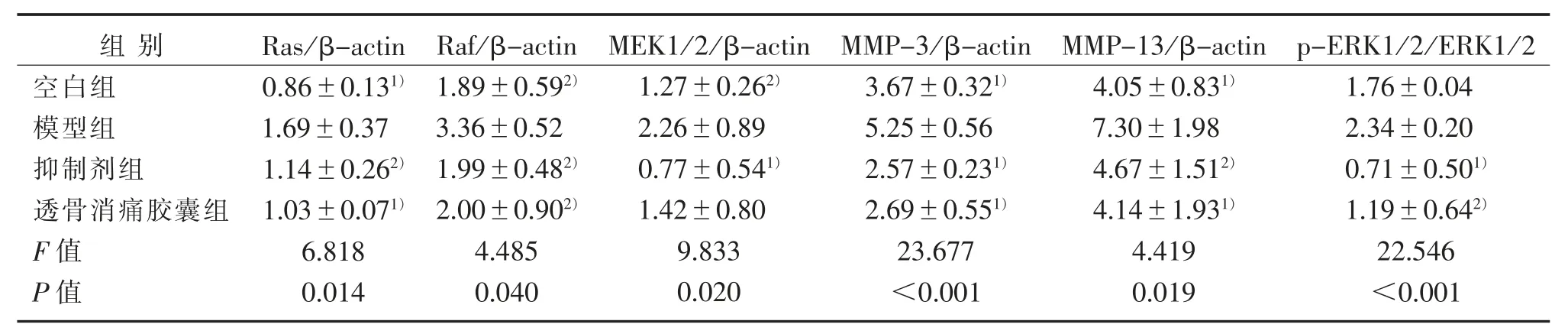
表2 Ras-Raf-MEK1/2-ERK1/2信号通路关键调控因子及MMPs蛋白表达比较(±s)Table 2 Comparison of key factors of Ras-Raf-MEK1/2-ERK1/2 signaling pathway and expression of MMPs protein(±s)
注:与模型组比较,1)P<0.01,2)P<0.05。Note:Compared with the model group,1)P<0.01,2)P<0.05.
?
3.3 软骨细胞基因检测结果
软骨细胞中MEK1/2、ERK1/2、MMP-3、MMP-13基因表达比较,模型组比空白组均明显升高(P<0.01);抑制剂组、透骨消痛胶囊组比模型组表达均降低(P<0.01,P<0.05)。见表3。
表3 MEK1/2、ERK1/2、MMP-3和MMP-13 mRNA表达比较(2-△△CT)(±s)Table 3 Comparison of MEK1/2,ERK1/2,MMP-3 and MMP-13 mRNA expression(2-△△CT)(±s)
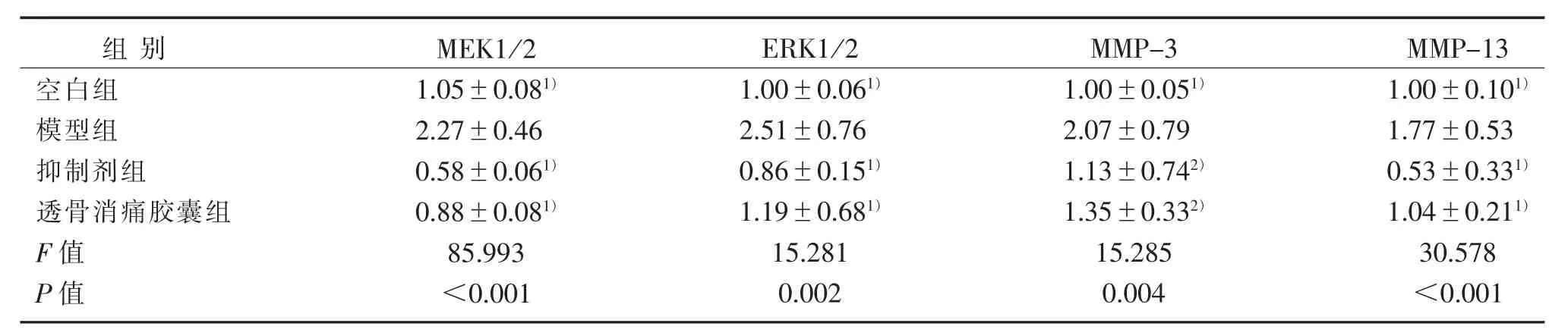
表3 MEK1/2、ERK1/2、MMP-3和MMP-13 mRNA表达比较(2-△△CT)(±s)Table 3 Comparison of MEK1/2,ERK1/2,MMP-3 and MMP-13 mRNA expression(2-△△CT)(±s)
注:与模型组比较,1)P<0.01,2)P<0.05。Note:Compared with the model group,1)P<0.01,2)P<0.05.
?
3.4 软骨细胞mi RNAs检测结果
软骨细胞中miR-27b的表达,模型组低于空白组(P<0.01),抑制剂组、透骨消痛胶囊组均高于模型组(P<0.01);miR-34a、miR-146a的表达,模型组均高于空白组(P<0.01,P<0.05),抑制剂组、透骨消痛胶囊组均低于模型组(P<0.01,P<0.05)。见表4。
表4 miRNAs表达比较(2-△△CT)(±s)Table 4 Comparison of miRNAs expression(2-△△CT)(±s)
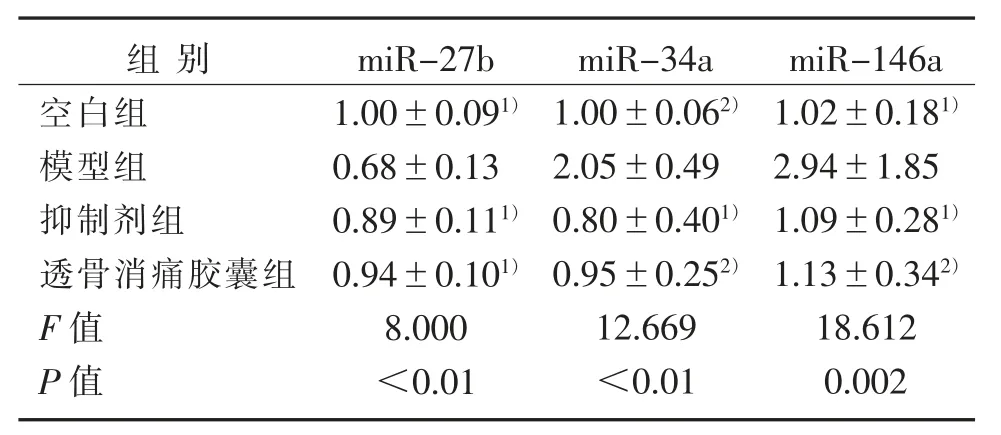
表4 miRNAs表达比较(2-△△CT)(±s)Table 4 Comparison of miRNAs expression(2-△△CT)(±s)
注:与模型组比较,1)P<0.01,2)P<0.05。Note:Compared with the model group,1)P<0.01,2)P<0.05.
?
4 讨 论
OA属于中医学“痹证”“痿证”范畴,病位在肝肾,病在筋骨,以肝肾亏虚、筋骨失养致痿为本,以腠理空虚复感风寒湿邪致痹为标[13]。透骨消痛胶囊由巴戟天、白芍、川芎、肿节风组成,方中巴戟天辛温,补肾强筋,祛风除湿以治本为君药;白芍苦酸,养血柔肝止痛为臣药;川芎辛温,活血行气,祛风止痛,肿节风祛风通络,活血止痛,二者均为佐使药。四药共奏补肝肾、强筋骨、止痹痛之功效,长期应用于临床疗效可靠。
Ras-Raf-MEK1/2-ERK1/2信号通路属于丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路的一部分[14]。当炎症因素刺激细胞后,炎症因子与细胞膜上的受体特异性结合,从而激活MAPK信号下游的Ras-Raf-MEK1/2-ERK1/2信号通路,即经信号传递后,Ras由失活状态转为活化,并进一步活化在胞膜上的Raf,Raf被激活后与信号通路中的“枢纽”MEK结合,从而激活MEK,活化的MEK则与ERK直接联接,激活ERK,使其由胞浆进入胞核,激活转录因子,以此参与调控软骨细胞增殖、凋亡及炎症等生物过程,引起OA软骨退变等病理改变[15-16]。故Ras-Raf-MEK1/2-ERK1/2信号通路是治疗OA的一个潜在途径。LPS则可以通过一系列的级联反应激活相关炎症信号通路,刺激多个炎症因子如肿瘤坏死因子(tumor necrosis factor,TNF)-α、白细胞介素(interleukin,IL)-1等表达,多用于炎症反应的体外研究。本课题组前期实验结果亦表明,10 ng/mL LPS干预8 h可明显刺激TNFα、IL-1β的表达,诱导软骨细胞炎症反应[12]。故本研究中选择LPS作为诱导剂,建立大鼠软骨细胞体外炎症模型进行研究。
MMPs是参与细胞外基质变性降解和OA发病的主要蛋白酶。MMPs家族成员众多,不同的MMPs可作用于不同的软骨基质导致其降解[17]。MMP-13是引起OA软骨退变的众多MMPs中最为关键的酶,在软骨基质的降解中起主导作用,在优先消化Ⅱ型胶原的同时,还能够降解蛋白多糖,加速破坏软骨基质。MMP-3在降解多种胶原和蛋白多糖的同时,激活其他的MMPs,介导结缔组织的重塑。一般情况下MMPs的正常作用可以维持软骨基质的合成与降解平衡,而炎症因子会导致MMPs过度表达,软骨基质降解过度,最终导致软骨病变。
本研究结果显示,经LPS刺激后模型组中Ras-Raf-MEK1/2-ERK1/2信号通路的关键调控因子及MMP-3、MMP-13表达均明显增多,表明LPS诱导软骨细胞炎症反应模型成功建立。透骨消痛胶囊干预 后 则 明 显 降 低Ras、Raf、MEK1/2、ERK1/2的 表达,其趋势同抑制剂组一致,表明透骨消痛胶囊可调控Ras-Raf-MEK1/2-ERK1/2信号通路中关键因子的表达;同时透骨消痛胶囊干预后MMP-3、MMP-13的表达亦减少,表明透骨消痛胶囊可抑制炎症反应介导的软骨基质降解。
在OA中,miRNAs参与调控炎症因子及MMPs的表达,对软骨基质的合成、降解有关键的调控作用[18]。在使用IL-1β诱导软骨细胞后,miR-27b的表达明显降低,并促进Col2a1、抑制MMP-13的表达,从而影响软骨基质的降解,且MMP-13是miR-27b的靶基因之一[7]。miR-34a则与炎症因子介导的软骨细胞凋亡相关,在OA患者软骨中的表达增多[8]。IL-1β作为诱导剂刺激软骨细胞后,miR-34a表达明显增高,并引起细胞死亡和衰老。miR-34a还可以降低Col2a1基因的表达,影响Ⅱ型胶原表达,破坏软骨的合成[19]。miR-146a则刺激多种炎症因子的表达,并受炎症因子的影响。软骨细胞系ATDC5经LPS刺激后,炎症因子IL-1β、IL-6、IL-8和TNF-α的表达和产物增加,miR-146a表达亦明显上升,并且过表达miR-146a后加重了LPS诱导的炎症损伤[9]。另有研究表明[20],miR-146a通过靶向TNF受体相关因子6(Tumor necrosis factor receptor associated factor 6,TRAF6)和IL-1受体相关激酶1(interleukin receptor-1 associated kinase-1,IRAK1)作为促炎信号通路的负反馈调节器,参与到OA炎症反应中。
本研究结果显示,与空白组相比,模型组中miR-27b表达明显降低,miR-146a、miR-34a表达明显升高,而透骨消痛胶囊干预后,miR-27b表达上升,miR-146a、miR-34a的表达下降,说明透骨消痛胶囊可以调控上述miRNAs的表达,通过调控mRNA的起始调控因子,抑制OA炎症反应及软骨基质的降解。
综上,透骨消痛胶囊通过调控Ras-Raf-MEK1/2-ERK1/2信号通路中关键调控因子及miR-27b、miR-146a、miR-34a的表达,调节软骨细胞炎症反应,从而抑制骨关节炎炎症及软骨基质的降解,保护关节软骨。但由于OA的发病机制尚未完全明确,且中药成分复杂具有多靶点的特性,其机制仍需进一步深入研究证实。

